Loading AI tools
ウィキペディアから
脊髄くも膜下麻酔(せきずいくもまくかますい)とは、くも膜下腔に局所麻酔薬を注入し、脊髄の前根、後根をブロックする区域麻酔の一種である。脊椎麻酔(英: spinal anesthesia、ラテン語の spinalis「脊椎/脊髄の」とAnästhesie「麻酔」に由来)または腰椎麻酔(英: lumbar anesthesia、ラテン語のlumbalis「腰部の」から)とも呼ばれる。他にくも膜下ブロック (Sub-arachnoid Block: SAB)と呼ばれることもある。
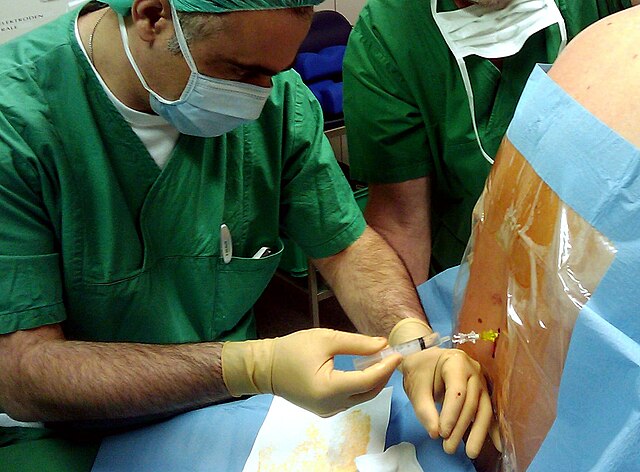
腰椎の間から脳脊髄液中に局所麻酔薬(場合によっては他の薬剤も)を注射することで、脊髄に由来する神経の信号伝達が抑制される。その結果、下半身の交感神経系、感覚神経、運動神経が一時的に可逆的に遮断される。患者の意識は保たれる。起こりうる副作用としては、低血圧、吐き気、背中の痛みなどがあり、硬膜穿刺後頭痛が麻酔後の数日間で起こることがある。重篤な合併症(脊髄に関連した血腫や感染、神経損傷)はまれである。
他の局所麻酔法に比べて、少ない麻酔薬の量で、迅速で強力な麻酔効果が得られる[1]が、通常はカテーテルを挿入しないため麻酔薬の持続投与ができず、短時間の手術に適応が限られる。また、頭蓋内圧亢進時や凝固異常、血小板減少、抗血栓療法中は禁忌となる。
19世紀末、特にアウグスト・ビーアとテオドール・タフィエ(1857-1929)によって臨床に導入されたこの麻酔方法は、麻酔に用いられたコカインの毒性や、麻酔後の酷い頭痛、高い死亡率が問題となり、全身麻酔の進歩とともに麻酔臨床における重要性を失っていった。20世紀半ばより、針の改良による頭痛の軽減、局所麻酔薬の改良による毒性の減少、モニタリングの徹底による死亡率の減少、などにより麻酔法として再評価されるようになった。標準的な麻酔法として、脊髄くも膜下麻酔は今日、下腹部、骨盤、下肢、産科の多くの手術に行われている。これらの手術では、腰部または胸部の硬膜外麻酔など、他の区域麻酔や全身麻酔の代替として、ないしは併用可能である。


人間の脊椎は24個の椎骨からなり[注釈 1][2]、体軸の力学的安定性を確保している。これらは靭帯で連結され、それぞれが椎体、脊髄(図では➀)とその膜を囲む椎弓、2つの横突起、後方(背側)の棘突起からなる[2]。脊髄神経は椎骨と椎骨の間から出ており[3]、身体を分節的に支配し、運動機能と知覚を可能にし[4]、また自律神経系の線維も含んでいる[5]。
中枢神経系の一部として、脊髄は髄膜に囲まれている[6]。内側から外側に向かって、脊髄に直接接している軟膜、くも膜、そして 外側の境界として硬膜である。軟膜とくも膜の間には脳脊髄液腔(くも膜下腔)があり、脳脊髄液が循環している。
脊髄くも膜下麻酔の際、このくも膜下腔は細い中空針(脊椎針)で穿刺される。針は皮膚、椎骨の棘突起間の靭帯(棘上靱帯、棘間靱帯、黄靱帯)を貫通して、さらに硬膜外腔(図の➂)(脂肪組織と血管で満たされ、髄膜の外側にある)を経て、硬膜とくも膜を貫通し、その先端がくも膜下腔(図の➁)で静止する。局所麻酔薬はこの腔内に注入され(髄腔内投与)、脊髄神経の前根と後根に作用し、神経インパルスを伝達する機能を一時的に停止させる[7]。
ヒトの発育過程において、脊柱は脊髄よりも早く成長するため、脊髄は(成人の場合)第1/第2腰椎の脊髄円錐のレベルで終わる[8]が、関連する脊髄神経は足側(尾側)に移動し続け、脊柱管から出てくる。それによって馬尾が形成される。このような状況により、脊髄を損傷することなく中位腰椎のレベルで穿刺することができる[9][10][11]。
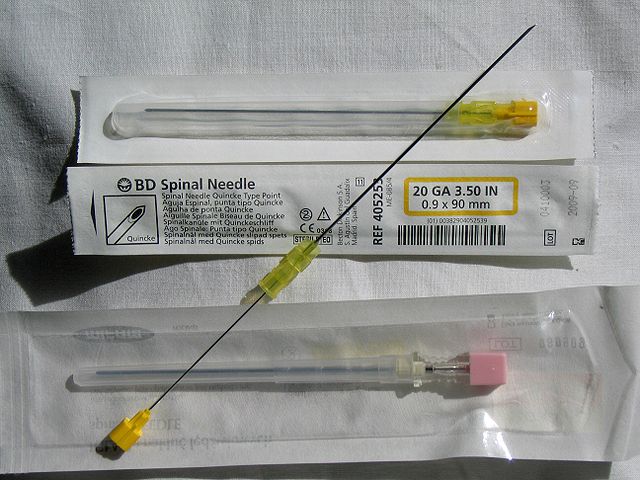

脊椎針とは専ら脊髄くも膜下麻酔ないしは腰椎穿刺に用いられる注射針の一種である。くも膜下穿刺針、脊麻針とも呼ばれる[13]。図に示すように、薬液を注入するために中空の外筒、穿刺時に外筒が詰まったり、くも膜下腔に皮膚組織や靭帯組織を持ち込まないように「フタ」の役目を果たす内筒で構成される[13]。脊麻針は細ければ細いほど、くも膜穿刺に伴う髄液の漏出が少ないために麻酔後の頭痛が起こりにくい[14]。針の太さはゲージ規格で表され、単位の略号は"G"である。太さは22Gから29Gまであり[15]、一番太い22Gでも0.71mm、29Gでは0.31mmである[16]。長さは通常約7cmである[17]。先端形状は鋭利なカッティング針と、スプロッテ針などの先端が鋭利でない針(非カッティング針)とがあり、後者は硬膜損傷が軽微で済むので麻酔後の頭痛の頻度が低いとされる[14]。
脊髄くも膜下麻酔の効果時間は、使用する薬剤によって異なる。局所麻酔薬は、脊髄くも膜下麻酔を行う際に使用される標準的な薬剤である。これらは神経内に拡散し、細胞膜のナトリウムチャネルを遮断し、ナトリウムイオンの流入を減少させる。このようにして、活動電位の形成が妨げられ、神経における信号伝達ができなくなる[18]。

リドカインは、毒性が低いことから1950年代から50年以上、脊髄くも膜下麻酔で好んで用いられてきたが[19]、脊髄くも膜下麻酔に関しては、他の麻酔薬よりもむしろ一時的な神経傷害が高率に生じることが判明し[20]、あまり使われなくなった。ブピバカインは広く使用されている薬剤で、作用時間が長く、リドカインとは対照的に神経毒性の発生率は低いと報告されている。等比重および高比重溶液の両方が製剤として市販されている[21]。メピバカイン[22]、プリロカイン[23]、ロピバカイン[24]なども薬理学的には有効であるが、脊髄くも膜下麻酔を適応とした製剤は日本では2023年現在市販されていない[注釈 2]。プロカインとメピバカインの作用時間は約1時間と比較的短く[26]、外来で行われる短時間の処置に使用するには魅力的である。しかし、エステル型の局所麻酔薬であるプロカインは、アミド型に属する他の局所麻酔薬よりもアレルギー反応のリスクが高い[27]。日本では、かつては、エステル型の0.3%ペルカミンS(ジブカイン)、ネオペルカミンS(ジブカインとパラブチルアミノ安息香酸ジエチルアミノエチル塩酸塩の合剤)も用いられていたが神経毒性を疑われ、現在は販売されていない[28]。他にテトカイン(テトラカイン)も使用されてきたが、日本では2023年度限りで販売終了となる見込みである[29]。
他の薬剤(添加薬)との併用は、局所麻酔薬の効果を長持ちさせ、副作用を軽減することを目的としている。例えば、オピオイドの添加がよく行われている。この目的のために、フェンタニル[30]やスフェンタニル[31]のような脂溶性のものが使用され、脊髄後角にあるオピオイド受容体を介して作用する[32]。かゆみ、吐き気、呼吸抑制といった典型的なオピオイドの副作用が起こることがある。モルヒネなどの水溶性オピオイド誘導体では、呼吸抑制と鎮静作用が強くなるため、患者を長時間モニターする必要がある[33]。クロニジン[34]やケタミン[35]の使用はあまり一般的ではない[36]。アドレナリンは、その効果を延長させるために他の局所麻酔法では添加されるが、脊髄くも膜下麻酔での使用には適さないとされる[37][注釈 3]。
脊髄くも膜下麻酔の効果の程度は、注入された薬剤がくも膜下腔にどのように広がるかどうかに依存する。これは主に、局所麻酔薬の総投与量と比重によって決まる[40]。脊髄くも膜下麻酔に用いられる局所麻酔薬は、髄液と同じ比重を持つ等比重液と、グルコースの添加によってより高い比重を持つ高比重液とに分類される[41]。等比重液の大部分は穿刺部位のくも膜下腔に留まる。しかし、比重はわずかに温度に依存するため、体内での加温により、高比重液よりも拡散の予測が難しくなる[42]。高比重液は重力に従って下方に沈むため、患者の体位によって麻酔薬の広がりをコントロールできる。高位麻酔は頭低位、低位麻酔は頭高位とすることにより達成される。等比重液と同様の広がりは、仰臥位で達成でき、サドルブロックは座位[43]で、側臥位では片側優位の麻酔効果が得られる[44]。低比重液の使用は例外的な場合にのみ行われる[45][46][注釈 4]。
麻酔薬の拡散に影響するその他の因子(決定因子)は、患者個々で変化の大きい髄液量とくも膜下腔の空間的条件である。後者は患者の体格に影響される。肥満、妊娠、腹水など、腹腔内の圧力が高くなると、くも膜下腔が圧迫され、それに応じて投与量を減らさなければならない[46]。注射の速度、注入される総量、局所麻酔薬と髄液の意図的な攪拌(Barbotageと呼ばれる。脊椎針に局所麻酔薬を充填したシリンジを接続し、髄液吸引と髄腔注入を数回繰り返す)は、麻酔の広がりにそれほど影響しない[45]。

脊髄くも膜下麻酔では、注射針が硬い髄膜(硬膜)を貫通するため、注入された局所麻酔薬はクモ膜下腔の脳脊髄液中に自由に広がり、神経線維がそこで麻酔される。一方、硬膜外麻酔では、硬膜に穴を開けない。カテーテルは硬膜の外側の硬膜外腔に挿入されるため、局所麻酔薬は主に髄膜の外側で脊髄からつながる脊髄神経に作用する。脊髄くも膜下麻酔では、麻酔が効いているレベルより下のすべての神経線維、つまり下半身全体が薬剤の髄液中への広がりにより麻酔されるのに対し、硬膜外麻酔では、穿刺レベルの対応する皮膚分節を中心に麻酔効果が及ぶ[47]。脊髄くも膜下麻酔では歩行は不能もしくは困難となるが、硬膜外麻酔では歩行は可能である[注釈 5]。脊髄くも膜下麻酔では最小量の局所麻酔薬で強力な鎮痛効果が得られるが、硬膜外麻酔では同等の鎮痛を得るためには大量の局所麻酔薬が必要となる。例えば、帝王切開に対する局所麻酔薬ブピバカインの用量は脊髄くも膜下麻酔では、7.5-12.5mgであるのに対して、硬膜外麻酔では100-150mg[30]と10倍以上の量が必要になる。
腰椎穿刺では、脊髄くも膜下麻酔とほぼ同じ方法でくも膜下腔を穿刺する。腰椎穿刺は、髄液圧の測定や診断用髄液サンプリングに使用され、中枢神経系の感染症や転移が疑われる場合や抗体診断のために行われる[48]。化学療法では、腰椎穿刺によって抗癌剤が髄腔内に注入されることもある[49]。

脊髄くも膜下麻酔は通常、1回の注射(シングルショット)で行われる。感覚ブロックの範囲によって、低位(皮膚分節Th12以下、鼠径部レベル)[50]、中位(分節Th4~分節Th10まで、剣状突起のレベル)[50]、高位(分節Th4以上[51]、乳首レベル)に区別される。脊髄くも膜下麻酔の特殊な形態として、主に陰部領域(S2-5)を支配する仙骨神経を標的として行われるサドルブロックがある[50]。
あまり一般的ではないが、脊髄くも膜下麻酔では、カテーテルを挿入することで、薬剤を連続的に投与することもできる(持続脊髄くも膜下麻酔、Continuous Spinal Anesthesia: CSA)[52]。もう一つの派生手技としては、脊髄くも膜下麻酔と硬膜外麻酔の併用(脊髄くも膜下併用硬膜外麻酔、Combined spinal epidural anesthesia: CSEA)がある。この場合、硬膜外麻酔針の中から脊椎針を進め、脊髄くも膜下麻酔を行う[注釈 6]。その後、硬膜外カテーテルを硬膜外腔に挿入する。このカテーテルから、必要に応じて薬剤を投与することができ、また効果的な術後疼痛治療が可能となる[53]。

脊髄くも膜下麻酔は標準的な麻酔法で、比較的簡単に行うことができ、すぐに効果が現れ、痛みを完全に取り除くことができる[1]。下腹部の外科手術(鼠径ヘルニア手術など)、骨盤部の婦人科手術や泌尿器科手術、下肢の整形外科手術、外傷の手術、血管手術などに使用できる、全身麻酔や硬膜外麻酔の代替となり得る麻酔法である。持続脊髄くも膜下麻酔は、術後の疼痛治療を継続できる可能性もある[注釈 7]。一方、脊髄くも膜下麻酔は、上腹部や胸部より高位の手術には適さない[54]。
産科では、帝王切開のための脊髄くも膜下麻酔は標準的な手技である。ドイツでは1990年代まで全身麻酔が主流であったが、2005年までには脊髄くも膜下麻酔が優先される麻酔法として明確に定着した[注釈 8][55]。脊髄くも膜下麻酔は、妊婦の全身麻酔に伴う誤嚥リスクの増大を回避できる。しかし、緊急分娩で脊髄くも膜下麻酔や硬膜外麻酔が十分に効果を発揮するまでの時間が待てない場合は、全身麻酔が依然として必要である[56]。
脊髄くも膜下麻酔は、悪性高熱リスク(死亡率の高い全身麻酔合併症)のある患者において、このような合併症を回避する方法のひとつである。また、気道確保が困難であることが予想され、かつ患者が絶食状態でない場合には、全身麻酔よりも脊髄くも膜下麻酔を優先したほうが良い[54]。閉塞性肺疾患(気管支喘息、COPD)のある患者も、全身麻酔を回避した方がよい[57]。
脊髄くも膜下麻酔がさまざまな合併症(深部静脈血栓症、肺塞栓症、出血、肺合併症)の発生率を低下させ、死亡率も低下させる可能性があるとの指摘がある[58]が、決定的な評価を行うにはデータが不十分である。脊髄くも膜下麻酔が、重度の心疾患や肺疾患の既往歴(Past medical history)を持つ患者にとって利点があるかどうかも議論の的となっている[59]。全身麻酔に対する優位性はまだ証明されていない[60]。
絶対禁忌は、使用する麻酔薬に対するアレルギー、穿刺部位の局所感染、未治療の全身感染症(菌血症)、未治療の循環血液量減少、頭蓋内圧亢進、遺伝的凝固障害や抗血栓療法による明らかな出血傾向(下表参照)である[61]。このような抗血栓薬による治療は、脊髄くも膜下麻酔を行う前に4時間(未分画ヘパリン)または、12時間(予防的低用量の低分子量ヘパリン)または24時間(治療的用量の低分子量ヘパリン)中断しなければならない。クロピドグレルは7日前から、チクロピジンは10日前から中止し、クマリン系薬剤(ワーファリンなど)服用後はPT-INR<1.4に達していなければならない。低用量(1日100mgまで)のアセチルサリチル酸単独による治療では、かつては休薬期間を設けていたが、もはや休薬する必要はない(ドイツ麻酔科学・集中治療医学会(Deutschen Gesellschaft für Anästhesie und Intensivmedizin: DGAI)の勧奨)[62]。
血小板の不足(血小板減少症)は出血性合併症のリスクを高める。脊髄くも膜下麻酔を実施できる絶対的な下限は、専門学会によって異なる。むしろ、血液凝固の全体的な状況を考慮しなければならない[63]。ドイツのガイドラインでは脊髄くも膜下麻酔の前に血小板濃縮製剤を輸血して血液中の血小板数を増加させることは、50,000/μl未満の値から推奨されており、これを下限値の目安とすることができる。脊髄くも膜下麻酔より太い針を使用する硬膜外麻酔では、80,000/μl未満で血小板輸血が推奨されている[64]。一方、日本のガイドラインでは、血小板数に関しては100,000/μl以上が望ましいとされ、50,000/μl未満では非推奨とされるものの輸血に関しては記載されていない[65]。
相対的禁忌には、慢性背部痛、抗生物質治療中の全身感染、強直性脊椎炎、重症の大動脈弁狭窄症またはその他の心臓弁膜症、脊髄空洞症、肺高血圧症が含まれる[61]。これらの疾患では、脊髄くも膜下麻酔の有益性と危険性を秤にかける必要がある[61]。
| 薬剤名 | 穿刺前の休薬期間 | 穿刺後の再開時間 |
|---|---|---|
| 未分画ヘパリン | 4–6時間[66][67] | 1時間[66][67][68] |
| 低分子量ヘパリン予防的投与量 | 12時間[66][67][68] | 4時間[66][67] |
| 低分子量ヘパリン治療的投与量 | 24時間[66][67] | 4時間[66][67] |
| フォンダパリヌクス | 36–42時間[66][67]
36時間[69] |
6–12時間[66][67] |
| ワーファリン | PT-INR < 1.4[66][67]
PT-INR ≦ 1.2[70] |
直後より[66][67] |
| クロピドグレル | 7日[66][67][68] | 直後より[66][67] |
| プラスグレル | 7–10日[66][67] | 6時間[66][67] |
| チクロピジン | 10日[66][67]
14日[68] |
直後より[66][67] |
| アブシキシマブ | 48時間[66][67] | 4時間[66][67] |
| チロフィバン | 8時間[66][67] | 4時間[66][67] |
| プロスタサイクリン | 0,5時間[66][67] | 直後より[66][67] |
| ダビガトラン | > 34時間[66][67]
5日[68] |
4–6時間[66][67] |
| リバーロキサバン | 22–26時間[66][67]
3日[68] |
4–6時間[66][67] |
| アピキサバン | 26–30時間[66][67]
3日[68] |
4–6時間[66][67] |
| チカグレロル | 5日[66][67] | 6時間[66][67] |
| シロスタゾール | 42時間[66][67]
3日[68] |
5時間[66][67] |
| ジピリダモール | 48時間[66][67] | 直後より[66][67] |
| アセチルサリチル酸 | 休薬不要[66][67][68] | 休薬不要[66][67][68] |
他の麻酔法と同様に、事前に患者と麻酔科医との間でインフォームド・コンセントの場が持たれる。合併症や十分な効果が得られない場合には、麻酔法を全身麻酔に変更しなければならないこともあるため、手術当日は絶飲食が必要である[71]。手術前の前投薬として、気持ちを落ち着かせ緊張を和らげる薬(鎮静剤)が投与されることもある。
緊急用の医薬品や器材を準備した上で[72]、静脈路を確保する[73]。脊髄くも膜下麻酔は座位または側臥位で行う[74]。座位では、助手が患者を前方から支える[43]。患者は基本的なモニター(心電図モニタ、パルスオキシメトリー、血圧測定)により継続的に監視される[75]。

脊髄くも膜下麻酔を行うには、第2腰椎と第3腰椎(L2/L3)または第3腰椎と第4腰椎(L3/L4)の間に脊椎針を穿刺する[76]。複数回の消毒と局所浸潤麻酔の後、無菌手技で2つの棘突起の間に針を刺入する。穿刺は、棘突起の平面に対して後方からまっすぐ(正中法)、または10°のわずかな側方偏位(傍正中法)で行われる[77]。あるいは、第5腰椎と第1仙椎間はTaylorによる側方アプローチと呼ばれる手技もあり、この場合、針は後上腸骨棘の1cm内側かつ下方に刺入し、頭側・内側に45°~55°の角度をつける[78]。
背中を丸める(いわゆる猫背)ことで棘突起間の距離を広げることができるため、患者の協力は重要である[74]。特に高齢者では、骨化した靭帯が細い針の前進の妨げとなる。このため、太いイントロデューサー針を使用することも多い[79]。これが靭帯構造を貫通したら、そこから実際の細い穿刺針を挿入し、クモ膜下腔に穿刺する。穿刺針が神経根に触れると、穿刺中に足に短時間のしびれ(パレステジア)が生じることがある[80]。針が硬膜を通過すると、透明な脳脊髄液が針から滴り落ち、針が正しく刺入されたことが分かる。
シリンジで局所麻酔薬を注入する前に、透明な髄液が脊椎針から流出し続けることを確認しておくべきである[81]。血の混じった髄液(血管の穿刺が疑われる)や髄液の流出がない場合は、脊椎針を抜いて再度挿入する必要がある[82]。くも膜下腔に適切な量の局所麻酔薬を注入した後、効果はほとんどすぐに現れ、脚や臀部が温かくなる感覚から始まる。数分以内に、感覚低下と無痛が現れ、可動域が制限される[83]。一方、この最初の5分間は「魔の時間」と称され、自律神経のバランスが崩れることによる呼吸、循環の激変が生じやすく、厳重なモニタリングが必要である[83]。
「麻酔範囲の決定要因」の節で述べたようにデルマトームを参考に、麻酔範囲の判定を行う。高比重液の場合、くも膜下腔に局所麻酔薬を注入してからの麻酔領域の広がりは分単位で変化するため、麻酔効果判定を頻回に行う必要がある[83]。高比重液を使用すれば、患者の体位によって麻酔領域の広がりを調節できる(中・高位麻酔、サドルブロック、左右どちらかの片効き麻酔)[84]。しかし、麻酔領域が脊髄高位に波及しすぎると、呼吸困難が生じる[85]。胸髄レベルの麻酔で同部位からの神経支配を受ける肋間筋の筋力低下が起こる。さらに麻酔領域が高位の頚髄レベルに及ぶと、第4頚神経の分枝である横隔神経が麻痺し、横隔神経に支配される横隔膜までが麻痺する可能性がある[85]。実際は、横隔神経は強大な運動神経であるため、脊髄くも膜下麻酔に用いられるような少量の局所麻酔薬では、横隔膜運動が停止するほどの麻痺は稀であるとされる[86]。脊髄くも膜下麻酔に合併する呼吸停止は低血圧に伴う延髄呼吸中枢への血流低下が主因とされる[86]。上肢の筋肉の運動支配は大半が頚神経なので、上肢に麻酔効果が及べば、肩から下位は既に麻酔効果が及んでいる(皮膚分節を参照)。麻酔薬によるブロックは細い神経線維から順に効果が現れることが知られており、交感神経、温覚、痛覚、触覚、圧覚、運動神経という順にブロックされていく[87]。痛覚の判定を行うピンプリックテスト、温覚の判定を行うコールドサインテスト、運動神経の判定を行うBromageスケールが有名である。必要なレベルの麻酔効果が得られなかった場合は再びくも膜下腔を穿刺し麻酔薬を追加するか、他の麻酔方法(多くは全身麻酔)に切り替える[42]。
麻酔薬を注射した後、使用する薬剤と手術部位にもよるが、1~4時間は手術が可能である[90]。ストレス軽減のため、適切な薬剤(主にミダゾラムなどのベンゾジアゼピン系)の静脈内投与により、患者は鎮静されることもある[90]。脊髄くも膜下麻酔の「固定時間」という以前の概念は現在では時代遅れと考えられており、注入された麻酔薬がくも膜下腔内で上昇することにより合併症が生じる可能性があるため、手術の全期間中、専門スタッフとモニタリングによって患者を監視する必要がある。手術が終了すると、脊髄くも膜下麻酔の効果がある程度回復するまで、麻酔後回復室(Post-anesthesia care unit: PACU)でモニタリングを継続する[91][92][93]。
脊髄くも膜下麻酔で比較的よくみられる副作用は、低血圧[94]、徐脈[94]、背部痛[79]、吐き気[95]、嘔吐[95]のほか、術後の硬膜穿刺後頭痛や尿閉である。これらの問題は通常、継続的なモニタリングにより麻酔科医がすぐに気づき、後遺症なく治療される[96][97]。
重篤な循環障害や、直接的な損傷、感染、出血による永続的な神経損傷などの重篤な合併症はまれな事象である。これらの頻度を決定することは困難である。問題点としては、十分な患者数を有する研究がないこと、これらの研究における損傷の定義が不正確で多様であること(異質であること)、手術手技自体、体位、既存の(おそらく未知の)疾患、または自然発生的な事象(出血、感染)など、他の可能性のある損傷機序との鑑別がしばしば困難であることなどが挙げられる[98][99]。

動脈血圧の低下(低血圧)は脊髄くも膜下麻酔の最も一般的な副作用で、多くの患者に起こる。これは、下半身の交感神経系の麻酔(交感神経遮断)[100]により血管が広がり(血管拡張)、循環血液量が相対的に減少するため、心臓への還流量が減少することによる[101]。脊髄くも膜下麻酔の広がりが大きいほど、血圧降下作用は顕著になる。心拍数の低下(徐脈)や吐き気を伴うこともある。
この血液低下は、特に循環血液量減少の患者に顕著であるため、晶質液を脊髄くも膜下麻酔を行う前に予防的に点滴静脈注射し、このような循環血液量の不足を補う。出血、体位変換操作、駆血帯解除も低血圧を助長する[102]。低血圧の治療には、点滴による循環血液量増加、頭部をわずかに下げる(トレンデレンブルグ位)[103]、必要であれば薬物投与を行う。カフェドリン・テオドレナリン(商品名アクリノール)、エフェドリン[104]、フェニレフリン、またはまれにノルアドレナリンなどのカテコールアミン誘導体が使用される。徐脈の場合は、アトロピンまたはオルシプレナリンも使用される[105]。血圧または心拍数の障害は通常、効果的に治療できるが、心停止に至るような重症型が起こることはまれである(約3/10,000)[106]。
硬膜穿刺後頭痛(Post Dural Puncture Headache: PDPH)は脊髄くも膜下麻酔の不快な副作用の一つであるが、通常予後は良好である。その発生機序は、硬膜の穿孔部位からの脳脊髄液漏出による[107]。脳脊髄液はこの漏出部から漏出し、漏出量が産生量を上回ると脳脊髄液腔に陰圧が生じる。痛みに敏感な脳の構造(髄膜、血管、大脳鎌)の牽引、代償的な血管拡張などが組み合わさって、頭痛が生じると推定されている[107]。この症候群は、アウグスト・ビーアによる脊髄くも膜下麻酔の報告ですでに言及されていた(1899年、下記参照)。
頭痛は、使用した脊椎針にもよるが、25Gのクインケ針で3-25%、Whitacre針で0-14.5%と、非カッティング針で発生率が低い[107]。頭痛の90%は処置後3日以内に、66%は最初の48時間以内に発症する[107]。患者が横になっているときに改善し、座ったり立ったりしたとき、または患者が頭を振ったり腹圧が高まったりしたときに悪化する。穿刺後の頭痛は、吐き気、嘔吐、めまい、項部硬直、背部痛、光や音に対する過敏症、複視や視覚障害の発生(第3、4、6脳神経の刺激による)[108]、聴力低下や耳鳴りを伴うこともある[109]。
治療は主に、安静、十分な水分補給、鎮痛剤による保存的治療が行われる。これらの措置が奏功しない場合は、さまざまな侵襲的治療法が用いられるが、硬膜外自己血パッチはその中で最も選択される方法と考えられており、奏功率は八割を超える[110]。これは、患者から血液を無菌的に採取し、腰椎穿刺部位のレベルで再度穿刺し、血液を硬膜外腔に注入するものである。これにより髄膜の穿孔が圧迫され、閉鎖される。
硬膜穿刺後頭痛の予防のための最も重要な対策は、非カッティング[注釈 9](ペンシルポイント先端)の可能な限り細い穿刺針を使用することである。この針は、直径が大きく、先端が斜めに研磨されたカッティング針(クインケ針など)に比べて、頭痛の発生率がはるかに低い(0.5~1%)[111][112]。1979年に導入されたスプロッテ針の非カッティング先端は、麻酔科医でペインクリニック医のGünter Sprotte(1945年生)がPajunk社と共同で開発したものである[113]。
神経の損傷は、脊髄くも膜下麻酔による一次的損傷と二次的に生じる損傷とに分類することができる。一次的損傷の機序は、注射針による機械的損傷または注入された溶液の神経毒性により、二次的な損傷機序は、感染症および体内の空間を占有する性質の出血(腫瘤効果(Mass effect)、下記参照)であり、これらは神経を圧迫することによって損傷を引き起こしうる[114]。
手術後に起こる神経損傷は、脊髄くも膜下麻酔による針損傷によるものはまれであり、手術体位(Surgical positions)、手術そのもの、または既往歴(Past medical history)などの独立した要因の結果であることが多い。脊髄くも膜下麻酔による脊髄神経損傷の発生率は3.8/10,000と推定され、その多くは可逆的である[98]。
一過性神経症状(Transent Neurological Symptoms: TNS)とは、脊髄くも膜下麻酔後に脚に放散する左右対称の臀部痛[115]のことで、通常、麻酔後数時間以内に始まり、数日以内にまた収まる。これは局所麻酔薬の毒性によるもので、患者の約1%にみられる[注釈 10]。しかし、リドカインを使用した場合、その割合は有意に高くなる[116][117]。
まれに起こる馬尾症候群(0.02-0.16/10,000)[98]の原因も、局所麻酔薬の神経毒性による。下肢の脱力、排尿・排便障害、生殖器の感覚障害が臨床徴候である。この障害はしばしば永続的である[114]。
針を脊柱管に進める際に血管を損傷すると、硬膜外腔又は脊柱管内での出血を引き起こすことがある。しかし、このような方法で腔内血腫が生じることは非常にまれであり、その頻度は1:220,000と推定される[118]。凝固障害に罹患している患者や抗血栓薬を服用している患者では、リスクがわずかに増加する(約160,000分の1)[118]。臨床的には、血腫による圧迫レベル以下の、反射消失、筋力低下、感覚障害が顕著であり、脊髄くも膜下麻酔の効果が消失した後に判明する。脊髄出血は永続的な神経損傷を引き起こす可能性があるため、疑わしい症例ではMRI検査を実施し、診断を確定する必要がある[119]。出血による神経の圧迫が確認された場合は、ただちに外科的治療(椎弓切除術)を行わなければならない[119]。予防法としては、出血を避けるために、抗血栓薬の投与と脊髄近傍の穿刺の間には一定の間隔を空けなければならない(上表参照)[62][114][120]。
一回法の脊髄くも膜下麻酔(持続法ではなく)後の感染性合併症は非常にまれである[121]。考えられる原因は、既存の感染症からの菌の拡散、汚染された脊椎針や不十分な無菌手技による穿刺で、病原体がくも膜下腔や硬膜外腔に侵入することである。起こりうる症状は、髄膜の炎症(髄膜炎)と硬膜外腔(硬膜と骨膜の間)の膿瘍の形成である。頻度に関する信頼できる数値は得られていない。カテーテル処置のリスクは大きく異なり、1:1,000~1:100,000と推定されているが、一回穿刺で発生することはまれである。脊髄くも膜下麻酔と無関係に発生する膿瘍(1万分の0.2~1.2)との鑑別は困難である[121]。最も一般的な病原体はブドウ球菌であり[121]、この細菌は皮膚細菌叢において高率に常在していることから、穿刺部位の徹底的な消毒と穿刺の際の厳密な無菌手技の重要性を示している[122]。
髄膜炎は通常、麻酔から数日後に発熱、項部硬直(髄膜刺激症状)、頭痛、吐き気などの症状が現れる[122]。疑いがあれば、的を絞った抗生物質療法で治療できるようにするために、髄液検査によって病原体を特定しなければならない[122]。極めて稀に起こる無菌性髄膜炎は、病原体が検出されない特殊な型である。その原因としては穿刺器材の洗浄物質に対する炎症や過敏反応の可能性が報告されている[123]。
硬膜外膿瘍は重篤な合併症である。症状はさまざまで、発熱、背部痛、神経障害などがある[121]。高感度な診断法として、特に画像診断(MRI)がある。治療的には抗生物質が使用され、ほとんどの症例で早期の外科的治療が必要である[121]。症例の3分の1には重篤な神経障害が残り、さらに3分の1には軽度の神経障害が残る。敗血症の発症による死亡率は約10~15%である[114][121][124]。
背部痛は患者の約13%が報告する[125]が、手術、体位との因果関係は難しい。尿閉は、用いられる局所麻酔薬の種類と濃度によって、程度と時間が異なる[126]が必発である[127]。原因は、膀胱を空にする働きを持つ交感神経系の抑制的影響と、その逆の働きをもつ副交感神経系の促進的影響の不均衡である[128]。治療には、滅菌使い捨てカテーテル留置が必要な場合がある[127]。
重篤な副作用は、薬が過剰投与された場合など、脊髄くも膜下麻酔が脊髄の高位に効きすぎることである。麻酔効果がくも膜下腔全体に広がると、全脊髄くも膜下麻酔(全脊麻)と呼ばれる[129][130]。意識障害、呼吸停止が起こることがあり、必要であれば気管挿管と人工呼吸、カテコラミン療法を行わねばならない[130]。適切な治療により、通常は完全回復が可能である[131]。
脊髄くも膜下麻酔の技術的失敗(穿刺困難、針の曲がり、ごくまれに針の破損)は、脊椎針の直径に直接依存する。標準的な針(25ゲージ)では、この割合は5%未満であるが、針が細くなると増加する。針の太さが大きいほど穿刺後頭痛の発生率が高くなるため、脊髄くも膜下麻酔の成功率と合併症はトレードオフの関係にある[96][97]。
腰部髄液腔の最初の穿刺は、1891年にキールの ハインリヒ・クインケが行ったが、これは髄液の診断サンプリングのためであった。彼は、この目的のために先端を斜めにカットした穿刺針(クインケ針)を開発した[132]。

1898年8月24日、同じくキールで、外科医アウグスト・ビーアと助手のアウグスト・ヒルデブラント(1868~1954)が、コカインを注射する相互実験で脊髄くも膜下麻酔に成功した[133][134]。 コカインを注射した結果、「脛に鉄のハンマーで強い打撃」や「睾丸を強く押したり引っ張ったり」しても、痛みを感じなくなった。その後、両者とも吐き気と嘔吐を伴う激しい後頭部痛を発症した[135]。

米国のジェームズ・レナード・コーニング(James Leonard Corning)は、ビーアらの発表の13年前の1885年にすでに同様の実験を行っており、脊髄に近い組織にコカインを注射し、脚と生殖器のしびれが観察された[136]。この過程で脊髄くも膜下麻酔が達成されたのか、それとも薬剤がその手前の靭帯組織投与されたのかは議論の余地がある(後年、コーニングが行ったのは脊髄くも膜下麻酔ではなく、硬膜外麻酔であったことが示された[137])。1898年に動物実験で脊髄くも膜下麻酔を研究したことをビーアは1899年に発表した[138]。しかし、ビーアの助手であったヒルデブラントは同年にビーアの元を去り、その後はビーアの脊髄くも膜下麻酔における功績を否定するような発表を繰り返した[135]。ビーアが最初の発表の際にコーニングの業績を引用、記載しなかったこともあり、脊髄くも膜下麻酔に最初に成功したのはビーアとコーニングのどちらであるかに関して、論争となった[135]。今日では、コーニングは脊髄くも膜下麻酔の実験的・理論的前提条件を作り上げたと評価され、ビーアは脊髄くも膜下麻酔の臨床への応用とその後の定着に成功したと評価されている[135]。
脊髄くも膜下麻酔を最初に行ったアメリカ人はサンフランシスコの外科医ダドリー・テイト(Dudley Tait)、グイド・E・カグリエリ(Guido E. Caglieri)[139]、ニューオーリンズの血管外科医ルドルフ・マタス(Rudolph Matás、1860-1957)で、1899年に[140]フェリックス・A・ラルー(Felix A. Larue)、 ヘルマン・B・ゲスナー(Hermann B. Gessner) そしてキャロル・アレン(Carroll Allen)の協力を得て痔核手術に実施した[141][142]。
フランス人のテオドール・タフィエ(Théodore Tuffier)(1857-1929)は、1899年に泌尿生殖器の外科手術に脊髄くも膜下麻酔を推奨した[143][144]。フランスのピエール・マリー(Pierre Marie)、ジョルジュ・ギラン(Georges Guillain)、シャルル・アシャール(Charles Achard)などの医師も、坐骨神経痛や腰痛のような腰部や下肢の神経痛の治療にコカインのくも膜下注射を行っていた[145]。
コカインは麻酔に用いられはじめた当初から毒性の高さが問題視され、1903年にフランスのエルネスト・フルノー(Ernest Fourneau)による局所麻酔薬ストバイン、1928年のEislebによるテトラカインなど、毒性の低い様々な合成局所麻酔薬が開発されると共に、髄液より高い比重の薬液を用いる(1930年、McLellland)ことによって麻酔範囲の調節が容易となり、脊髄くも膜下麻酔の安全性は高まっていった[146]。
20世紀初頭、脊髄くも膜下麻酔はいったんは産科医療に定着した。しかし不慣れな医師が、モニタリングを軽視してこの麻酔を頻繁に行った結果、合併症が頻発し、この麻酔法に対する信用が失墜した[147]。当時、脊髄くも膜下麻酔後の死亡率は1/1000であり、局所麻酔や全身麻酔よりも遙かに高率であり、帝王切開の死亡率に至っては1/139であると報告された[147]。産科麻酔を専門とした医師グリーンヒルは妊婦に対するあらゆる麻酔の中で最も危険であると結論づけた[147]。分娩は「自然分娩」や「精神予防法」が推奨され、1950年代までのこの時代は、後世、「産科麻酔の暗黒時代」と呼ばれた[147]。しかし、24時間体制の産科麻酔サービスが1940年から1950年の間にアメリカで確立されるとともに、脊髄くも膜下麻酔の身体に及ぼす影響が解明され、安全性は向上していった[147]。今日では、帝王切開を行う際には脊髄くも膜下麻酔または硬膜外麻酔が標準的な処置となっている[148]。
1951年、WhitacreとHartが先端が鈍な脊椎針、ペンシルポイント針を開発した。この針が臨床に導入されたことで、それまでかなりの割合の患者が経験していた脊髄くも膜下麻酔後の頭痛の割合が大幅に減少した[149]。
手術中に穿刺部位に脊椎針を残す最初の持続脊髄くも膜下麻酔は、外科医H. P. ディーンによって1907年にはすでに行われていた[150]。1940年代にカテーテルを残す方式に改良されたが[79]、カテーテルを入れるためには通常よりも太い針でくも膜を穿刺せねばならず、硬膜穿刺後頭痛が重症化する懸念があった。十分に細いカテーテルの開発によってこの手技が確立され、許容できるほど低い硬膜穿刺後頭痛の発生率が達成されるようになったのは、1980年代になってからであった[79]。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.