好中球
白血球の一種 ウィキペディアから
好中球(こうちゅうきゅう、neutrophil、neutrophile)は、白血球の一種である。

概要
好中球は5種類ある白血球の1種類で、3種ある顆粒球の1つ。中性色素に染まる殺菌性特殊顆粒を持つ顆粒球である。盛んな遊走運動(アメーバ様運動)を行い、主に生体内に侵入してきた細菌や真菌類を貪食(飲み込むこと)殺菌を行うことで、感染を防ぐ役割を果たす。
骨髄で作られ、成熟する。
好中球は炎症性サイトカインや細菌・真菌類の成分に対し遊走性を示し、炎症部に集合し、細菌・真菌などの異物の貪食・殺菌・分解を行い生体を防御する。
貪食された細菌類は、それを含む食胞が細胞内器官であるリソソーム(ライソゾーム)と融合することで、リソソーム内の酸素依存機序により殺菌され、加水分解酵素により分解される。好中球は成熟の段階によって核の形状が異なり、桿状核球(杆状核球)と分葉核球に分類できる。血液中の白血球の半数以上が好中球である。
形状
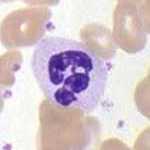
無色半透明のおおむね球状であるが、偽足を出し盛んにアメーバ様運動をするので形は定まっていない。標準の血液細胞染色であるギムザ染色で中性色素に染まる特殊顆粒を持ち、成熟すると核が分かれる(分葉)ので、「多形核白血球」と呼ばれることもある。最終完成形の好中球は「分葉核球」と呼ばれ、核は分かれるが、核の間は核糸で繋がっている。分葉核球になる前には核が大きく曲がったジェリービーンズ様の桿状である段階がある(桿状核球)。好中性顆粒はリソソーム(ライソゾーム)の一種であり、ゴルジ体(内網装置)で作られる。直径は12〜15μm[1]であり、白血球の中ではリンパ球より大きく、単球・マクロファージより小さい[2]。
数量・寿命
末梢血内には1マイクロリットル当たり2,000から7,500個程度の好中球が含まれ、成人の末梢血内には概ね10の10乗個のオーダー(桁)の好中球が存在する[3]。体重50kgの場合でおおよそ80億個から300億個程度の数量である。
しかしながら、好中球は血管壁や脾臓・肝臓などにも末梢血内に匹敵する量の好中球が辺縁プールとして存在する[4]。さらに、骨髄には、末梢血内の10から30倍もの量の貯留プールが存在し、生体内すべてでは10の11乗のオーダー、数千億個の桁の好中球が存在する[4]。
大きな貯留プールがあるため、細菌感染時などには貯留プール内の好中球が動員され、末梢血内の好中球数は速やかに増加する。また、食事や運動、ストレスなどのわずかな体の変化でも、その血流量の変化によって血管壁に滞留などで辺縁プールに存在していた好中球が末梢血内に移動するので、好中球数は変化しやすい。感染が無い時でも一部の好中球は血管から組織内に移動し、存在する。
血液内での好中球の寿命は1日以内、概ね10〜12時間程とされる[5]。
組織内では数日である[5]。好中球は骨髄内で生産されるが、1日当たり10の11乗個(1000億個)程度作られる。
血液内の好中球が増加する状況
感染症、炎症、急性出血、溶血、慢性骨髄性白血病、真性多血症、中毒、悪性腫瘍、尿毒、痛風、副腎皮質ステロイド投与[6]一時的なもの(運動、食事、[4]ストレス)、喫煙[7]などで好中球は増加する。
血液内の好中球が増加する要因としては、骨髄における好中球の産出が病的に亢進するもの(慢性骨髄性白血病など)、貯留プール及び辺縁プールから循環プール(末梢血)への移動及び骨髄における産出の反応的な亢進(感染症、炎症など)[5]貯留プール及び辺縁プールから循環プール(末梢血)への移動および組織への移動の減少など(副腎皮質ステロイド投与)[4]、血流の変化に伴う一時的な辺縁プールから循環プールへの移動(食事、運動など)[4]などその内容はさまざまである。
血液内の好中球が減少する状況
ウイルス感染、リケッチア感染、再生不良性貧血、悪性貧血[6]、ビタミンB12欠乏や葉酸欠乏、急性白血病、骨髄線維症、脾腫、好中球に対する自己免疫疾患、薬剤の使用などで好中球は減少することがある。
抗がん剤投与では顕著に減少するほか、きわめて多数の薬剤が好中球の減少に関係することがありうる。
好中球の生体防御のしくみ
要約
視点
生体に細菌などが感染すると、好中球は感染した炎症部位に遊走して集まり、細菌類を貪食殺菌する。好中球は特に化膿菌(ブドウ球菌、連鎖球菌、緑膿菌、大腸菌など大多数の細菌である)の殺菌に効果を発揮するが、結核菌やチフス菌、赤痢菌などの細胞内寄生性細菌への対処能力は限定的である。
遊走から細菌への接触
細菌や真菌類が侵入した組織では、組織内のマクロファージや肥満細胞がただちに反応し、インターロイキン1(IL-1)などのサイトカインを放出し、それらのサイトカインにより、組織内の細胞は炎症性変化を起こす。また。それ以外の過程を含め、炎症性変化を起こした組織やマクロファージ・肥満細胞はインターロイキン8(IL-8)あるいはNAP-2、MIP-2を代表とする多種類のケモカイン(サイトカイン)や肥満細胞が放出するロイコトリエンB4、その他の多種類の好中球遊走刺激因子を放出する[8]。また、細菌自身の産出物質(FMLP.formyl-methionyl-leucyl-phenylalanine)や細菌と抗体との反応で活性化した補体成分も好中球を遊走させる走化因子として働いている[9]。それらの遊走刺激因子を表面のレセプターで感じ取った好中球は遊走運動を活発化させる。好中球は表面に多数あるレセプターで刺激因子の濃度の濃い薄いを感じ取り、因子の濃度の濃い方向に遊走し、感染巣に集結する。多くの場合、感染巣は血管外であり、好中球は血管壁を通過しなければならない。炎症箇所に近い末梢血管壁で好中球は血管上皮に粘着し、血管上皮細胞と好中球それぞれが各種因子によって変化を起こし、好中球は偽足を伸ばし、血管上皮細胞の間をすり抜ける。さらに酵素を用いて基底膜を破り、血管外に這い出る。血管外に出た好中球は組織内を遊走し、感染巣に到達する[8]。感染巣に到達した好中球は、最終的には細菌自身の産出物質(FMLP)や細菌と抗体との反応で活性化した補体成分をレセプターで感じ取り、細菌へ接触する[9]。
炎症組織からの遊走刺激因子により、骨髄内の貯留プールなどに存在する好中球も刺激を受け遊走運動を開始し、また骨髄では好中球の生産が亢進される[10]。それらによって細菌類の感染には大量の好中球が動員されることになる[10]。
貪食・殺菌
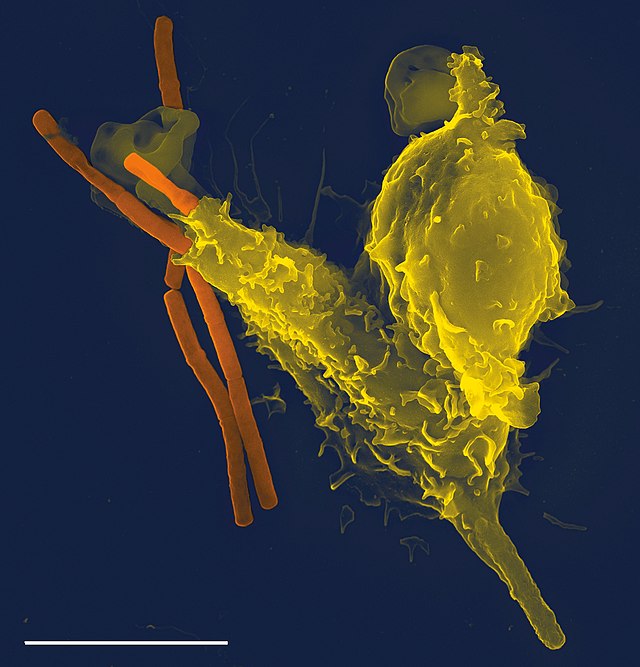
感染巣に到達した好中球は、細菌類への接触から貪食を行い、飲み込んだ細菌類を殺菌する。
好中球は細菌類に接触すると、細菌表面分子に対応する各種レセプターを介して異物と認識し、接着結合する。
しかし、細菌類の捕捉認識は細菌表面分子だけでは不十分なことが多い。その場合は細菌類に接合し好中球の捕捉を促進する物質が必要である。その物質をオプソニンと言い[11]、特に重要なのはIgG抗体である[11]。また、細菌類に接合し、活性化した補体成分C3bも好中球が細菌類に接合する過程で重要である[11]。IgG抗体や活性化補体C3bなどのオプソニン物質が細菌表面に結合していることを「オプソニン化」と言い、好中球はIgGのFc部分に対するFcレセプター(FcγR)およびC3bに対する補体レセプターなどのオプソニン物資に対応するレセプターを持っているので、オプソニン化された細菌類は特に好中球に捕捉されやすい[11]。好中球は必ずしも単独で細菌類に対処するのではなく、各種免疫反応にもサポートされて生体防御を行う。
結合した細菌類は、好中球形質膜がこれを包むようにして、好中球内に取り込む。好中球内で細菌類を取り込んで裏返しになった細胞膜の袋を食胞という。
細菌類を取り込んだ食胞は顆粒と融合し、顆粒内容物が食胞内に放出される。
顆粒内容物が放出された食胞内で細菌類は2つの手段で殺菌される。1つは酸素依存性の機構で、NADPH酸化酵素系の働きで活性酸素や過酸化水素を発生させ食胞内にて殺菌する。アズール顆粒に含まれるミエロペルオキシダーゼは過酸化水素(H2O2)と塩化物イオン(Cl-)から次亜塩素酸(HOCl)を産生する。細菌は、酵素反応によって生じたHOClにより、効率的に殺菌される[12]。
もう1つは非酸素依存性の機構で、顆粒から放出される殺菌性酵素(ラクトフェリン、リゾチーム、エラスターゼなど)などで殺菌・分解する[12]。
細菌類を飲み込んだ好中球はやがて死亡し、死体は膿になって体外に放出されるか、組織内のマクロファージなどにより処理される。
顆粒の種類と主な顆粒内内容物
分化過程

好中球を含め、全ての血球は骨髄の中に存在する造血幹細胞に由来する。骨髄中において造血幹細胞は赤血球・各種の白血球・血小板に分化するが、最終的に好中球に分化する場合は造血幹細胞、骨髄系幹細胞(骨髄系前駆細胞)、顆粒球・単球系前駆細胞、顆粒球前駆細胞、骨髄芽球、前骨髄球、骨髄球、後骨髄球の順に分化成熟する。さらに桿状核球を経て分葉核球へと分化するが、この最後の2つをもって好中球と呼ぶ。

造血幹細胞から分裂し、分化し始めた細胞は盛んに分裂し、数を増やしながら、少しずつ分化の方向を進めていく。幹細胞から前駆細胞、骨髄芽球の段階までは、顕微鏡による形態学的観察では最終的に好中球などの顆粒球系に分化する細胞であるか識別は困難であるが、骨髄芽球の段階からは顆粒が生じ始め、顆粒球系の細胞と形態学的にも判断できるようになる。前骨髄球の段階になると好中球への分化傾向が明らかになる。
骨髄芽球の段階から光学式顕微鏡では見えないが電子顕微鏡で確認できる一次顆粒(アズール顆粒)が生じ始め、前骨髄球では光学顕微鏡でも確認できる豊富な一次顆粒(アズール顆粒)を持つようになる[14]。骨髄球の段階では一次顆粒は見えなくなり(見えないが存在はする)代わりに二次顆粒(特殊顆粒)が発現する。さらに三次顆粒など好中球には各種の顆粒が存在するようになる。
顆粒球系と判断できるようになった段階以降も、骨髄芽球で1回、前骨髄球で2回、骨髄球で2回ほどの細胞分裂を起こし、数を増す[14]。後骨髄球の段階になると細胞分裂する能力は失われる。通常時には骨髄芽球以降の段階で7日から14日[15]、平均でおよそ11日の時間をかけ成熟する[14]。
骨髄芽球や前骨髄球など幼若な段階では細胞の核は大きく丸く、核内構造(クロマチン構造)は繊細であるが、分化・成熟が進むほど核は小さくいびつになり、構造は粗くなる[14]。核が歪んだジェリービーンズ形である桿状核球と呼ばれる段階になると、完成した好中球と認識されるが、さらに成熟が進み、核の形が複数に分かれた分葉核球となる。分葉核球が好中球の分化の最終成熟段階となる。
末梢血に見られる好中球の大多数は分葉核球であるが、炎症時など貯留プールからの好中球の大量の動員が必要な時などには桿状核球の割合が増える。
白血球の核形の左方推移
好中球は、正常な状態では末梢血中に分葉核球(2〜3葉が多い)が多く認められる。
感染症などの場合、免疫応答による好中球増加が見られるが、その初期の段階では桿状核球が増加し更に幼若な後骨髄球や骨髄球が末梢血に出現することがある。出血性貧血や、医療行為による骨髄抑制などによる汎血球減少からの回復期にも同様のことが起きる。このような一核細胞の増加を「核の左方推移」と呼ぶ。好中球を早急に動員しなければならない事態のために、最終成熟形態でない好中球も動員されるためである[5]。
上記は「造血の立ち上がり」にみられる一過性の左方推移の例であるが、骨髄異形成症候群や慢性骨髄性白血病などの場合は骨髄球-顆粒球系細胞の分化成熟能力自体に異常を生じているため、左方推移状態が持続する。なお、逆に分葉核球の比率が増えた状態=右方推移は、悪性貧血などのときに起こる。
好中球の異物貪食動画像
Neutrophils display highly directional amoeboid motility in infected footpad and phalanges. Intravital imaging was performed in the footpad path of LysM-eGFP mice 20 min after infection with LM. [16]
出典・脚注
参考文献
関連項目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
