中心静脈カテーテル
ウィキペディアから
中心静脈カテーテル(ちゅうしんじょうみゃくカテーテル、英: Central venous catheter、CVC)は、鎖骨下静脈、内頚静脈、大腿静脈などの太い静脈に挿入するカテーテルである[注釈 1]。
| 中心静脈カテーテル | |
|---|---|
| 治療法 | |
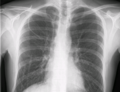
 右鎖骨下静脈に挿入された中心静脈カテーテル。皮下トンネルのないタイプ。 | |
| シノニム | 中心静脈ルート、中心静脈ライン、中心静脈アクセス |
| ICD-10-PCS | Z45.2 |
| MeSH | D002405 |
静脈アクセスの一種である。
概要
重症患者や長時間の点滴治療を必要とする患者には、より信頼性の高い[注釈 2]静脈路確保のために、手足よりも心臓に近い位置にある静脈に大きなカテーテルを留置することがしばしば必要となる。これらのカテーテルは、一般に、首の静脈(内頸静脈)、胸部の静脈(鎖骨下静脈または腋窩静脈)、鼠径部(大腿静脈)、または上腕の静脈に挿入される。これは、末梢挿入型中心静脈カテーテルまたは略称でPICCラインと呼ばれる。
中心静脈ラインは、口から飲めない、ないしは血管障害性の薬剤・輸液の投与、血液検査、高速での輸液や血液製剤の投与、中心静脈圧の測定に用いられる[1][2]。用いられるカテーテルの長さは通常15~30 cm、シリコンやポリウレタン製で、輸液注入用のルーメンが複数あるものもある[3](p8)。
中心静脈カテーテルの管理には、カテーテル内腔を注射器に充填した生理食塩水で洗浄することがよく行われるが、この行為はフラッシュ(英: flush)とよばれる。
合併症には、気胸、動脈穿刺、感染、カテーテル閉塞、カテーテルの位置異常、空気塞栓、血栓症などがある。
中心静脈カテーテルの留置にはガイドワイヤーを用いるセルディンガー法が用いられることが多く、近年はカテーテル留置時に超音波診断装置を併用することによって合併症の発生率は低下しつつある。
歴史
最初の中心静脈カテーテル留置は、1929年、ドイツの外科研修医ヴェルナー・フォルスマンによって成し遂げられた。彼は、プラスチック製の尿道カテーテルを自分の左腕の尺側皮静脈に挿入し、右心房まで到達させた[4]。しかし、上司に無許可であったために叱責され、彼は病院を解雇されてしまった[4]。だが、この手技の医学上の貢献が後に評価され、1956年にノーベル医学賞を授与されるに至った[5][3](p3)。
適応


中心静脈カテーテルの主な適応は次のとおりである[6]。
- 末梢静脈へのカテーテル留置困難 – 末梢静脈カテーテルを確保または維持することが困難な場合、中心静脈カテーテルが留置されることがある(例:肥満、過去のカニュレーションによる静脈の傷跡、興奮した患者)
- 特殊な薬剤ないしは輸液の投与 – 血管収縮薬(ノルエピネフリン、バソプレシン、フェニレフリンなど)、化学療法剤、高張液などの薬剤は末梢静脈にダメージを与えるため、しばしば中心静脈ラインを必要とする。さらに、複数のルーメンを持つカテーテルからは、複数の静注薬を容易に同時投与できる。
- 長期間の点滴治療 - 長期間の高カロリー輸液や抗生物質の静脈内投与など、長期間(数日以上)投与する必要がある注射薬は、中心静脈ラインを通して投与される。
- 特殊な治療 - 血液透析、血漿交換、経静脈的心臓ペーシング、侵襲的血行動態モニタリング(例:肺動脈カテーテル)等の医学的介入には中心静脈アクセスが必要である。
中心静脈カテーテルの使用に絶対的な禁忌はない[6]。相対的な禁忌は、血液凝固障害、留置部位の外傷または局所感染、留置部位よりも心臓に近い側の血管損傷が疑われる場合など。ただし、中心静脈留置に伴うリスクと合併症があるので、以下に述べる[7]。
合併症
要約
視点
中心静脈ライン挿入は、いくつかの合併症を引き起こす可能性がある。用いることで期待される利益は、これらの合併症のリスクを上回るものでなければならない。
気胸
気胸の発生率は、解剖学的に肺尖に近い鎖骨下静脈のカテーテル留置で最も高くなる。経験豊富な医師でも、気胸の発生率は1.5~3.1%程度にもなるとされる。内頸静脈のカテーテル治療の場合、気胸のリスクは超音波画像で可視化しながら留置することで最小化される。英国国立医療技術評価機構やその他の医療機関では、合併症を最小限に抑えるために超音波診断装置のルーチン使用を推奨している[8]。
気胸が疑われる場合は、立位で胸部X線撮影を行う必要がある。肺外に漏れた空気は肺尖に移動し、そこで容易に可視化されるため、立位胸部X線撮影が望ましい。もちろん、特に集中治療室に入院している重症の患者では、常にこれが可能とは限らない。仰臥位で撮影したX線撮影は、気胸の25~50%を検出できない[9]。代替手段として、ベッドサイドの超音波検査は、重症で立位撮影ができない患者の気胸検出手段として優れていることが示されている[10][11]。
動脈穿刺
動脈穿刺は、中心静脈穿刺の合併症として恐れられており、生命を脅かす可能性がある。幸いなことに、これらの事象の発生率は、特にカテーテルを超音波ガイドで留置した場合、非常にまれである。頚動脈への偶発的なカテーテル留置は、内頸静脈にカテーテルを留置する際に起こりうる合併症である。これは、超音波ガイドを用いた場合、約1%の割合で発生するとされる[注釈 3]。しかし、解剖学的ランドマークに依拠したアプローチを用いた場合には、0.5~11%の発生率が報告されている[12][注釈 4]。頸動脈に誤ってカテーテルを挿入した場合、カテーテルを抜くと致命的になるため、カテーテルをそのままにして血管外科医に連絡すべきである[13]。
カテーテル関連血流感染症 (Catheter-related bloodstream infections: CRBSI)
すべてのカテーテルは、血流に細菌を混入させる可能性がある。その結果、重篤な感染症を引き起こし、最大で25%の確率で命に関わることもある[14]。中心静脈ライン関連血流感染症(Catheter-related bloodstream infections: CRBSI)の問題は、近年ますます注目されている[15]。 合併症や死亡の原因となり、医療費も増加する。
微生物は、様々な方法でCVCを介して血流に到達しうる。まれに、汚染された輸液によって侵入することがある。また、ハブ(カテーテルの固定具)などによる破損箇所からカテーテル内腔に侵入することもある。しかし、ほとんどの微生物は、皮下組織内を血管まで走行するカテーテルに沿って、カテーテルの静脈刺入部分に到達するまで移動することにより、感染が成立する。さらに、血液中に存在する細菌がカテーテルの表面に付着し、感染巣となることがある[3](p40)。
CVCの感染が疑われる場合、CVCと体内の別の場所の静脈の両方から血液培養を行う。CVCからの培養で、他の静脈部位よりもずっと早く(2時間以上)細菌増殖を確認できた場合、CVCは感染している可能性が高い。定量的な血液培養はさらに正確だが、この方法はあまり普及していない[16]。
カテーテル関連血流感染症が疑われる患者には、ほぼ必ず、すぐに抗生物質を投与する。しかし、これは血液培養が行われた後でなければならず、そうでなければ原因菌が特定できない可能性がある。これらの感染症の原因菌として最も一般的なのは、表皮ブドウ球菌などのコアグラーゼ陰性ブドウ球菌である[17]。黄色ブドウ球菌による菌血症に起因する感染症では、カテーテルの抜去と抗生物質の投与が必要である。抗生物質を投与せずにカテーテルを抜去した場合、38%もの患者が心内膜炎を発症する可能性がある[18]。がん患者において、中心静脈カテーテルの長期留置前に抗生物質を投与することに利益はなく、この方法はグラム陽性カテーテル関連感染を予防しない可能性があるというエビデンスが示唆されている[19]。しかし、感染リスクが高い、長期CVC留置を必要とする患者、例えば、化学療法や原疾患による好中球減少のリスクがあるがん患者に対しては、抗生物質とヘパリンを含む溶液でカテーテル内腔をフラッシュすることにより、カテーテル関連感染症を減らすことができるかもしれない[19]。
アメリカ疾病予防管理センター(CDC)は、臨床ガイドラインにおいて、中心静脈ラインの抜去時にルーチンで培養することを推奨している[20]。 同ガイドラインでは、ライン感染を防ぐために、他にもいくつかの推奨事項がある[20]。
感染を予防するためには、カテーテル挿入部位の厳格な消毒が推奨される。このような消毒にはポビドンヨード液を用いることが多いが、クロルヘキシジンはヨードの2倍の効果が示唆されている[21]。 CVCや肺動脈カテーテルは、3日毎に定期的に入れ換えても、感染率に違いはなかった[22]。 CDCは、CVCの感染リスク低減に関して、以下を含む多数の推奨事項を示している[23]。
- 感染予防の観点から好ましい挿入部位(非トンネル型カテーテル留置を含む)は鎖骨下静脈であり、可能であれば大腿静脈を避けることが一般的である。
- ガイドラインではトンネル型カテーテルの部位について明確な推奨はない。
- カテーテルは、臨床目標を達成するための最小限のポートを持つものを選択するべきである。
- CVCの使用には滅菌手袋が必要である。
- CVCの留置には全身無菌ドレープ、キャップ、マスク、手袋が必要である。
- カテーテル部位は、感染の有無を評価するため、定期的に目視および触診(ドレッシングを通して)により観察する必要がある。
- ただし、血管内留置カテーテルの創傷被覆材(ドレッシング)を交換する際に、非滅菌の清潔手袋を用いることは差し支えない。
- 皮膚洗浄剤はクロルヘキシジンとポビドンヨードの両方が使えるが、クロルヘキシジンが好ましい。
- 短期間のCVC留置では、ドレッシングは透明ドレッシングの場合は少なくとも7日ごと、ガーゼドレッシングの場合は2日ごとに交換する必要がある。
- 長期留置カテーテルまたはトンネル型カテーテルでは、汚れたり緩んだりしない限り、ドレッシングの交換は週1回までとする。
- 中心静脈カテーテルの定期的な抜去・交換は推奨されない。中心静脈カテーテルは不要になったらすぐに抜去すべきであるが、ガイドワイヤーを用いた同じ穿刺部位からの交換であれ、新しい穿刺部位からの再留置であれ、定期的な抜去・交換が感染予防に有益であることは示されていない[24]。
- 薬剤を含浸させたドレッシング製品は、カテーテル関連の血流感染リスクを低減することができる[24]。
- 中心静脈カテーテルのドレッシングの交換間隔が長いことが、感染の多寡に関連するかどうかについては、結論が出ていない[25]。
- CVC留置中、皮膚を定期的に消毒することでカテーテル関連の血流感染率が低下するかは不明である[26]。
カテーテル閉塞

静脈カテーテルは、カテーテルのねじれ、カテーテル内への血液の逆流による血栓症、または沈殿物を形成する不溶性物質の注入によって閉塞する場合がある。このうち血栓症は中心静脈ラインの閉塞の最も一般的な原因であり、カテーテルの最大25%に発生する[28]。
CVCは、上肢深部静脈血栓症などの血栓(静脈血栓塞栓症)を形成する危険因子である[29][30]。このリスクは、留置時の静脈損傷によって血液中の凝固物質が活性化することによると考えられている[31]。がんも血栓の危険因子であるため、がんを患っている人の方が血栓のリスクは高くなる。中心静脈ラインを有するがん患者の3分の2がカテーテル関連血栓症の所見を有している[32]。しかし、カテーテル関連血栓症のほとんどの症例(95%以上)は発見されないままである。症候性の症例の多くは、大腿静脈カテーテル(3.4%)[33]または末梢挿入型中心静脈カテーテル(3%)[34]の留置で見られる。ヘパリンやフォンダパリヌクスなどの抗凝固薬は、CVCを有するがん患者における血栓、特に深部静脈血栓症の発生率を低下させることが示されている[35]。さらに、非がん患者において、鎖骨下静脈にCVCを短期間留置することは、大腿静脈に留置したCVCよりも血栓ができにくいことがコクランメタ解析で示唆されている[2]。
非血栓性閉塞(沈殿物の形成など)の場合、低濃度の酸を用いてカテーテルの開通性を回復させることができる。0.1N塩酸溶液を用いるのが一般的である[36]。高カロリー輸液(TPN)やプロポフォールなどの脂質を多く含む輸液も、時間の経過とともに閉塞しやすくなる傾向がある。このような場合、少量の70%エタノールを注入することで再開通することが多い[3](p37)[注釈 5]。
カテーテル位置異常
CVCの誤留置は、怪我や過去の手術によって解剖学的構造が異なっていたり、困難な場合に多くみられる[31]。
CVCは誤って動脈に挿入されることもある(例えば、頸部に挿入する場合は頚動脈や椎骨動脈、鼠径部に挿入する場合は総大腿動脈など)。このエラーは、カテーテルにチューブを接続して、液面を計測することにより、すぐに特定することができる(動脈は静脈よりも圧力が高い)。さらに、カテーテルから採血した血液サンプルを検査室に送ってpH、酸素分圧 (pO2)、二酸化炭素分圧 (pCO2)を測定すれば、動脈血(pH/pO2が高く、pCO2が低い)または静脈(pH/pO2が低く、pCO2が高い)の特性が判明する[1]。
鎖骨下静脈へのCVC留置では、カテーテルが誤って上大静脈ではなく同じ側の内頸静脈に押し込まれることがある。この可能性を排除するために、挿入後に胸部X線検査を行う[37]。また、カテーテルの先端が上大静脈ではなく、頸部の対側(反対側)の鎖骨下静脈に誤挿入されることもある。
空気塞栓
静脈循環に空気が混入すると、静脈空気塞栓症を引き起こす可能性がある。これはCVC留置のまれな合併症であるが、致死的な場合もある。空気塞栓が患者に与える影響は、空気の流入量と流入速度で決まる。このプロセスは、数秒間に少なくとも200~300 mlの空気が混入すると致命的となる可能性がある[38]。この結果、脳梗塞(卵円孔を通過した空気による)、肺水腫、急性右心不全(右心室内に閉じ込められた空気による)などが起こり、心原性ショックに至ることがある[38]。
静脈性空気塞栓症の臨床症状は、無症状であることがある。有症状者の場合、最も一般的な症状は突然の息切れと咳である。症状が重い場合、患者は急速に血圧が低下し、心原性ショックにより意識レベル低下を生じることがある。また、脳梗塞の急性期症状が見られることもある[38]。心臓超音波検査により、心臓内に閉じ込められた空気を可視化することができる[38]。重症の空気塞栓症が疑われる場合、CVCの末端に注射器を取り付け、空気を血液循環から除去することを試みても良い。また、患者を左側臥位にするのもよい。この体位は、右心室に滞留した空気を取り除くのに役立つと考えられてきたが、疑問視されてもいる[38]。
カテーテル関連血栓症(Catheter-related thrombosis: CRT)
カテーテル関連血栓症(Catheter-related thrombosis:CRT)とは、CVCの長期留置に関連した血栓の発生を指す。主にカテーテル留置が好まれる上肢に発生し、肺塞栓症、血栓後症候群、血管障害などの合併症を引き起こすことがある。症状としては、疼痛、触診による圧痛、腫脹、浮腫、熱感、紅斑、周囲への側副血管の発生などが挙げられる。しかし、ほとんどのCRTは無症状であり、過去のカテーテル感染によりCRT発症のリスクは高まる。定期的なフラッシュがカテーテル血栓症の予防に役立つことがある[39]。カテーテル閉塞がある場合、閉塞の原因が血栓またはフィブリン塊であれば、血栓溶解剤を用いてもよい。閉塞の原因が血栓形成である場合は、抗凝固剤による治療が適応となる[40]。中心静脈カテーテルの開存性を維持し閉塞を防ぐために、ヘパリン生理食塩水によるフラッシュが通常の生理食塩水によるフラッシュよりも優れているかどうかは十分なエビデンスがない[41][42]。
カテーテル挿入
手技のリスクや合併症を最小限に抑えるため、挿入前にまず、関連する検査項目やCVC留置の適応を確認し、患者を評価する。次に、挿入予定部位の皮膚を消毒する。必要であれば、局所麻酔薬を塗布する。静脈の位置を目印に、または小型の超音波装置を用いて確認する。中空針を皮膚に刺し、血液を吸引する。血液の色と流速によって、動脈血(誤って動脈を穿刺した可能性がある)と区別することができる。北米およびヨーロッパでは、超音波の使用が中心静脈へのアクセスおよび手技のゴールドスタンダードとなっており、ランドマーク手技は減少している[43][44]。日本においても超音波診断装置の使用が推奨されている[45]。最近のエビデンスでは、鎖骨下静脈カテーテルの超音波ガイドが有害事象を減少させることが示されている[46][47][48]。
先端鈍なガイドワイヤーを針に通し、針を抜くというセルディンガー法を用いて、カテーテルを挿入する。ガイドワイヤーに拡張器具(ダイレーター)を通し、カテーテル挿入経路を拡張する。最後に、中心静脈ラインそのものをガイドワイヤーに通し、ガイドワイヤーを抜去する。ラインの内腔はすべて血液を吸引し(静脈内に位置していることを確認するため)、生理食塩水またはヘパリンでフラッシュする[1]。その後、ラインが上大静脈内に位置していること、不慮の気胸が発生していないことを確認するために胸部X線検査を実施する。前後方向のX線では、カテーテルの先端が気管分岐部の高さより55~29 mm下にあることが許容範囲とされる[49]。電磁追跡法(英: Electromagnetic tracking)を用いれば、先端位置の確認と挿入時の誘導を行うことができ、その後のX線の必要性は無くなる[要出典]。
- 皮膚に縫合固定されたCVC。
- 右鎖骨下静脈に留置されたCVCを示す胸部X線写真。
- 胸部X線写真における上大静脈の輪郭は左側に青く示されている。
カテーテル流量
ハーゲン・ポアズイユ式
ハーゲン・ポアズイユ式は、管径が一定の円管を通る流体の特性を記述するものである[50]。式は下記の通り:
この式は、管径が一定の円管を流れる流量(Q)が、内半径(r)、チューブの長さ(L)、流体の粘度(μ)の関数であることを示している。流量は、チューブの内半径の4乗に直接関係し、チューブの長さと流体の粘性に反比例する。この式からは、静脈カテーテルに関する次の重要な見解が理解できる。すなわち、カテーテルの内径は、カテーテルの長さや流体の粘度よりも流量にはるかに大きな影響を与えること、急速注入[注釈 7]には、短くて大きな内径のカテーテルが最大の流量を提供するので最適であること、である[3](p7)。
分類
要約
視点

CVCにはいくつかの種類があり、部位(カテーテルを体内に挿入する場所)や用いるカテーテルの種類によってさらに細かく分類することができる[51]。
挿入部位による分類
経皮的中心静脈カテーテル (Percutaneous central venous catheter: CVC)
経皮的中心静脈カテーテル(CVC)は、皮膚から直接挿入される、最も一般的なCVCである。内頚静脈、外頚静脈、鎖骨下静脈、大腿静脈のいずれかを用いる。重症の患者に最もよく用いられる。CVCは数日から数週間用いることができ、患者は入院する必要がある。通常、縫合糸またはセット化されている固定具で固定される[39]。
末梢挿入型中心静脈カテーテル (Peripherally inserted central catheters: PICC)

→詳細は「末梢挿入型中心静脈カテーテル」を参照
末梢挿入型中心静脈カテーテル、またはPICCライン(「ピック」と発音)は、CVCを首や胸の静脈ではなく、腕の静脈(尺側皮静脈または橈側皮静脈経由)に挿入するものである。尺側皮静脈は太く、腕の中をまっすぐ通っているため、通常、橈側皮静脈よりもカテーテル留置の対象として適している。カテーテルの先端は上大静脈に位置する[1]。PICCラインは細い末梢静脈に挿入されるため、中心静脈ラインよりも直径が小さく、中心静脈カテーテルよりもはるかに長い(50~70 cm対15~30 cm)。したがって、PICCラインを流れる輸液速度は他のCVCよりもかなり遅く、急速大量輸液による蘇生には不向きである。PICCラインは容易に閉塞する可能性があり、析出しやすい薬剤であるフェニトインを用いてはならない[39]。また、PICCラインは静脈血栓症や狭窄を引き起こす可能性があるので、慢性腎不全の患者では、血液透析のためにシャントを作る必要がある場合に備えて慎重に使用すべきである[52][53]。
しかし、PICCラインはいくつかの理由から望ましいものである。最長で1年間、静脈アクセスとして使用できる。患者はPICCを装着したまま帰宅することができる。PICCラインは、中心静脈ライン留置の合併症(気胸、偶発的な動脈カニュレーションなど)を回避でき、超音波ガイド下で比較的容易に留置でき、CVCよりも不快感が少ない[3]。PICCラインはベッドサイド、在宅、放射線科で挿入できる。PICCは縫合糸またはセット化された固定具で固定される[39]。
皮下トンネル型CVC

トンネル型カテーテルは、挿入部位から別の出口部位まで皮下に埋め込まれる。カテーテルとその付属物は皮膚の下から出てくる。出口は通常胸部にあり、首から直接突き出たカテーテルよりもアクセスポートが目立たない。カテーテルを皮下に通すことで、感染を防ぎ、固定性も良好である。挿入は外科的手技により、カテーテルは上大静脈に入る前に胸部の皮膚の下にトンネル状に挿入される。一般的に用いられるトンネル型カテーテルには、ヒックマンカテーテル、グローソンカテーテル、ブロビアック(Broviac)カテーテルなどがあり、これらの名称でも呼ばれることがある。
トンネル型カテーテルは、数ヶ月から数年間挿入されたままになることがある。これらのCVCは、ダクロンカフという、挿入部付近のカテーテルを囲む抗菌カフが抗菌液でコーティングされており、挿入後2~3週間でカテーテルが固定されるため感染率が低い[39]。
CVポート
→詳細は「ポート (医療)」を参照



CVポート(英: central venous port)は、単に「ポート」とも呼ばれ、皮下トンネル型カテーテルに似ているが、カテーテルとその付属物全体が完全に皮膚の下に埋め込まれる。薬剤は皮膚経由でカテーテルに注入される。すなわち、埋め込まれたポートの中には、小さなリザーバーがあり、薬剤を充填することができる。充填された後、リザーバーから薬がゆっくりと血流に放出される。外科的に植え込まれた輸液ポートは、鎖骨の下(鎖骨下窩)に留置され、カテーテルは上大静脈を通って心臓(右心房)に通される。埋込後は、グリッパー(gripper)と呼ばれる、ヒューバーチップ針を皮膚から直接挿入する。PowerLocは商標の1つで、一般名はヒューバーチップ針である。一般的なサイズは長さ0.75および1インチ(19および25 mm、19および20ゲージ)を使ってポートにアクセスする。この針はツーイ針同様の鈍針であり、コアリング防止形状となっている。コアリングとは、中空針によってくり抜かれた組織や器材の断片が針によって、体内に持ち込まれてしまうことを指す。針のセットには、短い長さのチューブとカテーテルが含まれる。ポートに穿刺する前に局所麻酔薬を皮膚に塗ってもよい。ポートは、投薬、化学療法、採血に用いることができる。ポートは完全に皮下にあるため、CVCやPICCカテーテルよりもメンテナンスが容易で、感染リスクも低い[1]。埋め込まれたポートは、トンネル型カテーテルやPICCラインよりも目立ちにくく、日常のケアもほとんど必要なく、患者の日常生活への影響も少ない。ポートへのアクセスには、専用の機器と取扱者の訓練が必要である。
ポートは通常、長期にわたる治療で定期的な静脈アクセスを必要とする患者に用いられ、その後、外科的に除去されるまで定期的にフラッシュされる。短期間に頻繁に静脈にアクセスする必要がある場合は、外部アクセスを有するカテーテルがより一般的に用いられる[1]。
カテーテルによる分類
トリプルルーメンカテーテル
CVCとして最も一般的に用いられるのは、トリプルルーメンカテーテルである[3](p8)。 レンコンのように3つの内腔(ルーメン)を持ち、複数の薬液を同時に投与できることから、(特にICUで)好まれている。カテーテルのサイズはフレンチスケールとゲージ規格を用いて決められ、成人では7フレンチサイズが一般的である。フレンチスケールとは逆に、ゲージ数は大きくなるほどカテーテルの直径は小さくなる[3](p4)。これらのカテーテルには16ゲージのルーメンが1つあるが、中心静脈カテーテルは比較的長いため、流量は16ゲージの末梢静脈カテーテルに比べかなり遅い(上記の「カテーテルの流量」の項を参照)。複数のルーメンを用いても、カテーテル関連血流感染症のリスクは増加しないことに留意することが重要である[54][注釈 8]。ルーメンが1つのものはシングルルーメンカテーテル、ルーメンが2つのものはダブルルーメンカテーテルと呼ばれる。
血液透析用カテーテル
血液透析カテーテルは、血液透析の大流量を維持するために必要な200~300 ml/minの流量が可能な大口径カテーテル(最大16フレンチすなわち5.3 mm)である。2つのルーメンがあり、1つは患者の血液を透析装置に運ぶために用い、もう1つは患者に血液を戻すために用いる。これらのカテーテルは、通常、内頸静脈に留置される[3]。
シースイントロデューサー
シースイントロデューサー(又はイントロデューサーシース)は、肺動脈カテーテルや経静脈ペーシングなどを一時的に血管内に留置するために、留置される太径のカテーテル(8~9フレンチ)である。イントロデューサーシースを先に留置し、デバイスをシースから血管内に通す。このカテーテルは、直径が大きく、長さが短いため、急速輸液を行うことも可能である。加圧注入装置と組み合わせると、850 ml/minもの流量が達成できる[55]。
カテーテルの定期的な管理

カテーテルは、粘着性ドレッシング、縫合糸、または医療用ホチキスで固定し、閉鎖型ドレッシングで覆う。生理食塩水またはヘパリン含有輸液で定期的にフラッシュすることで、カテーテルの開通を維持し、血栓を防止する。ヘパリンが生理食塩水よりも血栓予防に優れているというエビデンスはない[56]。特定のカテーテルには、感染リスクを減らすために、抗生物質、銀含有物質(特にスルファジアジン銀)、クロルヘキシジンを含浸させたものがある[57]。
長期留置用CVCの一種、ヒックマンカテーテルは、バルブが閉じていることを確認するためにクランプを必要とし、グローソンカテーテルは、液体を引き出したり注入したりするときにバルブが開き、用いないときは閉じたままになっているものである。また、ヒックマンカテーテルは、細菌のカテーテル沿いの移動を阻止するために、皮膚の下に「カフ」を備えている[58]。カフは、長期的に固定するために、デバイスに組織を生着させるためのものでもある[59]。
脚注
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.