トップQs
タイムライン
チャット
視点
三フッ化リン
ウィキペディアから
Remove ads
三フッ化リン(さんフッかリン、英: phosphorus trifluoride)とは、分子式が PF3 と表される無機化合物。錯体化学において配位子として用いられ、その強い毒性やヘモグロビン中の鉄と結合する性質が金属カルボニル中の一酸化炭素と対比される[1]。常温常圧では無色の気体で、水とはゆっくりと反応する。
Remove ads
物理的性質
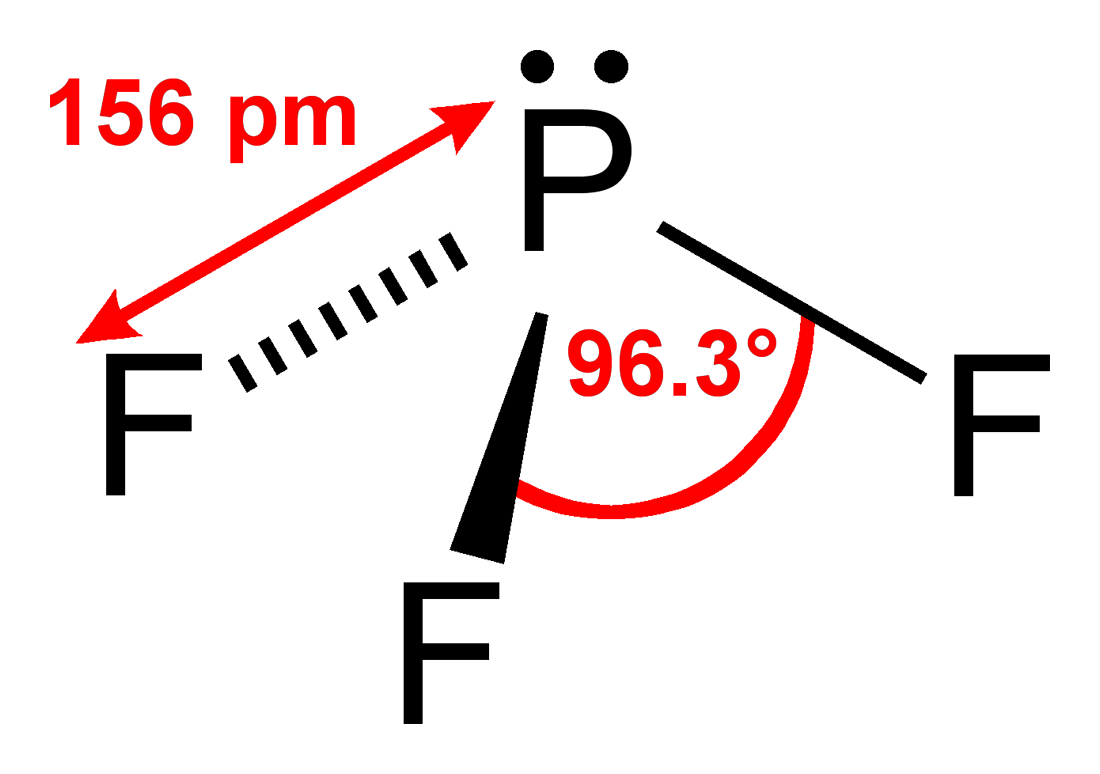
三フッ化リンの F-P-F 結合角は 96.3°と知られている。気体状の三フッ化リンの標準生成エンタルピーは −945 kJ/mol (-226 kcal/mol) と求められている。リンの NMR シグナルは H3PO4 に対して 97 ppm 低磁場側に現れる。
化学的性質
要約
視点
三フッ化リンは特に高いpHのもとで加水分解を受けるが、三塩化リンよりは反応性が低い。高温でない限りはガラスを浸食することはなく、無水の水酸化カリウムを用いて乾燥することもできる。高温の金属を作用させるとリン化物とフッ化物が生じる。アンモニアなどのルイス塩基とは付加体を作る。また、臭素や過マンガン酸カリウムなどにより酸化される。
遷移金属への配位子として三フッ化リンは強い π受容性を示し[2]、低原子価の金属とさまざまな錯体を作る。三フッ化リンは一酸化炭素では不安定な形式の錯体を作ることもある。例えばパラジウム(O)錯体 Pd(PF3)4 は存在が知られるが、Pd(CO)4 は知られていない[3][4][5]。通常、三フッ化リンを配位子とする金属錯体は、対応する金属カルボニル錯体との配位子交換により合成される。しかし金属ニッケルは 100 ℃、35 MPa で直接三フッ化リンと反応し、Ni(PF3)4 を与える。クロム錯体 Cr(PF3)6 はビス(ベンゼン)クロムから作ることもできる。
Remove ads
合成
三フッ化リンは通常、三塩化リンからのハロゲン交換によって合成される。フッ化物としてはフッ化水素、フッ化カルシウム、三フッ化ヒ素、三フッ化アンチモン、フッ化亜鉛などが用いられる[6][7][8]。
生理活性
三フッ化リンは一酸化炭素のように、ヘモグロビン上の鉄に強く結合して酸素の吸着を阻害する。
注意
脚注
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads