Timeline
Chat
Prospettiva
Reazione di accoppiamento di Hiyama
reazione chimica di accoppiamento (cross-coupling) Da Wikipedia, l'enciclopedia libera
Remove ads
Remove ads
La reazione di accoppiamento di Hiyama è una reazione di accoppiamento (cross-coupling) degli organosilani con gli alogenuri organici, catalizzata da palladio. Viene impiegata in chimica organica per formare nuovi legami carbonio-carboni e fu scoperta nel 1988 da Tamejiro Hiyama e Yasuo Hatanaka.[1] Oggi è una tecnica molto utile per la sintesi di vari prodotti naturali.[2]
-
- : arilico, alchenilico o alchinilico
- : arilico, alchenilico, alchinilico o alchilico
- : Cl, F or alchile
- : Cl, Br, I oppure OTf
A differenza della reazione di Stille, quella di Hiyama ha il vantaggio di non adoperare composti tossici a base di stagno.[3][4]
Remove ads
Storia
Riepilogo
Prospettiva
La reazione di Hiyama fu sviluppata per aggirare gli ostacoli incontrati nell'impiego di altri reagenti organometallici. A rendersi conto della reattività dell'organo-silicio non fu per primo Hiyama, come si potrebbe pensare, bensì Kumada, che aveva riportato una reazione di accoppiamento in cui si impiegavano reattivi organo-fluoro-silicati.[5]

In seguito Hiyama, approfondendo questi studi, scoprì che gli organosilani hanno una certa reattività quando attivati da atomi di fluoro.[6][7] Questa reattività, combinata con sali di palladio, portava alla formazione di un legame carbonio-carbonio con un carbonio elettrofilo, tipo quello di un alogenuro organico. I composti di organo-silicio sono inattivi, specie se paragonati ad altri comuni reattivi organometallici, quali i reattivi magnesiaci (di Grignard) e quelli di organo-rame, che sono poco chemoselettivi e noti per l'eccessiva reattività che può distruggere i gruppi funzionali su entrambi i partner della reazione.
Altri composti organometallici a base di zinco, stagno e boro presentano problematiche minori riguardo alla reattività, ma hanno altri problemi. Per esempio, gli organo-zinco sono sensibili all'umidità, gli organo-stagno sono tossici mentre i composti di organo-boro non si preparano facilmente, motivo per cui sono costosi e poco stabili. Gli organosilani, invece, sono composti che si preparano agilmente e che, per attivazione con fluoro o una base, possono reagire con gli alogenuri organici per formare nuovi C-C in una maniera chemoselettiva e regioselettiva.
Il primo esempio di utilizzo di questa reazione riguardava l'accoppiamento tra nucleofili di organo-silicio ed elettrofili (alogenuri organici) in presenza di palladio.[1]
Fin dalla sua diffusione, la reazione ha attirato l'attenzione dei chimici organici, volti a trovare nuovi metodi per non impiegare fluoro nel processo.
Per velocizzare la reazione, oltre al fluoro sono state impiegate anche tecniche a base di microonde.[3]
Remove ads
Meccanismo
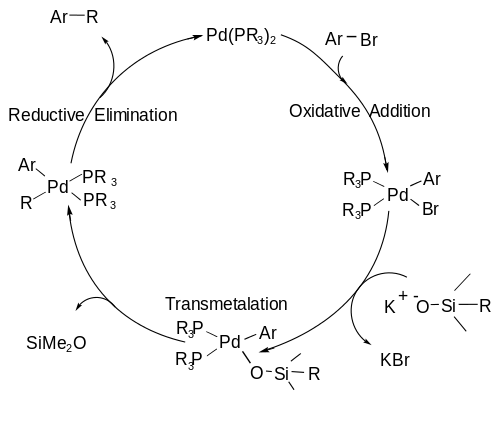
L'organo-silano è attivato con fluoro (in forma di un sale come TBAF o TASF) oppure una base per formare un centro silicico pentavalente che è abbastanza labile da permettere la rottura di un legame C-Si durante la fase di transmetallazione.[8] Lo schema generale di formazione di questo intermedio è mostrato qua sotto ed è un passaggio che avviene in-situ.

Il meccanismo dell'accoppiamento di Hiyama segue un ciclo catalitico, in cui abbiamo:[9]
- A) Addizione ossidativa, in cui un alogenuro si addiziona al palladio ossidando il metallo da Pd (0) a Pd (II);
- B) Transmetallazione, in cui il C-Si si rompe e un secondo frammento di carbonio si lega al Pd;
- C) Eliminazione riduttiva in cui si forma il legame C-C desiderato e il palladio ritorna al suo stato di ossidazione zero per far ripartire il ciclo daccapo.

Remove ads
Obiettivo e limiti
Riepilogo
Prospettiva
Obiettivo
La reazione di accoppiamento di Hiyama può essere applicata per formare legami Csp2-Csp2 (tipo arile-arile) così come legami Csp2-Csp3 (ad esempio arile-alchile).
Rese di reazione buone si ottengono per accoppiamenti di alogenuri arilici, vinilici e allilici con organo-ioduri.
Ulteriori studi sono stati condotti da Scott E. Denmark.[10]

L'accoppiamento di alogenuri alchilici con organo-alogeno-silani come alternativa ai semplici organosilani è un'altra variante della reazione classica.
Gli organo-cloro-silani consento accoppiamenti con i cloruri arilici, che sono abbondanti ed in genere più economici degli ioduri arilici.[11] Un catalizzatore di nichel consente l'accesso a nuove reattività degli organotrifluorosilani, come riportato da GC Fu ed altri autori.[12] Gli alogenuri alchilici secondari funzionano bene in questo modo, dando buone rese.[13]

Limiti
La reazione di Hiyama è limitata dalla richiesta di fluoro per attivare il reagente di organo-silicio. L'addizione di fluoro rompe un qualsiasi gruppo protettore a base di silicio (come i silil-eteri[14]) che sono spesso impiegati nella sintesi organica. Il fluoro è inoltre basico, per cui i gruppi protettori sensibili alle basi, i protoni acidi e i gruppi funzionali in generale potrebbero risentire della presenza di questo ione. La maggior parte della ricerca attuale è concentrata sul trovare una reazione che aggiri il problema.
Varianti
Riepilogo
Prospettiva
Un'alternativa prevede l'impiego di silaciclobutano e fluoro.[15]

Accoppiamenti senza il fluoro
Usando organoclorosilani, Hiyama trovò che un accoppiamento può avvenire usando NaOH come attivatore basico.[16] In altri studi si è usata persino l'acqua[17][18]

Un'altra classe di reazioni senza fluoro vede l'uso di un acido di Lewis che richiede poi l'uso di basi come K3PO4[19][20][21] Sono stati studiati anche esempi in cui si ha l'addizione di rame come co-catalizzatore insieme al palladio.[20][21]

Reazione di accoppiamento di Hiyama-Denmark
La reazione di Hiyama-Denmark è una modifica apportata alla reazione originale e non richiede l'uso di fluoro. Lo schema generale è riportato di seguito, dove si vede l'impiego di una Base di Brønsted come agente attivante (al posto del fluoro).[2]

Questo è un esempio specifico di quanto detto sopra. Se avessimo usato il fluoro, il terz-butildimetilsilil-etere (TBS) si sarebbe probabilmente rotto.[22]

Meccanismo della reazione di Hiyama-Denmark

Remove ads
Note
Voci correlate
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
![The General Scheme for the Hiyama Coupling {\displaystyle {\ce {R-SiR''_{3}+R'-X->[\mathrm {F^{-}} ][{\text{Pd cat.}}]R-R'}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/61136e624b1d2eaf1122ba069be1188b853693be)



