Timeline
Chat
Prospettiva
Anidride ipoclorosa
composto chimico Da Wikipedia, l'enciclopedia libera
Remove ads
L'anidride ipoclorosa o monossido di dicloro è un composto inorganico binario del cloro monovalente con l'ossigeno ed è anche il più semplice ossido del cloro,[1] avente formula Cl2O. Fu sintetizzata per la prima volta nel 1834 da Antoine Jérôme Balard,[2] che insieme a Gay-Lussac ne determinò anche la composizione. Per reazione con l'acqua dà l'acido ipocloroso HOCl. Nella letteratura meno recente è a volte indicato come monossido di cloro,[3] il che può essere fonte di confusione poiché quel nome ora si riferisce propriamente alla specie radicalica [ClO]·, un inquinante dannoso per lo strato di ozono.[4]
Remove ads
Proprietà
Riepilogo
Prospettiva
A temperatura ambiente l'anidride ipoclorosa si presenta come un gas giallo bruno di odore penetrante e sgradevole, mentre allo stato liquido (Teb. = 2 °C) prende un colore rosso bruno scuro.[5] È un ossidante e un clorurante (vedi sezione Reazioni), piuttosto instabile e molto reattivo, sensibile agli urti e facilmente esplosivo se riscaldato,[6] specialmente se viene a contatto con sostanze organiche; mescolato all'ammoniaca reagisce esplosivamente;[7] è inoltre una molecola fotosensibile.[8] Anche per questo è incompatibile con molti solventi, sebbene quelli perclorurati o perfluorurati non vengano attaccati: Il tetracloruro di carbonio, dove ha una notevole solubilità, è quello comunemente impiegato, ma anche CCl3−CF3 è stato usato per alcune misure.[9]
L'anidride ipoclorosa, come pure gli analoghi monossidi di dialogeno X2O, è un composto endotermico, ΔHƒ° = 80,3 kJ/mol,[10] ed anche endoergonico, ΔGƒ° = 88,7 kJ/mol,[11] per cui la sua dissociazione in Cl2 e O2, che sono anch'essi sostanze ossidanti e comburenti, è favorita.
Questa è un'anidride molto solubile in acqua,[12] 143,6 g/100 g (~16,52 m),[13] con reazione esotermica, dove dà luogo ad equilibri di idratazione e di reazione con essa per dare il suo acido corrispondente, l'acido ipocloroso (HClO), un acido assai debole (pKa = 7,54[14]). Diversamente dal caso di altre anidridi gassose che in acqua si idratano parzialmente, quali CO2 e SO2, nell'equilibrio dell'idratazione di Cl2O in soluzione acquosa gran parte di essa viene convertita nel suo corrispondente acido, HClO:[11][15]
- Cl2O (aq) + H2O (l) ⇄ 2 HOCl (aq) K (0 °C) ≈ 282
L'entalpia standard di reazione è stata valutata come [11]
Remove ads
Preparazione
Riepilogo
Prospettiva
Il primo metodo di sintesi consisteva nel trattare l'ossido di mercurio(II) con cloro gassoso.[3] Tuttavia, questo metodo è costoso, oltre che pericoloso a causa del rischio di avvelenamento da mercurio:
- .
Un metodo di produzione più sicuro e conveniente è la reazione del cloro gassoso con carbonato di sodio idrato a 20-30 °C:[3]
- .
Questa reazione può essere eseguita in assenza di acqua ma richiede il riscaldamento a temperature di 150-250 °C; poiché l'anidride ipoclorosa è instabile a queste temperature[16], deve essere continuamente rimossa per evitare la decomposizione termica:
- .
Ancora un altro metodo è il seguente: una piccola quantità di anidride ipoclorosa può essere prodotta facendo passare del cloro perfettamente anidro sull'ossido mercurico (HgO) a 0 °C:
- .
Remove ads
Struttura ed altre proprietà
Riepilogo
Prospettiva
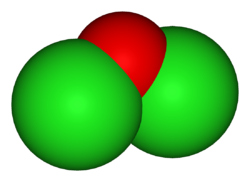
La molecola dell'anidride ipoclorosa, come quella dell'acqua e quella dell'acido ipocloroso, è angolare, come previsto dal modello VSEPR (molecola del tipo (AX2E2) e dalla teoria del legame di valenza, per la quale l'ossigeno centrale è ibridato sp3,[17] quindi con geometria pseudo-tetraedrica ed angoli di legame idealmente di 109,5°. Essendo l'ossigeno più elettronegativo del cloro, esso porta una parziale carica negativa, compensata dalle due cariche parziali positive su i due Cl (δ+Cl–O2δ––Clδ+). Ad influenzare l'angolo Cl–O–Cl concorrono la repulsione tra le coppie solitarie sull'ossigeno centrale, che tende a farlo restringere; la repulsione tra i due atomi di Cl, che si trovano ad una distanza (279,3 pm)[18] che è molto inferiore al doppio dei loro raggi di van der Waals (358-380 pm), che tende a farlo allargare;[19] infine, la presenza sui clori di cariche parziali dello stesso segno crea anch'essa un'azione repulsiva tendente a far ampliare l'angolo.
Sperimentalmente, da un'indagine spettroscopica rotazionale nelle microonde,[18] si trova che l'angolo Cl–O–Cl, che risulta dal compromesso delle influenze dei fattori sopra menzionati, è di 110,88°; la lunghezza Cl–O è di 169,6 pm, quasi uguale alla somma dei raggi covalenti di O e Cl (168 pm[20]). La simmetria molecolare, come nel caso dell'acqua, è C2v.[21] Nonostante che la differenza di elettronegatività tra O e Cl (0,28) sia qui molto più piccola che tra O e H (1,24), il momento dipolare della molecola è notevole, 1,69 D,[22] solo poco inferiore a quello di H2O (1,86 D).
Nel caso della molecola analoga F2O (difluoruro di ossigeno), con l'ossigeno centrale anche qui formalmente ibridato sp3 econ un momento dipolare molto inferiore (0,297 D[23]), ma che qui porta su di sé una carica parziale positiva (l'opposto che in Cl2O), l'angolo su O è notevolmente più stretto, 103,1°.[24] Questo è però in accordo con la regola di Bent[25] secondo la quale il carattere s negli orbitali ibridi è minore nei legami che l'atomo centrale forma con atomi più elettronegativi (qui F), che con atomi meno elettronegativi (qui Cl); per Cl2O il maggiore carattere s si traduce in un ampliamento dell'angolo con cui l'atomo centrale (O) si lega ai clori in Cl2O.[26]
Allo stato solido, Cl2O cristallizza nel gruppo spaziale tetraedrico I41/amd, essendo quindi isostrutturale con la forma cristallina dell'acqua ad alta pressione, il ghiaccio VIII. La distanza Cl−O risulta leggermente maggiore (170,92 pm) che nella molecola isolata in fase gassosa.[27]
Chimica ionica in fase gassosa
Il potenziale di ionizzazione normale di Cl2O ammonta a 10,91 ± 0,02 eV,[28] un valore minore di quello di Cl2 (11,481 eV).[29]
L'affinità elettronica è l'energia rilasciata da una specie chimica in fase gassosa quando acquisisce un elettrone ed è correlata in generale al potere di una specie chimica di strappare elettroni ad altre specie e quindi al suo potere ossidante.[30][31][32] Per Cl2O è calcolata essere 3,12 eV,[33] che è un valore ben maggiore di quello relativo al cloro molecolare (Cl2), pari a 2,50 eV.[34] Questo è in accordo qualitativo con il maggior potenziale di riduzione in ambiente acido di HOCl (Cl+1, come in Cl2O), rispetto a quello di Cl2 (Cl0), per dare Cl−: +1,484 V contro +1,358 V.[35]
Remove ads
Reazioni
Riepilogo
Prospettiva
L'anidride ipoclorosa è altamente solubile in acqua,[36] dove esiste in equilibrio con HOCl. La velocità della reazione di idrolisi è abbastanza bassa da consentire l'estrazione di Cl2O con solventi organici come il tetracloruro di carbonio (CCl4),[3] ma la costante di equilibrio favorisce decisamente la formazione di acido ipocloroso (HOCl).[37]
- .
Nonostante ciò, è stato suggerito che l'anidride ipoclorosa possa essere la specie attiva nelle reazioni di HOCl con olefine e composti aromatici,[38][39] nonché nella clorazione dell'acqua potabile.[40]
Con composti inorganici
L'anidride ipoclorosa reagisce con gli alogenuri e ossoalogenuri metallici al loro massimo stato di ossidazione, 2 (o 4) atomi di cloro vengono sostituiti da uno (o 2) atomi di ossigeno, per formare ossoalogenuri, anche alcuni insoliti:[3][41][42]
Reazioni simili sono state osservate anche con alogenuri e ossoalogenuri di metalloidi e non metalli; in tali casi la reazione si risolve anche in un'ossidazione degli elementi coinvolti :[45][46]
Con l'anidride nitrica reagisce dando principalmente il nitrato di cloro:[43]
N2O5 + Cl2O → 2 Cl−ONO2
Con composti organici
L'anidride ipoclorosa è un agente clorurante efficace. Può essere utilizzata sia per la clorurazione della catena laterale che sull'anello di substrati aromatici disattivati[47]. Per gli aromatici attivati come i fenoli e gli eteri arilici reagisce principalmente per dare prodotti alogenati sull'anello[48].
Fotochimica
L'anidride ipoclorosa subisce la fotolisi, formando ossigeno e cloro molecolari come prodotti finali:
- .
Il processo è tipicamente radicalico, e la fotolisi flash mostra che il radicale ipoclorito [ClO]• è un intermedio chiave in questa trasformazione.[49]
Proprietà esplosive
L'anidride ipoclorosa è esplosiva, anche se mancano ricerche moderne su questo comportamento. Le miscele a temperatura ambiente con l'ossigeno non potevano essere fatte esplodere da una scintilla elettrica finché non contenevano almeno il 23,5% di Cl2O[50], che è un limite minimo di esplosività estremamente elevato. Ci sono rapporti contrastanti sul fatto che esploda per esposizione a una forte luce[51][52]. Anche il riscaldamento superiore a 120 °C, o un rapido riscaldamento a temperature inferiori, sembra portare a esplosioni[3]. È stato segnalato che l'anidride ipoclorosa liquida è sensibile agli urti[53].
Remove ads
Note
Voci correlate
Altri progetti
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


![{\displaystyle {\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{{\mskip {1mu}}(\mathrm {g} )}}~\leftrightarrows \mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{{\mskip {1mu}}(\mathrm {aq} )}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/f2b5067c2574eaedb967294793645139e6b20242)

![{\displaystyle {2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ \mathrm {HgO} {}\mathrel {\longrightarrow } {}\mathrm {HgCl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ \mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/fd32be4ed769927d4afd874b4eb1b7a1fe5c9a14)
![{\displaystyle {2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ 2\,\mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} ~\ {}+{}\ 2\,\mathrm {NaHCO} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ 2\,\mathrm {NaCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ce722b93f98b9c7ac593517a6cb92e561e3cf51a)
![{\displaystyle {2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ 2\,\mathrm {NaHCO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} ~\ {}+{}\ 2\,\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ 2\,\mathrm {NaCl} ~\ {}+{}\ \mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b2d25ad7e8819d25711a8e09b4da0772c2b6bebc)
![{\displaystyle {2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ \mathrm {Na} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} ~\ {}+{}\ \mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ 2\,\mathrm {NaCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/1396d1697d58af875e7f31e22e594a9dad843e36)
![{\displaystyle {2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ 2\,\mathrm {HgO} {}\mathrel {\longrightarrow } {}\mathrm {HgCl} {\vphantom {A}}_{\smash[{t}]{2}}~\cdot \mathrm {HgO} ~\ {}+{}\ \mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} ~\uparrow }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/fa73713dadd2ced2b6c3cf54cecb22213d0287fb)


![{\displaystyle {2\,\mathrm {HOCl} {}\mathrel {\longrightleftharpoons } {}\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} ~\ {}+{}\ \mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {;}{\mkern {6mu}}\mathrm {K} {\vphantom {A}}_{\smash[{t}]{(}}0{\vphantom {A}}^{\circ }\mathrm {C} ){}={}3{,}55\,\cdot 10{\vphantom {A}}^{-3}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/2e28d80c3dc6a00202ca6febb1735ab8f70c3a26)
![{\displaystyle {\mathrm {VOCl} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ \mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {VO} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ 2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/20583d1b4f470241b17075bf5a42ac4fc5cafeed)
![{\displaystyle {\mathrm {TiCl} {\vphantom {A}}_{\smash[{t}]{4}}~\ {}+{}\ \mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {TiOCl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ 2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/bf166808ffbe18c3866de99524201969406b7bc8)
![{\displaystyle {\mathrm {SbCl} {\vphantom {A}}_{\smash[{t}]{5}}~\ {}+{}\ 2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {SbO} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ 4\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/6d9d0d53492c81b6c865776fbdc73e39d8881acb)
![{\displaystyle {\mathrm {AsCl} {\vphantom {A}}_{\smash[{t}]{3}}~\ {}+{}\ 2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {AsO} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ 3\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/e67c7d7cc5f98f1deaf44a8def2c09198762e9de)
![{\displaystyle {\mathrm {NOCl} ~\ {}+{}\ \mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Cl} ~\ {}+{}\ \mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/227406dbe74d924a2ad9e1fbe079ceff043e5269)
![{\displaystyle {2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}~\ {}+{}\ \mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/20d77dd6ba0eb8171fe3e798add13b616efe4d90)