Loading AI tools
proteina Da Wikipedia, l'enciclopedia libera
La Green Fluorescent Protein (GFP, in italiano proteina fluorescente verde) è una proteina espressa nella medusa Aequorea victoria. Grazie alla sua proprietà di fluorescenza, alle sue modeste dimensioni e alla possibilità di modificarne entro certi limiti le caratteristiche spettroscopiche, la GFP è diventata negli ultimi decenni un diffuso strumento per esperimenti e tecniche di biologia molecolare. La GFP, se colpita e eccitata da una radiazione ad una specifica lunghezza d'onda, è in grado di riemettere luce di colore verde acceso. Sono ormai molte comunque le forme di GFP modificate, in grado di assorbire ed emettere radiazioni diverse da quelle della proteina originaria.
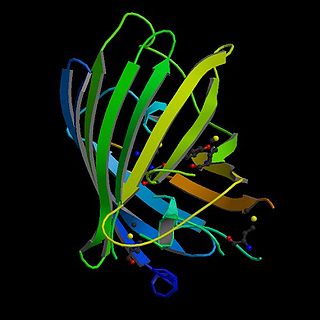

La GFP è costituita da 238 amminoacidi e ha un peso molecolare di 27000 Dalton. È costituita da 11 foglietti beta disposti in circolo a formare una struttura denominata barile-β (β-barrel o β-can). Inoltre sono presenti due segmenti ad alfa elica, uno alla base del barile, l'altro lungo il suo asse centrale. Quest'ultima elica contiene il fluoroforo (ovvero la porzione in grado di emettere fluorescenza), formato a partire dal tripeptide Ser 65-Tyr 66-Gly 67. La struttura, nel complesso, è molto compatta, in modo da proteggere il fluoroforo da reazioni con altre molecole che lo potrebbero inattivare.
La proteina impiega circa dieci minuti a ripiegarsi nella sua corretta struttura terziaria. Sono dopo necessarie tre reazioni successive per la formazione del fluoroforo funzionante: ciclizzazione, deidratazione (entrambe complessivamente in circa 3 minuti) e ossidazione (dai 19 agli 83 minuti). In seguito a questi eventi si forma un anello eterociclico a cinque atomi (anello imidazolinone) e grazie a deidratazione e ossidazione si formano due ulteriori doppi legami. Il fluoroforo, qualora eccitato, è così in grado di emettere la caratteristica luce verde.
Come ogni sostanza fluorescente, anche la GFP deve prima essere colpita da una radiazione, con lunghezza d'onda e quindi energia, che permetta ad alcuni suoi elettroni di passare nello stato eccitato (fase di assorbimento); dopo un breve istante di tempo, gli elettroni ritornano nello stato fondamentale (stato iniziale) e riemettono un'altra radiazione, con energia però inferiore a quella iniziale (fase di emissione). Nel caso della GFP, l'assorbimento ha dei picchi con radiazioni a lunghezze d'onda di 395 nm e 475 nm. L'emissione avrà un picco massimo intorno a 505 nm. Questo significa che può essere utilizzata, per eccitare la proteina, sia una radiazione ultravioletta (395 nm), sia una radiazione nello spettro visibile (475 nm), in particolare di colore blu. In entrambi i casi la GFP emetterà una radiazione di colore verde (505 nm). In genere sono utilizzate per l'assorbimento radiazioni blu, per evitare i rischi legati all'uso di raggi UV.

La GFP espressa in Aequorea victoria è definita anche GFP wild type e fa parte della prima classe di queste proteine. Esistono in tutto sette classi, distinte in base al tipo di mutazione (o di mutazioni) rispetto al wild type e alle conseguenti diverse caratteristiche di assorbimento e di emissione. Le GFP di classe II e III, ad esempio sono molto simile alla GFP di classe I, ma presentano uno solo dei due picchi di assorbimento in essa presenti. Della classe IV fanno parte le cosiddette YFP (yellow fluorescent protein), che fluorescono nel giallo, invece che nel verde. Alla classe V e VI appartengono rispettivamente le CFP (cyan fluorescent protein), che emettono con color azzurro-grigio e le BFP (blue fluorescent protein), che emettono nel blu. Le diverse forme di GFP sono ottenute tramite mutagenesi casuale o mutagenesi sito specifica del suo gene. Mutazioni sono introdotte anche per modificare caratteristiche come intensità di emissione, velocità di ripiegamento, sensibilità al pH.
La luminescenza di GFP è un fenomeno intrinseco alla stessa proteina e non richiede substrati né enzimi, quindi questa è molto usata come marcatore nelle indagini di identificazione e localizzazione subcellulare delle proteine. In questi saggi la sequenza nucleotidica della proteina X da identificare viene fusa con la sequenza nucleotidica di GFP in un vettore di espressione che solitamente è un plasmide. Il plasmide ricombinante viene inserito nella cellula eucariotica, solitamente tramite elettroporazione, in modo che, una volta all'interno della cellula, il plasmide si integri nel genoma per ricombinazione sito specifica all'interno del gene per la proteina mitocondriale. Questo processo porta all'inattivazione del gene selvatico per X e all'espressione del gene ricombinante per X-GFP. L'identificazione e localizzazione subcellulare di X-GFP può allora essere visualizzata tramite la microscopia a fluorescenza che rivela i segnali prodotti da GFP e che quindi identificano anche X. Questa tecnica è molto potente in quanto la localizzazione della proteina studiata viene rivelata in vivo ed è possibile seguirla anche nel tempo.
Il Vertico SMI usa GFP e combina infine la microscopia con la modulazione spaziale dell'illuminazione raggiungendo risoluzioni inferiori ai 10 nanometri (1 nanometro = 1 nm = 1 × 10−9 m)[1][2][3].

Julian Voss-Andreae, artista nato in Germania e specializzato in "sculture proteiniche,"[4] ha realizzato sculture basate sulla struttura della GFP, fra le quali la "Proteina Fluorescente Verde" (2004) alta 1,70 m[5] e la "Medusa d'acciaio" (2006) alta 1,40 m. Quest'ultima scultura si trova nel luogo della scoperta della GFP, effettuata da Shimomura nel 1962, vale a dire i Friday Harbor Laboratories dell'Università di Washington[6].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.