Loading AI tools
farmaco antivirale Da Wikipedia, l'enciclopedia libera
Il Favipiravir, noto anche come T-705 (commercializzato come Avigan o Favilavir), è un farmaco antivirale che possiede un'attività diretta contro molti virus a RNA. È stato sviluppato dalla Toyama Kagaku Kōgyō, una consociata giapponese della Fujifilm Holdings Corporation.
| Favipiravir | |
|---|---|
 | |
| Nome IUPAC | |
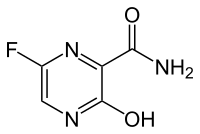
| 6-fluoro-3-idrossi-2-pirazinecarbossammide | |
| Nomi alternativi | |
| T-705 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C5H4FN3O2 |
| Numero CAS | |
| Codice ATC | J05 |
| PubChem | 492405 |
| DrugBank | DBDB12466 |
| SMILES | C1=C(N=C(C(=O)N1)C(=O)N)F |
| Dati farmacologici | |
| Categoria farmacoterapeutica | antivirale |
| Indicazioni di sicurezza | |
Chimicamente è un 6-fluoro-3-idrossi-2-pirazinecarbossammide.[1] Come alcuni farmaci antivirali sperimentali (T-1105 e T-1106), è un derivato della pirazinecarbossammide.
Il favipiravir è stato sviluppato, con brevetto del 1999, dalla Toyama Kagaku Kōgyō, una consociata della Fujifilm Holdings Corp.
In origine, il favipiravir doveva essere commercializzato in Giappone come farmaco antinfluenzale, come analogo dell'oseltamivir.
Nel 2014, la Fujifilm ha presentato alla Food and Drug Administration un'istanza per l'uso di pillole di favipiravir nel contrasto a ebolavirus.[2]
L'approvazione del farmaco in Giappone, a causa della sua teratogenicità,[3] prevede la somministrazione solo su ceppi virali per i quali non esistono altri farmaci efficaci; considerandolo un farmaco di riserva.[4][5]
Secondo quanto riportato dai media locali, il governo giapponese possiede circa 2 milioni di dosi di Avigan e lo fornirà alle istituzioni mediche, se necessario;[1] analogamente ha fatto Taiwan.[6]
Nel febbraio 2020, il Favipiravir è stato studiato in Cina come trattamento sperimentale della malattia emergente COVID-19.[7][8][9] Ha ricevuto l'approvazione a breve termine in Cina il 16 febbraio 2020 come antivirale, e viene prodotto in Cina con il nome di Favilavir.[10]
Il 16 marzo 2020 la Corea del Sud ha dichiarato che non avrebbe importato il farmaco per il trattamento di COVID-19.[5] La scelta è stata motivata dai dubbi sulla sua efficacia, dall'insufficiente sperimentazione sull'uomo e dalle perplessità sui gravi effetti collaterali rilevati sugli animali.[5]
In Italia, il 22 marzo 2020, l'AIFA ha autorizzato la sperimentazione del farmaco in Lombardia, Veneto e Emilia Romagna, per valutare l’impatto del farmaco nelle fasi iniziali della malattia[11][12]. L'AIFA ha sottolineato che le evidenze scientifiche a favore di questo farmaco siano basate soprattutto su un singolo studio preliminare, ma che la Commissione Tecnico-Scientifica dell'agenzia, riunita in seduta permanente, sottopone a valutazione ogni giorno tutte le evidenze.[13]
Il 24 marzo 2020, Chiaki Hasegawa, portavoce di Fujifilm Holdings Corp., ha espresso perplessità sull'utilizzo del farmaco sottolineando come il farmaco non fosse stato ancora sufficientemente sperimentato.[14]
Sia l'EMA europea che la FDA americana non ne hanno autorizzato l'utilizzo.[13]
Non esistono studi clinici pubblicati relativi alla sicurezza del farmaco o alla sua efficacia nel trattamento della malattia da COVID-19. Sono unicamente noti studi preliminari, disponibili attualmente solo come versione pre-proof.
Ricercatori cinesi hanno suggerito, in uno studio pre-proof (cioè non sottoposto a revisione di esperti) su 80 pazienti affetti da COVID-19 in forma lieve e con massimo 7 giorni di malattia alle spalle, che il farmaco potrebbe essere efficace nel trattamento della COVID-19 causata dal SARS-CoV-2.[15] In questo studio, il favipiravir ha accorciato a 4 giorni il decorso della malattia, rispetto agli 11 giorni dell'antivirale sperimentale lopinavir/ritonavir (anch'esso non autorizzato per COVID-19).[15][16] I pazienti trattati nello studio hanno riportato miglioramenti visibili con TAC (sempre rispetto a lopinavir/ritonavir) del 47%. Gli stessi autori dello studio segnalano che, non trattandosi di uno studio clinico controllato, ci potrebbero essere inevitabili distorsioni dovute alla selezione arbitraria dei pazienti reclutati.[15]
Ricercatori coreani, sempre in uno studio pre-proof, hanno osservato l'assenza di efficacia contro il virus COVID-19, a differenza di farmaci rivelatisi efficaci quali lopinavir e remdesivir.[17]
Il Favipiravir è un profarmaco che viene metabolizzato nella sua forma attiva, favipiravir-ribofuranosil-5'-trifosfato (favipiravir-RTP), disponibile in formulazioni sia orali sia endovenose.[18][19] Si ritiene che l'ipoxantina umana guanina-fosforibosiltransferasi (HGPRT) svolga un ruolo chiave in questo processo di attivazione.[20]
Il favipiravir non inibisce la sintesi di RNA o DNA nelle cellule di mammifero e non comporta tossicità significativa per esse.[21]
Si ritiene che il meccanismo d'azione del farmaco sia correlato all'inibizione selettiva dell'RNA polimerasi-RNA-dipendente virale.[22] Altre ricerche suggeriscono che il favipiravir induce mutazioni letali dell'RNA virale, producendo un fenotipo virale non vitale.[23] Ricerche hanno anche scoperto che la presenza di analoghi delle purine possono ridurre l'attività antivirale di favipiravir, suggerendo la competizione tra favipiravir-RTP e nucleosidi purinici per il legame RdRp; il dominio catalitico RdRp sembra essere comune nei virus a RNA.[24]
Gli esperimenti sugli animali in Giappone ne mostrarono potenziali teratogenesi (lo sviluppo anormale di alcuni organi del feto durante la gravidanza). Per questo motivo, l'approvazione della produzione da parte del Ministero della salute giapponese fu notevolmente ritardata, per poi essere limitata ai soli casi di emergenza.[25]
Sempre in esperimenti condotti su animali, il Favipiravir ha dimostrato attività contro i virus influenzali, virus del Nilo occidentale, virus della febbre gialla, virus dell'afta epizootica, nonché altri flavivirus, arenavirus, bunyavirus e alphavirus.[26] Ne è stata anche dimostrata l'attività contro gli enterovirus[26] e il virus della febbre della Rift Valley.[27] Favipiravir ha mostrato una certa efficacia contro il virus Zika negli studi sugli animali, pur essendo stato meno efficace di altri antivirali come MK-608 della Merck & Co.[28] Nel 2013, uno studio in vitro ha mostrato la capacità di favipiravir di indurre in H1N1 delle mutagenesi che ne riducono l'infettività[29].
Durante l'epidemia di Ebola del 2014, il Giappone si è offerto di fornire il favipiravir, ove necessario.[30]
Nell'ottobre del 2014, un'infermiera francese di MSF in Liberia è sopravvissuta all'infezione del ebolavirus, dopo essere stata trattata con favipiravir.[31]
L'OMS aveva infatti dichiarato eticamente accettabile, nel corso dell'epidemia di Ebola 2014, la somministrazione di medicinali preventivi o terapeutici, anche senza prove della loro efficacia nell'uomo, purché i risultati sperimentali indicassero almeno una efficacia sugli animali.[32]
Nel marzo del 2015, la Medivector Inc, una società di biotecnologie del Massachusetts, ha completato uno studio clinico di fase III, diretto dalla Dott.sa Carol A. Epstein, finalizzata a studiare la sicurezza e l'efficacia di Favipiravir nel trattamento dell'influenza. A marzo 2020, non sono ancora stati pubblicati gli esiti dello studio.[33]
In una ricerca del 2015, il farmaco ha mostrato una certa efficacia anche contro il virus della rabbia (in vitro e in vivo sui topi)[34]. Tuttavia, nel 2017, l'utilizzo sperimentale su una paziente umana infetta dal virus, non ha contrastato il fatale decorso della malattia[35].
Nel 2018, uno studio della American Society for Microbiology, ha dimostrato che favipiravir ha una scarsa attività antivirale nelle cellule respiratorie umane primarie.[36]
Il 30 Maggio 2020, Il Ministero della Salute russo ha approvato una versione generica di favipiravir denominata Avifavir. RFID ha sostenuto lo sviluppo di Avifavir lo ha trovato altamente efficace nella prima fase degli studi clinici.[senza fonte]
Il Favipiravir è teratogeno, ossia può causare lo sviluppo anormale di alcuni organi del feto durante la gravidanza. Pertanto, nelle donne con gravidanza confermata o sospettata, la somministrazione deve essere evitata.[3][24]
Dati prodotti su animali da esperimento indicano: effetti avversi sui tessuti ematopoietici, come riduzione della produzione di globuli rossi, e aumento degli indici di citolisi epatica e colestasi, come l'aspartato aminotransferasi (AST), la fosfatasi alcalina (ALP), la alanina aminotransferasi (ALT) e la bilirubina totale ed un aumento della vacuolizzazione negli epatociti.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.