Loading AI tools
L'esaclorocicloesano (conosciuto erroneamente anche come benzene esaclorato) è il nome di diversi isomeri strutturali del gruppo degli idrocarburi alogenati.
Il composto più famoso appartenente al gruppo dei esaclorocicloesano è il Lindano (γ-esaclorocicloesano), conosciuto soprattutto per le sue proprietà insetticide. I composti esaclorocicloesanici sono divisi in isomeri in base all'orientazione degli atomi di cloro presenti sull'anello e vengono nominati antecedendo lettere greche minuscole. Gli altri isomeri strutturali commercialmente conosciuti sono l'α-esaclorocicloesano , β-esaclorocicloesano e il δ-esaclorocicloesano oltre al ε-esaclorocicloesano.[1] Il η- e θ-isomeri sono stati solo in un prodotto di laboratorio.[2] In passato il Lindano veniva prodotto tramite clorazione del benzene sotto radiazioni UV. Il processo però produceva 5 dei possibili 8 isomeri, quindi anche una grande quantità di prodotti indesiderati quali gli α-,β-, δ- e ε-isomeri. Questi prodotti risultano più tossici, più difficili da degradare e persino meno importanti (in veste di insetticida) della non troppo problematica struttura γ. Solo tale isomero venne per tanto più tardi impiegato come veleno da ingestione e da contatto. Il Lindano venne prodotto per la prima volta nel 1825 da Michael Faraday. Dalla degradazione termica vengono prodotti fosgene e acido cloridrico.
| Esaclorocicloesani | |||||
| Nome | α-esaclorocicloesano | β-esaclorocicloesano | γ-esaclorocicloesano | δ-esaclorocicloesano | ε-esaclorocicloesano |
| Formula di struttura |  |  | 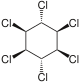 | 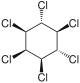 | 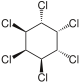 |
| Struttura spaziale (per l'isomero α sono mostrati anche gli atomi d'drogeno) |
 |  |  |  | |
| Numero CAS | Miscela isomerica 608-73-1 | ||||
| Nomero CAS | 319-84-6 | 319-85-7 | 58-89-9 | 319-86-8 | 6108-10-7 |
| PubChem | 727 | ||||
| Formula bruta | C6H6Cl6 | ||||
| Massa molecolare | 290,83 g·mol−1 | ||||
| Stato della materia | solido | ||||
| Descrizione breve | Sostanza solida tra il giallino e il trasparente dall'odore di muffa | ||||
| Punto di fusione | 159-160 °C[3] | 309 °C[4] | 113 °C[5] | 139 °C[6] | |
| Punto di ebollizione | 288 °C[3] | 323 °C (Degradazione)[5] | |||
| Densità | 1,89 g/cm3[4] | 1,85 g/cm3[5] | 1,55 g/cm3[6] | ||
| Solubilità | Minimamente solubile in acqua (0,2–8 mg/l)[3][4][5][6] | ||||
| Rischio chimico[3][4][5][6] | |||||
| Frasi R | Template:Frase-R | Template:Frase-R | Template:Frase-R | ||
| Frasi S | Template:Frase-S | Template:Frase-S | Template:Frase-S | ||
In aria
L'esaclorocicloesano è degradato nell'atmosfera, quando presente nell'aria, reagendo con radicali idrossilici prodotti fotochimicamente, ma la velocità di reazione non è molto rapida quindi HCH presenta un periodo di vita atmosferica relativamente lungo. Non assorbendo a lunghezze d'onda >290 nm, la sua diretta fotolisi non si ritiene rilevante nell'ambiente.
In acqua
In acqua la biodegradazione è creduto essere il processo degradativo dominante, anche se idrolisi e fotolisi possono anche accadere. È stato dimostrato che il γ-esaclorocicloesano è degradato da cianobatteri azotofissatori. Questi batteri riducono l'effetto tossico del γ-HCH seguendo ripetute inoculazioni[7]. La declorinazione del γ-HCH a γ-pentaclorocicloesene è anche stata dimostrata in sospensione acquosa di funghi[8] e colture di alghe[9]. L'idrolisi non è considerato un importante processo di degradazione per l'esaclorocicloesano a pH neutro, ma in condizioni alcaline il γ-esaclorocicloesano è idrolizzato abbastanza rapidamente. Siccome l'esaclorocicloesano non contiene cromofori che assorbano luce della regione uv (>290 nm), la fotolisi diretta non è possibile. Può avvenire, invece, una fotolisi indiretta; sostanze come l'acido umico o fulvico sono ben noti agenti fotosensibilizzanti e sono praticamente ubiqui in acqua naturale e possono assorbire luce e trasferire l'energia eccitante all'esaclorocicloesano. Sostanze ossidanti comunemente trovate in acqua naturale, come radicali perossidici, radicali idrossilici o ossigeno singoletto sono in grado di degradare HCH in acqua. Va ricordato che la degradazione dei diversi isomeri presenta differenti velocità, nell'ordine α > γ > β. Questo perché un numero maggiore di atomi cloro in posizione planare nel cicloesano, stabilizza la struttura, fornendo un minore guadagno energetico per qualsiasi processo degradativo, e non offre punti di attacco favorevoli per iniziare il processo degradativo. Quindi i tempi di degradazione, già ampi per il lindano sono ancora più lunghi per i suoi contaminati e sottoprodotti di produzione α- e β-esaclorocicloesano.
Nel suolo e nei sedimenti
Il processo biodegradativo è il principale fattore di degradazione del γ-HCH nel suolo o nei sedimenti, anche se l'idrolisi può risultare anche rilevante in suoli alcalini umidi. È stato riportato che 71 microorganismi su 147 isolati da terra grassa sono capaci di utilizzare soluzioni di γ-HCH come unica sorgente di carbonio [10]. Un batterio della specie delle pseudomonas, anche isolato da suolo pretrattato, è capace di degradare il γ-HCH e l'α-HCH, ma non il β-HCH, in 10–20 giorni in condizioni sia aerobiche che anaerobiche [11]. Il β-esaclorocicloesano è l'isomero più persistente, con un tempo di dimezzamento di 184 e 100 giorni, rispettivamente su terreno coltivato ed incolto, seguito dal γ-esaclorocicloesano con 107 e 62.1 giorni, l'α-esaclorocicloesano con 54.4 e 56.1 giorni ed infine il δ-esaclorocicloesano con 33.9 e 23.4 giorni. Una ricerca su suolo e vegetazione di un terreno circostante un sito di interramento rifiuti industriali in Germania a 10 anni dopo l'ultimo scarico di esaclorocicloesano, rivelò la presenza di isomero β compresa tra l'80 ed il 100% del totale HCH residuo[12].
Il processo biodegradativo include la declorinazione idrolitica con la seguente rottura dell'anello cicloesanico ed infine la totale o parziale mineralizzazione[13]. La trasformazione abiotica e processi degradativi del γ-HCH, come degli altri isomeri, nel suolo o nei sedimenti, non si ritengono significativi. Come già discusso, nei processi in acqua, la fotolisi e l'idrolisi non sono considerate importanti vie degradative di tutti gli isomeri dell'esaclorociloesano, nonostante l'eccezione dell'idrolisi in condizioni alcaline.
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.