Top Qs
Timeline
Obrolan
Perspektif
Mycobacterium tuberculosis
Dari Wikipedia, ensiklopedia bebas
Remove ads
Mycobacterium tuberculosis (M. tb) adalah spesies bakteri patogen dalam famili Mycobacteriaceae serta menjadi penyebab dari tuberkulosis (TBC).[1][2] Pertama kali ditemukan pada 1882 oleh Robert Koch, M. tuberculosis memiliki permukaan sel berlilin yang tak biasa yang disebabkan adanya asam mikolat. Pelapisan ini memengaruhi pewarnaan Gram, sehingga M. tuberculosis dikategorikan Gram positif lemah.[3] Uji ketahanan asam seperti pewarnaan Ziehl–Neelsen, atau pewarnaan fluoresensi menggunakan auramin dapat digunakan untuk mengidentifikasi M. tuberculosis di bawah mikroskop. Fisiologi M. tuberculosis bersifat aerob dan memerlukan banyak oksigen. Sebagai patogen sistem pernapasan mamalia, bakteri ini menyerang paru-paru. Metode diagnostik yang cukup umum adalah uji tuberkulin, ketahanan asam, kultur mikrobiologi, serta PCR.[2][4]

Remove ads
Sejarah
Ringkasan
Perspektif
M. tuberculosis yang dikenal sebagai "tubercle bacillus", pertama kali dijelaskan pada 24 Maret 1882 oleh Robert Koch, yang kemudian menerima Nobel Prize dalam bidang Fisiologi atau Kedokteran untuk penemuan ini pada tahun 1905. Sehingga bakteri ini juga dikenal sebagai "Koch's bacillus".[7]
M. tuberculosis telah ada sepanjang sejarah, tetapi namanya sering berubah dari waktu ke waktu. Pada tahun 1720, sejarah tuberkulosis mulai terbentuk menjadi apa yang dikenal sekarang. Seperti yang dijelaskan oleh Benjamin Marten dalam A Theory of Comsumption, tuberkulosis disebabkan oleh makhluk hidup kecil yang ditularkan melalui udara ke pasien lain.[8] Penyakit yang ditularkan melalui udara ini termasuk penyakit menular paling mematikan di seluruh dunia dan memengaruhi hampir 2 miliar orang di dunia saat ini. M. tuberculosis dapat menyerang pada wanita, anak-anak, dan individu yang terinfeksi virus seperti HIV. Bakteri ini mudah ditransmisikan lewat bersin, batuk, atau hanya berbicara dengan penderita. Droplet yang terkontaminasi dapat menginfeksi siapa saja dan mereka menjadi terkontaminasi M. tuberculosis. Dengan demikian, mereka menjadi bagian dari 1,8 miliar orang di seluruh dunia yang saat ini berjuang melawan penyakit ini.[9]
Remove ads
Mikrobiologi
Ringkasan
Perspektif
M. tuberculosis yang ditemukan pada tahun 2019 memiliki 9 sub spesies antara lain M. tuberculosis sensu stricto, M. africanum, M. canetti, M. bovis, M. caprae, M. microti, M. pinnipedii, M. mungi, dan M. orygis.[10] Bakteri ini membutuhkan oksigen untuk tumbuh, tidak menghasilkan spora, dan non motil.[11][12] M. tuberculosis membelah setiap 18-24 jam. Pembelahan ini sangat lambat jika dibandingkan bakteri lain yang cenderung membelah dalam beberapa menit. Bakteri ini berbentuk basil kecil yang resistan terhadap disinfektan kadar rendah dan dapat bertahan dalam lingkungan kering selama berminggu-minggu. Dinding sel M. tuberculosis berbeda dari bakteri lainnya yang kaya akan lipid seperti asam mikolat dan kemungkinan besar digunakan untuk bertahan dari kekeringan serta salah satu faktor virulensi.[13]
Mikroskopis
Pewarnaan bakteri lain biasanya diidentifikasi dengan mikroskop menggunakan pewarnaan Gram. Namun asam mikolat pada dinding sel M.tuberculosis tidak dapat menyerap pewarna. Oleh karena itu, untuk identifikasi M. tuberculosis biasanya digunakan pewarnaan Acid-fast seperti Ziehl-Neelsen, atau pewarnaan fluoresens yang menggunakan auramin.[14] Pada pengamatan mikroskop akan teramati sel berbentuk batang melengkung dan terlihat terbungkus, karena adanya asam lemak pada dinding sel yang saling menempel. Penampakan ini disebut cording atau seperti untaian kabel yang membentuk tali.[11] M. tuberculosis ditandai dalam jaringan dengan mengaseasi granuloma yang mengadung Langhans giant cell, yang memiliki pola inti "horseshoe".
Struktur Dinding Sel
Struktur dinding sel Mycobacterium tuberculosis unik di antara prokariota lain dan merupakan faktor utama virulensi bakteri. Kompleks dinding sel mengandung peptidoglikan dan juga terdiri dari lipid yang kompleks. Lebih dari 60% dinding sel bakteri ini adalah lipid. Fraksi lipid dinding sel M. tuberculosis terdiri dari tiga komponen utama yaitu asam mikolat, cord factor dan wax-D. Asam mikolat adalah lipid bercabang alfa unik yang ditemukan di dinding sel Mycobacterium dan Corynebacterium. Asam mikolat membentuk 50% dari berat kering selubung sel mikobakteri. Asam mikolat adalah molekul hidrofobik kuat yang membentuk cangkang lipid di sekitar bakteri dan memengaruhi sifat permeabilitas pada permukaan sel. Asam mikolat dianggap sebagai penentu virulensi yang signifikan pada M. tuberculosis karena dapat mencegah serangan mikobakteri oleh protein kationik, lisozim, dan oksigen radikal dalam granul fagositik. Asam mikolat juga mampu melindungi mikobakteri ekstraseluler dari pengendapan komplemen dalam serum. Cord factor bertanggung jawab atas serpentine cording. Cord factor bersifat toksik bagi sel mamalia dan penghambat migrasi sistem imun. Cord factor banyak diproduksi pada strain virulen M. tuberculosis. Wax-D dalam selubung sel adalah komponen utama dari Freund's complete adjuvant (CFA).[15]
Diagnostik
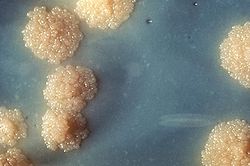
M. tuberculosis dapat ditumbuhkan di laboratorium. Dibandingkan dengan bakteri lain yang umum dipelajari, M. tuberculosis memiliki tingkat pertumbuhan yang sangat lambat. Media yang umum digunakan untuk menumbuhkan bakteri ini yaitu medium cair seperti Middlebrook 7H9 atau 7H12, medium padat berbasis-telur seperti Lowenstein-Jensen (LJ), dan medium padat seperti Middlebrook 7H11 atau 7H10.[11] Kultur yang diinokulasi pada medium LJ tampak berwarna coklat, koloni granular, kasar dan keras. Kultur harus diinkubasi sekitar empat minggu. Bakteri ini juga dapat dibedakan dari mikobakteri lain dengan produksi katalase dan niasinnya.[16] Tes lain untuk identifikasi yaitu probe gen dan MALDI-TOF.[17][18]
Remove ads
Patogenitas
Ringkasan
Perspektif
Manusia adalah satu-satunya reservoir M. tuberculosis yang diketahui. M. tuberculosis tidak ditularkan melalui berjabat tangan, bersentuhan dengan dudukan toilet, berbagi makanan atau minuman, dan berbagi sikat gigi. Dahak bisa menjadi salah satu akar penularan bakteri ini. Namun, penyebaran utama adalah melalui tetesan udara yang berasal dari seseorang yang mengidap penyakit tuberkulosis baik melalui batuk, bersin, berbicara, atau bernyanyi. Ketika seseorang terinfeksi bakteri TBC, bakteri tersebut dapat menetap di paru-paru dan mulai berkembang biak. Kemudian bermigrasi melalui darah ke bagian tubuh lainnya seperti ginjal, tulang belakang, dan otak. Penyakit TBC di paru-paru atau tenggorokan dapat menular. TBC di bagian tubuh lain, seperti ginjal atau tulang belakang, biasanya tidak menular.[16]
Saat berada di paru-paru, M. tuberculosis difagositosis oleh makrofag alveolar, tetapi mereka tidak dapat membunuh dan mencerna bakteri. Dinding selnya mencegah fusi fagosom dengan lisosom, yang mengandung sejumlah faktor antibakteri.[17] M. tuberculosis memblokir molekul penghubung, autoantigen endosom awal 1 (EEA1). Namun, blokade ini tidak mencegah fusi vesikula yang berisi nutrisi. Akibatnya, bakteri ini dapat berkembang biak tanpa terkendali di dalam makrofag. Bakteri ini juga membawa gen UreC, yang mencegah pengasaman fagosom.[18] Selain itu, produksi diterpen isotuberculosinol mencegah pematangan fagosom.[19] M. tuberculosis juga menghindari pembunuhan makrofag dengan menetralkan zat antara nitrogen reaktif.[20] Baru-baru ini, ditunjukkan bahwa M. tuberculosis mengeluarkan dan menutupi dirinya dalam 1-tuberculosinyladenosine (1-TbAd), nukleosida khsusus yang bertindak sebagai antasida, memungkinkannya untuk menetralkan pH dan menyebabkan pembengkakan di lisosom.[21][22] 1-TbAd dikodekan oleh gen Rv3378c.[22]
Baru-baru ini juga diteliti bahwa pada infeksi M. tuberculosis, kadar PPM1A diregulasi dan pada gilirannya akan berdampak pada respons apoptosis normal makrofag untuk membersihkan patogen, karena PPM1A terlibat dalam jalur apoptosis intrinsik dan ekstrinsik. Oleh karena itu, ketika tingkat PPM1A ditingkatkan, ekspresi itu akan menghambat dua jalur apoptosis. Dengan analisis kinom, jalur pensinyalan JNK/AP-1 ditemukan menjadi efektor downstream di mana PPM1A memiliki peran untuk dimainkan dan jalur apoptosis di makrofag dikendalikan dengan cara ini.[23] Sebagai hasil apoptosis yang ditekan, maka akan menyediakan relung bagi M. tuberkulosis untuk bereplikasi dengan aman. Sehingga bakteri mampu mempertahankan keadaan laten untuk jangka waktu yang lama.[24]
Granuloma pelindung terbentuk karena produksi sitokin dan peningkatan regulasi protein yang terlibat dalam perekrutan. Lesi granulotomatosa penting dalam mengatur respons imun dan meminimalkan kerusakan jaringan. Selain itu, sel T membantu mempertahankan Mycobacterium di dalam granuloma.[25]
Kemampuan untuk membangun mutan M. tuberculosis dan menguji produk gen individu untuk fungsi spesifik telah secara signifikan meningkatkan pemahaman tentang faktor patogenesis dan virulensinya. Banyak protein yang disekresikan dan diekspor diketahui penting dalam patogenesis.[26] Misalnya salah satu faktor virulensi tersebut adalah faktor tali pusat (trehalose dimycolate), yang berfungsi untuk meningkatkan kelangsungan hidup di dalam inangnya. Strain M. tuberculosis yang resisten telah mengembangkan resistensi terhadap lebih dari satu obat TB, karena mutasi pada gennya. Selain itu, obat TB lini pertama yang sudah ada sebelumnya seperti rifampisin dan streptomisin telah menurunkan efisiensi dalam membersihkan M. tuberculosis intraseluler karena tidak mampu secara efektif menembus ceruk makrofag.[27]
JNK memainkan peran kunci dalam mengontrol jalur apoptosis intrinsik dan ekstrinsik. Selain itu, juga ditemukan sebagai substrat dari aktivitas PPM1A,[28] maka fosforilasi JNK akan menyebabkan apoptosis terjadi.[29] Karena kadar PPM1A meningkat selama infeksi M. tuberculosis, dengan menghambat jalur persinyalan PPM1A, ini berpotensi menjadi metode terapeutik untuk membunuh makrofag yang terinfeksi M. tuberculosis dengan memulihkan fungsi apoptosis normalnya dalam pertahanan patogen. Oleh karena itu, dengan menargetkan jalur sumbu persinyalan PPM1A-JNK, dapat menghilangkan makrofag yang terinfeksi M. tuberculosis.[23]
Kemampuan untuk mengembalikan apoptosis makrofag ke yang terinfeksi M. tuberculosis dapat meningkatkan pengobatan kemoterapi tuberkulosis saat ini, karena obat TB dapat memperoleh akses yang lebih baik ke bakteri di ceruk tersebut. Oleh karena itu, mengurangi jangka waktu pengobatan infeksi M. tuberculosis.
Gejala M. tuberculosis antara lain batuk yang berlangsung lebih dari tiga minggu, hemoptisis, nyeri dada saat bernapas atau batuk, penurunan berat badan, kelelahan, demam, keringat malam, menggigil, dan kehilangan nafsu makan. M. tuberculosis juga berpotensi menyebar ke bagian tubuh lain. Hal ini dapat menyebabkan darah dalam urin jika ginjal terpengaruh, dan sakit punggung jika tulang belakang terpengaruh.[30]
Remove ads
Genom
Ringkasan
Perspektif
Genom dari strain H37Rv diterbitkan pada tahun 1998.[31][32] Ukurannya 4 juta pasang basa, dengan 3.959 gen. 40% dari gen ini memiliki fungsi yang dicirikan, dengan kemungkinan fungsi yang didalilkan untuk 44% lainnya. Di dalam genom juga ada enam pseudogen.
Genom mengandung 250 gen yang terlibat dalam metabolisme asam lemak, dengan 39 di antaranya terlibat dalam metabolisme poliketida yang menghasilkan lapisan lilin. Sejumlah besar gen yang dilestarikan menunjukkan pentingnya evolusi lapisan lilin bagi kelangsungan hidup patogen. Lebih lanjut, penelitian eksperimental telah memvalidasi pentingnya metabolisme lipid untuk M. tuberculosis, yang seluruhnya terdiri dari lemak yang diturunkan dari inang seperti lemak dan kolesterol. Bakteri yang diisolasi dari paru-paru tikus yang terinfeksi terbukti menggunakan asam lemak daripada substrat karbohidrat.[33] M. tuberculosis juga dapat tumbuh pada kolesterol lipid sebagai satu-satunya sumber karbon, dan gen yang terlibat dalam jalur penggunaan kolesterol telah divalidasi sebagai hal penting selama berbagai tahap siklus hidup infeksi M. tuberculosis, terutama selama fase kronis pada infeksi ketika nutrisi lain mungkin tidak tersedia.[34] Sekitar 10% dari kapasitas pengkodean diambil oleh keluarga gen PE / PPE yang menyandikan asam, protein kaya glisin. Protein ini memiliki motif N-terminal yang lestari, delesi dapat mengganggu pertumbuhan makrofag dan granuloma.[35] Sembilan sRNA non coding telah dikarakterisasi pada M. tuberculosis,[36] dengan 56 lebih lanjut diprediksi dalam skrining bioinformatika.[37]
Pada tahun 2013 dilakukan studi genom beberapa strain M. tuberculosis sensitif, ultraresistant, dan multiresistant untuk mempelajari mekanisme resistensi antibiotik. Hasil mengungkapkan hubungan baru dan gen resistensi obat yang sebelumnya tidak terkait dan menyarankan beberapa gen dan daerah intergenik yang terkait dengan resistensi obat mungkin terlibat dalam resistansi terhadap lebih dari satu obat. Yang perlu diperhatikan adalah peran daerah intergenik dalam pengembangan resistensi ini, dan sebagian besar gen yang diusulkan dalam penelitian ini bertanggung jawab atas resistensi obat memiliki peran penting dalam perkembangan M. tuberculosis.[38]
Variasi Strain
Genotyping strain berguna dalam penyelidikan wabah tuberkulosis, karena memberikan bukti kepada penyidik untuk mencegah penularan dari orang ke orang. Pertimbangan situasi di mana orang A mengidap tuberkulosis dan yakin dia tertular dari orang B. Jika bakteri yang diisolasi dari setiap orang termasuk jenis yang berbeda, maka penularan dari B ke A secara definitif tidak terbukti. Namun, jika bakterinya adalah strain yang sama, maka ini mendukung (tetapi tidak secara definitif membuktikan) hipotesis bahwa B menginfeksi A.
Sampai awal 2000-an, strain M. tuberculosis diketik dengan pulsed field gel electrophoresis (PFGE).[39] Sekarang telah digantikan oleh variable numbers of tandem repeats (VNTR), yang secara teknis lebih mudah untuk dilakukan dan memungkinkan diskriminasi yang lebih baik antar strain. Metode ini memanfaatkan adanya sekuens DNA berulang dalam genom M. tuberculosis.
Tiga generasi tipe VNTR untuk M. tuberculosis dicatat. Skema pertama, disebut pengulangan tandem tepat, hanya menggunakan lima lokus,[40] tetapi resolusi yang diberikan oleh lima lokus ini tidak sebaik PFGE. Skema kedua, disebut mycobacterial interspersed repetitive unit, memiliki kemampuan membedakan sama bagus dengan PFGE.[41][42] Generasi ketiga (mycobacterial interspersed repetitive unit - 2) menambahkan sembilan lokus lagi sehingga totalnya menjadi 24. Hal ini memberikan derajat resolusi yang lebih besar dari PFGE dan saat ini menjadi standar untuk typing M. tuberculosis.[43] Namun, sehubungan dengan sisa-sisa arkeologi, bukti tambahan mungkin diperlukan karena kemungkinan kontaminasi dari bakteri tanah terkait.[44]
Resistensi antibiotik pada M. tuberculosis biasanya terjadi karena akumulasi mutasi pada gen yang menjadi target antibiotik atau perubahan titrasi obat.[45] M. tuberculosis dianggap multidrug-resistant (MDR TB) jika ia telah mengembangkan resistensi obat terhadap rifampisin dan isoniazid, yang merupakan antibiotik terpenting yang digunakan dalam pengobatan. Selain itu, M. tuberculosis yang resisten terhadap obat secara ekstensif (TB XDR) ditandai dengan resistensi terhadap isoniazid dan rifampisin, ditambah fluoroquinolone dan setidaknya satu dari tiga obat lini kedua yang dapat disuntikkan (yaitu, amikacin, kanamycin, atau capreomycin).[46]
Remove ads
Evolusi
Ringkasan
Perspektif
Kompleks M. tuberculosis berkembang di Afrika dan kemungkinan besar di Tanduk Afrika[47][48] Selain M. tuberculosis, M. tuberculosis kompleks (MTBC) memiliki sejumlah anggota yang menginfeksi berbagai jenis hewan, antara lain M. africanum, M. bovis (Dassie's bacillus), M. caprae, M. microti, M. mungi. , M. orygis, dan M. pinnipedii. Kelompok ini mungkin juga termasuk klade M. canettii. Strain hewan MTBC ini tidak sepenuhnya berhak atas status spesies, karena semuanya berkerabat dekat dan berada dalam filogeni M. tuberculosis, tetapi karena alasan historis, mereka saat ini memegang status spesies.
Klade M. canettii - yang mencakup M. prototuberculosis - adalah kelompok spesies Mycobacterium yang berkoloni halus. Berbeda dengan anggota kelompok M. tuberculosis yang sudah mapan, mereka melakukan rekombinasi dengan spesies lain. Mayoritas strain yang diketahui dari kelompok ini telah diisolasi dari Tanduk Afrika. Nenek moyang M. tuberculosis dimungkinkan adalah M. canettii, pertama kali dijelaskan pada tahun 1969.[49]
Anggota mapan dari M. tuberculosis kompleks semuanya merupakan klonal dalam penyebarannya. Spesies utama yang menginfeksi manusia telah diklasifikasikan menjadi tujuh garis keturunan. Menerjemahkan garis keturunan ini ke dalam terminologi yang digunakan untuk spoligotyping, sebuah metodologi genotipe yang sangat kasar, garis keturunan 1 berisi keturunan Afrika-India Timur (EAI), keluarga strain Manila dan beberapa strain Manu (India); garis keturunan 2 adalah kelompok Beijing; garis keturunan 3 termasuk strain Asia Tengah (CAS); garis keturunan 4 termasuk strain Ghana dan Haarlem (H / T), Amerika Latin-Mediterania (LAM) dan X; tipe 5 dan 6 sesuai dengan M. africanum dan diamati terutama dan pada frekuensi tinggi di Afrika Barat. Jenis ketujuh telah diisolasi dari Tanduk Afrika.[47] Spesies lain dari kompleks ini termasuk dalam sejumlah spoligotipe dan biasanya tidak menginfeksi manusia.
Lineage 2, 3 dan 4 semuanya berbagi peristiwa delesi unik (tbD1) dan dengan demikian membentuk kelompok monofiletik.[50] Tipe 5 dan 6 berkerabat dekat dengan galur hewan MTBC, yang biasanya tidak menginfeksi manusia. Lineage 3 telah dibagi menjadi dua klade: CAS-Kili (ditemukan di Tanzania) dan CAS-Delhi (ditemukan di India dan Arab Saudi). Lineage 4 juga dikenal sebagai garis keturunan Euro-Amerika. Subtipe dalam tipe ini termasuk Mediterania Amerika Latin, Uganda I, Uganda II, Haarlem, X, dan Kongo.[51]
Sebuah penelitian melaporkan bahwa M. tuberculosis telah berevolusi bersama dengan populasi manusia, dan bahwa nenek moyang terbaru dari kompleks M. tuberculosis berevolusi antara 40.000 dan 70.000 tahun yang lalu.[50][52] Namun, penelitian selanjutnya yang memasukkan urutan genom dari anggota kompleks M. tuberculosis yang diekstraksi dari tiga mumi Peru berusia 1.000 tahun, mendapatkan kesimpulan yang sangat berbeda. Jika nenek moyang terbaru dari M. tuberculosis complex berusia 40.000 sampai 70.000 tahun, ini akan memerlukan tingkat evolusi yang jauh lebih rendah daripada perkiraan yang dihasilkan oleh analisis genom dari sampel heterochronous.[53]
Analisis lebih dari 3000 strain M. bovis dari 35 negara menunjukkan asal Afrika untuk spesies ini.[54]
Co-evolusi dengan manusia modern
Saat ini ada dua narasi paralel mengenai usia MTBC dan bagaimana bakteri ini telah menyebar dan berkembang bersama dengan manusia dari waktu ke waktu. Salah satu studi membandingkan filogeni M. tuberculosis dengan filogeni genom mitokondria manusia dan menafsirkannya sebagai sangat mirip. Berdasarkan ini, penelitian menunjukkan bahwa M. tuberculosis, seperti manusia, berevolusi di Afrika dan kemudian menyebar dengan manusia modern secara anatomis dari Afrika ke seluruh dunia. Dengan mengkalibrasi tingkat mutasi M. tuberculosis untuk mencocokkan narasi ini, penelitian menunjukkan bahwa MTBC berevolusi 40.000-70.000 tahun yang lalu.[48] Dengan menerapkan skala waktu ini, penelitian menemukan bahwa ukuran populasi efektif M. tuberculosis meningkat selama Transisi Demografis Neolitik (sekitar 10.000 tahun yang lalu) dan menyarankan bahwa M. tuberculosis mampu beradaptasi dengan perubahan populasi manusia dan bahwa sejarah keberhasilan patogen ini. setidaknya sebagian didorong oleh peningkatan dramatis dalam kepadatan populasi inang manusia. Juga telah dibuktikan bahwa setelah beremigrasi dari satu benua ke benua lain, daerah asal inang manusia dapat memprediksi garis keturunan TB yang mereka bawa,[55][56] yang dapat mencerminkan hubungan yang stabil antara populasi pejamu dan M. tuberculosis tertentu. garis keturunan dan / atau interaksi sosial yang dibentuk oleh sejarah budaya dan geografis bersama.
Mengenai kesesuaian antara filogeni manusia dan M. tuberculosis, sebuah studi yang mengandalkan M. tuberculosis dan sekuens DNA kromosom Y manusia untuk menilai secara formal korelasi di antara mereka, menyimpulkan bahwa mereka tidak kongruen.[57] Juga, sebuah penelitian yang lebih baru yang memasukkan urutan genom dari anggota kompleks M. tuberculosis yang diekstrak dari tiga mumi Peru berumur 1.000 tahun, memperkirakan bahwa nenek moyang terbaru dari kompleks M. tuberculosis hidup hanya 4.000 - 6.000 tahun yang lalu.[58] Laju evolusi M. tuberculosis diperkirakan oleh Bos et al. studi[58] juga didukung oleh studi di Lineage 4 yang mengandalkan urutan aDNA genom dari mumi Hungaria yang berusia lebih dari 200 tahun.[59] Secara total, bukti mendukung perkiraan yang lebih baru tentang usia MTBC nenek moyang paling baru, dan dengan demikian bahwa evolusi global dan penyebaran M. tuberculosis telah terjadi selama 4.000–6.000 tahun terakhir.
Di antara tujuh garis keturunan M. tuberculosis yang diakui, hanya dua yang benar-benar mendunia dalam penyebarannya: Garis keturunan 2 dan 4. Di antara garis keturunan ini, Garis 4 adalah yang paling tersebar dengan baik, dan hampir seluruhnya mendominasi di Amerika. Lineage 4 terbukti telah berkembang di atau di sekitar Eropa, dan telah menyebar secara global dengan orang Eropa mulai sekitar abad ke-13.[60] Studi ini juga menemukan bahwa Lineage 4 tuberculosis menyebar ke Amerika tidak lama setelah penemuan benua Eropa pada tahun 1492, dan menunjukkan bahwa ini merupakan pengenalan pertama TB pada manusia di benua itu (walaupun strain hewan telah ditemukan pada sisa-sisa manusia sebelum Columbus.[58] Demikian pula, Lineage 4 ditemukan telah menyebar dari Eropa ke Afrika selama Age of Discovery, dimulai pada awal abad ke-15.[60]
Telah dikemukakan bahwa mikobakteri leluhur mungkin telah menginfeksi hominid awal di Afrika Timur sejak tiga juta tahun yang lalu.[61] Meskipun MRCA dari M. tuberculosis yang masih ada tampaknya telah ada sekitar 4.000-6.000 tahun yang lalu, ini tidak berarti bahwa TB tidak ada sebelumnya, ini hanya berarti bahwa semua strain M. tuberculosis yang beredar saat ini dapat dilacak. kembali ke leluhur bersama yang hidup pada saat itu.
Remove ads
Referensi
Pranala luar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads