A sclerosis multiplex (röviden: SM, átírással szklerózis multiplex), velőshüvely-szétesés, vagy encephalomyelitis disseminata a központi idegrendszert érintő gyulladásos autoimmun betegség, amelynek során az agy és a gerincvelő idegsejtjeinek védőburka, az úgynevezett velőshüvely vagy más néven mielinhüvely megbomlik.[1] Ez a bomlás befolyásolja az idegrendszer bizonyos részei közötti kommunikációs képességet: a károsodás következtében az idegrost rosszul működik: lassabban vezeti és/vagy blokkolja az ingerületet.[2] Az idegrostok működési problémája a különböző kórtünetek széles skálájának megjelenését okozza, ideértve a fizikai, mentális és esetenként pszichiátriai problémákat is.[1][3] Az SM többféle formában is megmutatkozhat, amikor is az új tünetek elszigetelt rohamok formájában (visszaeső típus) jelentkeznek, vagy folyamatosan fejlődnek ki az idő teltével (progresszív típus).[4] Az egyes rohamok között a tünetek akár teljesen megszűnhetnek, mindazonáltal, különösen a betegség előrehaladottabb stádiumában, gyakori a tartós neurológiai problémák megjelenése.[4]
| Sclerosis multiplex vagy velőshüvely-szétesés | |
 | |
| Demielinizáció sclerosis multiplexben. A Klüver-Barrera mielinfestésen jól észrevehetők a halványan festődő károsodott területek (Eredeti nagyítás 100x-os) | |
| Latinul | Sclerosis multiplex, encephalomyelitis disseminata |
| Angolul | Multiple sclerosis, disseminated sclerosis |
| Osztályozás | |
| BNO-10 | G35 |
| BNO-9 | 340 |
| Főbb tünetek | krónikus neuropátiás fájdalom |
| Adatbázisok | |
| OMIM | 126200 |
| DiseasesDB | 8412 |
| MedlinePlus | 000737 |
| eMedicine | neuro/228 oph/179
emerg/321 pmr/82radio/461 |
| MeSH ID | D009103 |
A Wikimédia Commons tartalmaz Sclerosis multiplex vagy velőshüvely-szétesés témájú médiaállományokat. | |

kék: nagy kockázatú területek
piros: valószínűsíthetően kockázatos területek
sárga: alacsony kockázatú területek

Míg a betegség oka nem teljesen egyértelmű, feltételezett, hogy a hátterében meghúzódó mechanizmus vagy az immunrendszer okozta pusztulás, vagy a mielintermelő sejtek működési zavara.[5] Ennek feltételezett okai között szerepelhetnek genetikai és környezeti tényezők, például fertőzések.[1][6] Az SM diagnózisa rendszerint a meglévő jegyek és tünetek valamint az azokat alátámasztó orvosi vizsgálatok alapján történik.
A sclerosis multiplexnek egyelőre nincs ismert gyógymódja. A kezelés rendszerint a rohamok után az életműködés funkcióinak javítására és az új rohamok megelőzésére irányul.[1] Az SM kezelésére használt gyógyszerek csak mérsékelten hatékonyak, ugyanakkor mellékhatásaik lehetnek, és a beteg gyakran rosszul tolerálja őket. Sokan még a meggyőző bizonyítékok hiánya ellenére is inkább alternatív gyógymódokhoz folyamodnak. A tartós eredményeket nehéz előre megjósolni; jobb eredmények általában nőknél észlelhetők, vagy azoknál, akiknél a betegség fiatalabb korban jelentkezett, vagy a visszaeső típusú betegségben szenvedőknél, illetve azoknál, akik kezdetben ritkábban tapasztaltak rohamokat.[7] A várható élettartam rendszerint 5-10 évvel elmarad azokétól, akiket nem érint a betegség.[1]
2008-ban az egész világon mintegy 2-2,5 millióra volt tehető az érintettek száma. Az előfordulási arány világrészenként és különböző populációk között nagyban változó.[8] A betegség rendszerint a 20. és 50. életév között jelentkezik, előfordulása nőknél kétszerte gyakoribb, mint férfiaknál.[9] A sclerosis multiplex elnevezés azokra a hegekre (azaz szklerotikus gócokra, sebekre – sclerae) utal, amelyek elsősorban az agy és a gerincvelő fehérállományában jelennek meg.[10] Az SM-et először Jean-Martin Charcot írta le 1868-ban.[10] Jelenleg számos új kezelési és diagnosztikai mód áll kidolgozás alatt.
A betegség jegyei és tünetei
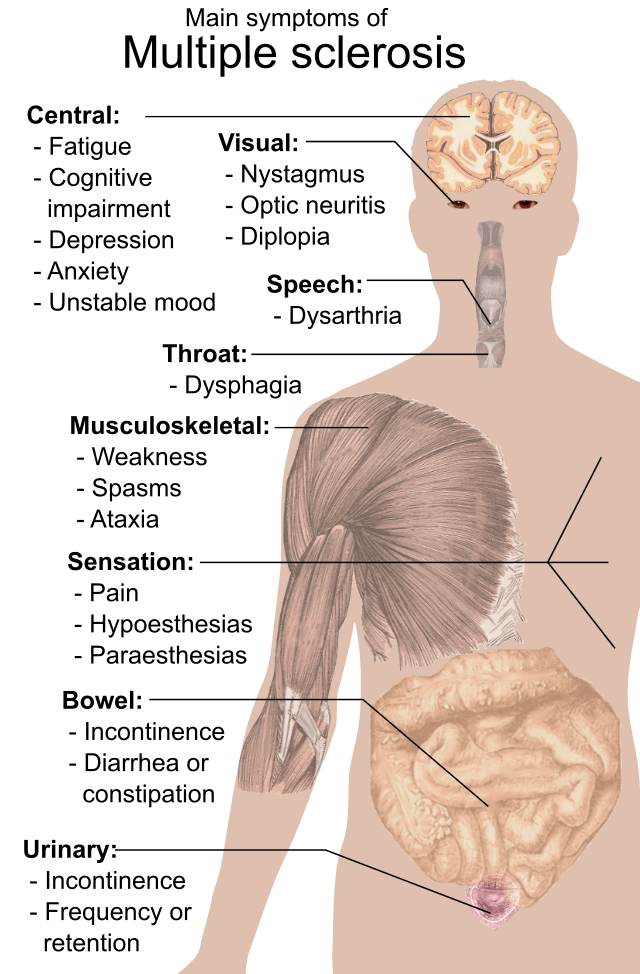
Az SM-ben szenvedő beteg lényegében bármilyen neurológiai tünettel vagy jeggyel rendelkezhet, amelyek között a leggyakoribbak az autonóm, látási, motorikus és érzékelési zavarok.[1] Az egyes tünetek attól függenek, hogy az idegrendszeren belül hol találhatók hegek. A tünetek közé tartozhat többek között a hypoesthesia (csökkent érzékelés) vagy a paresthesia (kóros érzékelés) – úgymint csípő, szúró érzés, zsibbadtság vagy dermedtség érzete, izomgyengeség, rendkívül erős reflexmozgás, izomgörcs, vagy nehézkes mozgás; koordinációs és egyensúlyozási nehézségek (ataxia); beszédzavar vagy nyelési nehézség, látászavarok (szemrezgés, látóideg-gyulladás vagy kettőslátás), fizikai kimerültség, heveny vagy idült fájdalom, valamint húgyhólyag- és bélműködési nehézségek.[1] Nehézkessé válhat a gondolkozás és gyakran felmerülhetnek az olyan érzelmi problémák is mint a depresszió vagy a változékony hangulat.[1] Az Uhthoff-szindróma, amelynek során a szokottnál magasabb hőmérséklet a tünetek súlyosbodását váltja ki, valamint a Lhermitte-tünet, amikor is a nyak előre hajlásakor egyfajta elektromos érzés fut végig a gerincen, ez kiváltképp jellegzetes SM-tünet.[1] A cselekvőképesség elvesztésének és a betegség súlyosságának legfőbb fokmérője a kiterjesztett rokkantsági állapot skála (EDSS) és az olyan további fokmérők mint a sclerosis multiplex funkcionális összetevő teszt amelyet a kutatások során egyre gyakrabban használnak.[11][12][13]
Az esetek 85%-ában a betegség több nap alatt, és klinikailag elszigetelt szindrómaként alakul ki. Ezen belül az érintettek 45%-a motorikus vagy szenzoros problémákat érzékel, 20%-a látóideg-gyulladást, míg 10%-a az agytörzs rendellenes működésével kapcsolatos tüneteket észlel. A fennmaradó 25% a fent említett problémák közül egyidejűleg többet is észlel.[14] Kezdetben a tünetek lefolyása két főbb sémát követ: vagy néhány naptól akár hónapokig tartó, hirtelen súlyosbodási szakaszok jelentkeznek (ezeket visszaesésnek, súlyosbodásnak, lázrohamnak, rohamnak vagy kitörésnek nevezzük), amelyeket az esetek 85%-ában jobbulás követ, vagy az idő előrehaladtával fokozatos súlyosbodás tapasztalható, amelyet nem szakítanak meg a felépülés időszakai. Ez az esetek 10-15%-ára jellemző.[9] E két séma kombinációja szintén előfordulhat,[4] vagy megtörténhet, hogy az SM kezdetben visszaeső-javuló (relapszáló-remittáló) lefolyású, amely később progresszív típusúvá válik.[9] Bár a szakirodalomban elterjedt a jóindulatú (benign) SM kifejezés is, amit azokra használnak, akik hosszabb távon sem érnek el nagyobb rokkantsági fokot, a szakértők megosztottak abban, hogy ez mennyire elterjedt, vagy hogy valóban önálló kategóriaként érdemes-e kezelni.[15] A visszaesések rendszerint nem láthatók előre, és minden előzetes figyelmeztető jel nélkül jelentkeznek.[1] Az állapot súlyosbodása egy éven belül ritkán fordul elő több mint két alkalommal.[1] Mindazonáltal egyes visszaeső tünetek jelentkezését már jól ismert kiváltó okok előzik meg, és ezek a visszaesések gyakrabban fordulnak elő tavasszal és nyáron.[16] Hasonlóképpen növelik a visszaesés kockázatát egyes vírusos fertőzések, például a megfázás, az influenza vagy a gyomor-bélhurut.[1] A stressz szintén rohamot válthat ki.[17] A betegségben szenvedő beteg az őt érő megrázkódtatásra az idegrendszeri tünetek súlyosbodásával, esetleg új tünet jelentkezésével reagálhat. Állapotromláshoz vezethet az erős hideg- vagy melegbehatás, láz, UV-fény, baleset fizikai-lelki hatása, valamilyen vírus- vagy egyéb fertőzés, műtét, amely átmenetileg megbontja a szervezet megszokott egyensúlyát.
Terhesség alatt a visszaesés kockázata csökken, ám a szülést követő első hónapokban ez a kockázat fokozódik.[1] Összességében úgy tűnik, hogy a terhesség hosszú távon nem befolyásolja a betegség következtében kialakuló mozgáskorlátozottság mértékét.[1] Több tényezőről megállapították, hogy nincsenek hatással a relapszusok gyakoriságára – ilyenek többek között a védőoltások,[18] a szoptatás,[1] a fizikai sérülések,[19] és az Uhthoff-szindróma.[16]
Kiváltó okok
Jelenleg nem ismeretes, hogy mi(k) a kóros folyamatot beindító tényező(k),[20] amelytől az immunrendszer saját szervezetének ellenségévé válik, ugyanakkor egyes vélemények szerint bizonyos környezeti tényezők –például fertőző közegek – és genetikai tényezők kombinációja válthatja ki.[1] Az elméletek igyekeznek a rendelkezésre álló adatok összegezésével helytálló magyarázatokra jutni, de mindeddig egyik ilyen törekvés sem bizonyult sikeresnek. Míg számos környezeti kockázati tényező ismeretes, és ezek némelyike részben enyhíthető is, további kutatások szükségesek annak eldöntésére, hogy megszüntetésükkel megelőzhető-e az SM kialakulása.[21][22]
A legfontosabb feltételezett tényezők:
- Genetikai tényezők: HLA-DLα-Val az egyénben.
- Környezeti tényezők: vírusinfekciók (pl. polio vírus, HSV, rubeola)
Földrajzi elhelyezkedés
Az SM gyakrabban fordul elő az Egyenlítőtől távolabbra élők körében, bár vannak kivételek.[1][23] A kivételek között olyan etnikai csoportok is találhatóak, melyek az Egyenlítőtől távol élnek ugyan, de a betegség kockázata náluk mégis alacsony, mint például a számik, az amerindiánok, a kanadai hutteriták, az új zélandi maorik,[24] és a kanadai eszkimók,[9] valamint olyan népcsoportok, amelyek az egyenlítő közelében élnek, de a betegség kockázata náluk mégis viszonylag magas. Ilyenek a szárdok,[9] a palesztinok és a párszik.[24] E földrajzi szórás oka nem egyértelműen tisztázott.[9] Az előfordulások észak-déli irányú gradiense csökkenőben van ugyan,[23] de a 2010-es évben még mindig észlelhető volt.[9]
Az SM előfordulása az észak-európai népesség lakóterületén gyakoribb,[1] és lehetséges, hogy a földrajzi ingadozás mindössze a nagyobb kockázatnak kitett népesség globális eloszlását tükrözi.[9] A kevesebb napfény – amelynek következtében csökken a D-vitamin termelés – egyesek szerint szintén magyarázat lehet e jelenségre.[25][26] Ezt az elképzelést alátámasztani látszik a születési évszak és az SM kialakulása közti lehetséges összefüggés, mivel az északi féltekén novemberben születettek közül kevesebben lesznek érintettek, mint a májusban születettek körében.[27] A gyermekkorban tapasztalt környezeti tényezők szintén közrejátszhatnak, miután több tanulmány is kimutatta, hogy a 15 éves koruk előtt a világ más tájékára költözőkre felnőttkorban az ott jellemző SM kockázat válik mérvadóvá. Amennyiben a költözés a 15. életév után történik, az illetőre rendszerint a régi hazájára jellemző kockázati kitettség marad érvényes.[1][21] Arra is van némi bizonyíték, hogy a költözéssel megváltozott kockázat esetenként a 15 évnél idősebb korukban elköltözöttekre is vonatkozhat.[1]
Genetikai okok

Az SM nem örökletes betegség, mindazonáltal számos genetikai elváltozásról mutatták ki, hogy megnöveli az SM kialakulásának kockázatát.[28] Az érintett személy rokonsági körében nagyobb a betegség kialakulásának valószínűsége, és minél közelebbi rokonsági fokról van szó, annál nagyobb a kockázat.[1] Egypetéjű ikrek esetében mindkét félnél megközelítőleg az esetek 30%-ában kerülhet sor a betegség kialakulására, míg a kétpetéjű ikreknél ez az arány csak 5%. Testvérek esetében 2,5% érintett, míg féltestvéreknél az arány ennél alacsonyabb.[1][29] Amennyiben a betegség mindkét szülőt érinti, gyermekeiknél az átlag népességhez viszonyítva tízszer nagyobb a kockázat.[9] Az SM előfordulása emellett bizonyos etnikai csoportoknál gyakoribb, mint másoknál.[30]
Az SM kialakulásához konkrétan köthető gének közé tartoznak azok, amelyek elváltozást okoznak az humán leukocyta antigén (HLA) rendszerben – ez egy olyan géncsoport, amely a humán 6-os kromoszómában található, és fő hisztokompatibilitási komplex (MHC) antigénként működik.[1] A HLA tartományban végbemenő elváltozások és a betegségre való hajlam közötti összefüggés már több mint harminc éve ismeretes.[31] Ez a tartomány kapcsolatban áll további autoimmun betegségek – például az 1-es típusú diabetes és a szisztémás lupus erythematosus – kialakulásával is.[31] A legkövetkezetesebben kimutatható kapcsolat a szklerózis multiplex és a DR15 és DQ6-ként definiált MHC allélok között található.[1] Más lokuszok (azaz génhelyek), mint például a HLA-C554 és a HLA-DRB1*11 viszont védelmező hatást mutattak.[1] Általában véve elmondható, hogy a betegségre való genetikai hajlam megléte mintegy 20-60%-ban vezethető vissza a HLA elváltozásaira.[31] Bizonyos modern genetikai módszerek (génállomány társítási tanulmányok) segítségével a HLA lokusz kívül még legalább tizenkét további génről is felismerték, hogy csekély mértékben ugyan, de növelhetik az SM kialakulásának valószínűségét.[31]
Kórokozók
Több mikroorganizmusról felvetették, hogy az SM okozója lehet, de még egyik feltevést sem sikerült tudományosan igazolni.[1] Külön érdekes tény, hogy az SM kockázata megváltozik, ha valaki fiatal korában a világ egyik pontjából a másikba költözik.[6] Erre a tendenciára magyarázatul szolgálhat, ha egy elterjedt, s nem egy ritkán előforduló mikroorganizmus okoz egyfajta fertőzést.[6] A feltételezett mechanizmusok között található a higiénia hipotézis és a prevalencia hipotézis. A higiénia hipotézis felvetése szerint a korai gyermekkorban tapasztalt fertőzések védelmet alakítanak ki; a betegség egy ilyen kórokozóra adott válasz egy későbbi életszakaszban.[1] A prevalencia hipotézis szerint a betegség oka egy olyan kórokozó, amely azokban a régiókban elterjedt, ahol az SM gyakoribb, és amely a legtöbb egyénben folyamatos, tünetmentes fertőzést okoz. Csak néhány esetben és több év elteltével okoz demielinizációt, vagyis mielinvesztést.[6][32] A higiénia hipotézisnek több támogatója van, mint a prevalencia hipotézisnek.[6]
Vírusra utaló bizonyítékok lehetnek a következők: oligoklonális sávok jelenléte az agyban és az agy-gerincvelői folyadékban a legtöbb SM-mel élő ember esetében, több vírus asszociálhatósága humán demielinizációs encephalomyelitisszel, és a mielinvesztés előfordulása állatoknál bizonyos vírusfertőzéseket követően.[33] Az emberi herpeszvírusok csoportja az egyik lehetséges víruscsoport. SM kialakulásának kisebb a veszélye azoknál, akik soha nem fertőződtek meg Epstein-Barr vírussal (EBV); míg azok, akik fiatal felnőtt korukban fertőződtek meg EBV vírussal, nagyobb eséllyel betegszenek meg, mint azok, akik fiatalabb korukban fertőződtek.[1][6] Néhányan ezt a higiénia hipotézis ellenérvének tartják, hiszen akik nem fertőződtek meg soha, azok valószínűleg higiénikusabb környezetben nevelkedtek,[6] míg mások úgy vélik, hogy nincs ellentmondás, mert az első találkozás a betegséget okozó vírussal viszonylag későn történik és ez váltja ki a betegséget.[1] Más, kapcsolódó betegségek lehetnek a kanyaró, a mumpsz és a rózsahimlő.[1]
Egyéb okok
A dohányzás bizonyítottan az egyik független kockázati tényező SM kialakulásában.[25] A stressz ugyancsak lehetséges kockázati tényező, bár erre nincs meggyőző bizonyíték.[21] A foglalkozási kitettséget és mérgeket – különösen az oldószereket – is kiértékelték, habár nem vontak le egyértelmű következtetéseket.[21] A védőoltásokat is vizsgálták mint okozati tényezőket; a legtöbb tanulmány nem mutatott összefüggést.[21] Több más lehetséges kockázati tényezőt is átnéztek, mint például az étrend vagy a hormonbevitel, azonban a bizonyíték a betegséghez való viszonyukra „szórványos és nem meggyőző”.[25] Köszvény a várhatónál ritkábban fordul elő, és alacsonyabb húgysav szintet mérnek az SM-betegek körében. Ez a felfedezés ahhoz az elmélethez vezetett, hogy a húgysav védő szerepet tölt be, bár pontos jelentősége még nem tisztázott.[34]
Patofiziológia
A betegség kialakulási mechanizmusa nem teljesen ismert. Alapvetően három fő jellemzője van, nevezetesen a központi idegrendszerben elszórtan kialakuló károsodások (léziók vagy más néven plakkok), melyekben gyulladás van jelen, és ami az idegsejtek nyúlványait borító mielinhüvely károsodásához vezet. Ezek együttesen az idegszövet tartós sérülését okozzák, ami annak elhelyezkedéstől függően tünetekhez vezet. A betegség kialakulásában fontos szerep jut az immunrendszer kóros működésének, a betegséget az autoimmun kórképek közé sorolják.[1]
A kutatók feltételezik, hogy a betegség kialakulása iránti érzékenység öröklött, de ez a betegség környezeti kockázati tényezők hatására alakul ki. Az esetleges fellángolását vírusfertőzés, például megfázás vagy influenza, de forró fürdő vagy például nőknél a terhesség első hat hónapjában bekövetkező változások is előidézhetik.[35] Kialakulásában minden bizonnyal szerepet játszik az ibolyántúli sugárzás hatására a bőrben keletkező D-vitamin és a táplálkozás is.[36]
Patológia

A szklerózis kifejezés az orvosi szóhasználatban hegesedést jelent. A betegséget leíró Jean-Martin Charcot az agyban elszórtan található hegesedések miatt a kórképet sclerosis multiplexnek nevezte el, ami szó szerint „többszörös hegesedést” jelent. A folyamat az agy fehérállományát érinti. A szürkeállományban foglalnak helyet az idegsejtek sejttestei, a különböző agyi struktúrákban található sejteket a fehérállományban futó idegnyúlványok kapcsolják össze egymással, illetve ebben futnak az agyból a periféria felé haladó idegnyúlványok is. Az idegnyúlványok körül található a mielinhüvely, mely egy szigetelő, illetve védő burok, amit a központi idegrendszerben az úgynevezett oligodendroglia sejtek alakítanak ki a nyúlványok körül. Ennek fontos szerepe van abban, hogy a nyúlványokon az elektromos ingerület megfelelően vezetődjön, és az egyik sejtből induló elektromos jel eljusson a következő kapcsoló idegsejthez. Sclerosis multiplexben az oligodendrogliák ellen alakul ki kóros immunreakció, ami a mielinhüvely vékonyodásához, majd eltűnéséhez vezet az idegnyúlványok körül. Ezt a folyamatot demielinizációnak nevezik. Emiatt csökken azok vezetőképessége, illetve hosszú távon maguk a nyúlványok is elpusztulnak, ami maradandó neurológiai károsodásokhoz vezet. A betegség korai szakaszaiban az egyes demielinizációs periódusokat a mielinhüvelyt helyreállító ún. remielinizáció követi, mely részben visszaállítja az adott területen a normális ingerületvezetést, ezáltal megszűnhet vagy csökkenhet az adott tünet.[38] Mivel a regeneráció csak részleges, az idő előrehaladtával, ahogy egyre több demielinizációs epizód éri a központi idegrendszert, egyre több és egyre súlyosabb maradandó funkcióvesztés alakul ki.[35]
Tünetei
A betegség lefolyása nagyon változatos, nemcsak a különböző altípusainak eltérőek a tünetei, hanem szinte minden betegnél másképp jelentkezik. Ezért hívják ezerarcú kórnak, hiszen a szervezetben zajló kóros folyamatok a legváltozatosabb panaszokkal jelentkeznek. Leggyakoribb tünetei:
- homályos és kettős látás
- rosszul érthető, nem jól artikulált beszéd
- nyelészavar
- végtaggyengeség, illetve mozgatási nehézség
- egyensúlyzavar
- ülés, állás vagy járás közben a test felületén érzett zsibbadás
- széklet-, vizelettartási nehézség
- feltűnő fáradékonyság
- részleges vagy teljes vakság
- végtagbénulás
- pszichológiai zavarok: szorongás,[39] depresszió,[40] alvászavar.[41]
- eszméletvesztés
- végtagok (kéz) remegése[1]
Sclerosis multiplex és a látás
A sclerosis multiplexes betegek körében gyakran fordulnak elő látási problémák, sőt, több esetben ezek a betegség első jelei. Gyakorta okozhatja ezt az állapotot a látóideg gyulladása (optic neuritis), amely homályos látással, kettős látással, fejfájással, illetve a látás teljes elvesztésével jár vagy az egyik, vagy pedig gyerekeknél a vírusfertőzést követően mindkét szemen. Nagyon jellegzetes, hogy a szem mozgásakor fájdalom kíséri ezt a homályos látást. A látóideg-gyulladás nem más, mint hogy az idegrost elveszíti a védő mielinhüvelyét, ezáltal az ingerület lassabban halad rajta. A látóideg-gyulladás jelentkezhet a látóidegfőt érintve (papillitis) és a kilépés után az ideget érintve (neuritis retrobulbaris). Látóidegfő-gyulladás (papillitis) esetén jellegzetes szemfenéki kép figyelhető meg: a látóidegfő széle elmosott, színe vörös, mérsékelten duzzadt, előemelkedő. Régóta fennálló gyulladás esetén a látóidegfő színe elhalványodik, sárgás-fehér lesz. A gyulladás csökkenésekor az éles látás helyén „csillagfigura” alakul ki a sárgás, csillogó felrakódásokból.[1]
A látóideg (Nervus opticus [II.]) gyulladásának (opticus neuritis; ON) tünetei általában nem mondhatóak állandónak, első megjelenéskor két hétig erősödnek, majd stabilizálódnak. A későbbiekben, néhány esetben csak pár percig vagy másodpercig tartanak. Jelenleg a látóideg-gyulladás oka számos esetben ismeretlen még az orvosok előtt is. Jelenthet ez minimális látásromlást vagy pedig teljes vakságot is.[1]
Kimutatása
Elsőként nagyon fontos a látás kivizsgálása, majd a színes látás tesztelése. Ezt követően a discus opticus vizualizációja indirekt ophthalmoszkópiával, végül pedig az agy MRI tesztelése. Az esetek 70-80 százalékában a koponya MRI-vizsgálaton többszörös kis fehér elváltozások láthatóak, hasonlón az SM-hez.[1]
A látás rendellenességek formái
A sclerosis multiplex az afferens vizuális pályákra van hatással. Teljes látáskiesés, csökkent vagy homályos látás gyakran csak az egyik szemre van hatással annál az SM-es betegnél, aki látóideg-gyulladást tapasztal. A színek kifakultnak tűnhetnek, és az éjszakai látás különösen nehéz lehet. Fényben érzékenység fordulhat elő a kontrasztoknál, vagy lyukak (vakfoltok) is előfordulhatnak, mindehhez nagyon erős szem- és fejfájás társul.
A látóideg-gyulladás elsősorban 18 és 45 év közötti nőknél diagnosztizálható, átlagéletkornak pedig a 32 éves kor tekinthető. Egyik eltérésként Ceco centralis scotomát tapasztalhatnak, egy rendellenességet, mely vakfolt megjelenését eredményezi a látómező közepén. Ritkán fordul elő egy másik rendellenesség, a homonymous hemianopsia, mely a látás kiesését okozza mindkét szemnél a látómező jobb vagy bal oldalán.
A nystagmust az izomgyengeség és koordináció elvesztése eredményezheti, ez egy állapot, mely a szem gyors rángatózó mozgását okozza. Nystagmus esetén egy tárgy ugráló vagy kiszámíthatatlan mozgásúnak tűnik, amikor a két szem már nem képes koordinálni mozgását egymással. Ez nem olyan gyakori, mint a diplopia, vagy ismertebb nevén, a kettőslátás, ami az egyik szem mozgékonyságának megváltozása. A szem mozgásának ez a zavara a szemgolyó mozgásait meghatározó izmokat vagy az izmokat vezénylő szemmozgató idegeket ért sérülésnek következménye. Fáradtság esetén vibráló kép?[1]
A látási rendellenességek kezelése
Intravénás szteroid kezelést lehet alkalmazni a gyulladás csökkentésére és a gyógyulási folyamat meggyorsítására.
Az egyik szteroidfajta, a kortizon jól alkalmazható a gyulladás enyhítésére. Ennek a gyógyszernek hosszú távú mellékhatása a szürkehályog kialakulásának elősegítése. A látás homályossá válását okozva a szürkehályog általában sebészi úton történő eltávolítását követeli meg.
Bár időnként szemkötést (patni) szoktak alkalmazni a diplopia (kettős látás) kezelésére, elegendő időt hagyva az agy gyakran alkalmazkodik a diplópiához és végül megfelelően fogja feldolgozni a látottakat, de ez az alkalmazkodás lassan történik. Azoknál a betegeknél, akik a fényre érzékenyek, sárga lencsék használata javasolt.
A látásproblémákat érzékelő SM-es betegekre gyakran hat megnyugtatóan az a tény, hogy ezek a tünetek majdnem mindig átmenetiek. Sok más SM-tünethez hasonlóan szem előtt kell tartani, hogy ezeket a tüneteket is rontja a stressz, a kimerültség, a fertőzés, bizonyos gyógyszerek (pl. a triciklikus antidepresszánsok) vagy a hőmérséklet emelkedése, ezért nem ajánlatos a szolárium és a szauna használata.[1]
Pupillareakciók az SM alatt
Többféle kutatást folytattak a pupillareflexet megfigyelve a sclerosis multiplexben (SM) és a látóideg-gyulladásban (optic neuritis, ON) szenvedő betegeknél. Az egyik vizsgálat szerint a megvizsgált betegek közül 14 személynél diagnosztizálták, hogy a pupilla-összehúzódás lassabban történik az átlagosnál. Ezen betegek mindegyikének volt ON betegsége, és a későbbiekben 5 vizsgálati személynél jelentkezett SM. Egy másik kutatás szerint az ON-ban szenvedő betegek sérült szeme lassabban ad reakciókat a fényvillanásokra, ép szemük pupillája viszont sokkal gyorsabban funkcionál, mint egy egészséges ember egészséges szeme. Az akut fázis után javul a látás, de ezt követően még fennmarad a pupillareflex késése.[1]
Diagnosztika

A betegség diagnózisa a neurológiai tüneteken és a különböző képalkotó, illetve laborvizsgálatokon alapul. Az betegség ún. McDonald kritériumait 2001-ben dolgozták ki, és azóta többször módosították.[42] Ebben alapvető jelentőséget kap a tünetek időben és térben való elkülönülése, vagyis annak igazolása, hogy a neurológiai érintettség a központi idegrendszer eltérő részeiben, valamint nem egyidejűleg jelenik meg.[42] Kezdeti diagnosztikai nehézséget jelenthet, ha a beteg rögtön az első demielinizációs epizód során kerül kivizsgálásra, hiszen ekkor még nem teljesül az időbeli elkülönülés kritériuma.
Képalkotók közül az MRI-nek van kitüntetett szerepe.[43] Az agyról és a gerincvelőről készült T2 súlyozott MRI felvételeken elkülöníthetőek a demielinizációs gócok, melyek az agyi fehérállományban látható kerek elváltozások és sokszor az agykamrák körül láthatóak. Gadolínium kontrasztanyag használatával a vizsgálat érzékenysége fokozható, hatékonyabban mutathatóak ki a léziók területén a vér-agy gát sérülései.[44]
A képalkotók mellett ma már kevésbé meghatározó az agy-gerincvelői folyadék vizsgálata, de kétes esetben megerősítheti a diagnózist. A liquor elektroforézis vizsgálatával sclerosis multiplexben különböző IgG izotípusú immunglobulinok mutathatóak ki (oligoklonális gammopátia), melyek helyileg a központi idegrendszerben termelődnek, a vérszérumban rendszerint nem láthatóak.[45] Bár ez az eltérés gyakori SM-ben, nem kizárólag abban fordul elő, így a többi lelettel együttesen értékelhető. Az elektroforézisen látható többlet csíkok mellett a liquorban meg szokták határozni az ún. IgG indexet, mely azt fejezi ki, hogy a termelt ellenanyag valóban a központi idegrendszerben termelődött és nem a vér-agy gáton át jutott a vérből a liquorba. Számításának módja:[46]
- IgG index= [liquor IgG / szérum IgG] / [liquor albumin / szérum albumin]
A betegség diagnosztikájában használhatók még az elektrofiziológiai vizsgálatok is, ezek közül a vizuális kiváltott válasz (angolul visual evoked potential, VEP) emelhető ki.[47][48]
Klinikai lefolyás

A betegség a klinikai lefolyását tekintve több altípussal rendelkezik, melyek elkülönítése prognosztikai és terápiás szempontból egyaránt fontos. 1996-ban az Amerikai Egyesült Államok Nemzeti Sclerosis Multiplex Társasága jellemezte ezeket és négy fő csoportot különített el.[4] Ezt később 2013-ban egy nemzetközi együttműködés keretében átdolgozták, a négy alap kategória mellé bevezették a klinikailag izolált szindróma (CIS) és a radiológiailag izolált szindróma (RIS) fogalmát.[49] A sclerosis multiplex négy fő klinikai altípusa:
- Relapszáló-remittáló
- Másodlagos progresszív (SPMS)
- Elsődleges progresszív (PPMS)
- Progresszív-relapszáló
A relapszáló-remittáló formát a megjósolhatatlan rosszulléteket (relapszusok, „shubok”) követő hosszabb tünetmentes időszakok (remissziók) jellemzik. Ez kezdetben a betegek kb. 80 százalékára jellemző megjelenési forma.[1] A relapszusok során megjelenő neurológiai tünetek a rosszullétet követően vagy teljesen megszűnnek, vagy enyhébb formában tartósan megmaradnak. A relapszusok után kb. 40 százalékban maradnak vissza tartós neurológiai károsodások, mely különösebben a régebb óta fennálló betegség esetén jellemző.[1] A betegség elsőként gyakran ún. klinikailag izolált szindrómaként (CIS) jelentkezik. Ez azt jelenti, hogy a beteg demielinizációra jellemző klinikai tünettannal jelentkezik, azonban a kivizsgálás során nem teljesülnek még a sclerosis multiplex diagnosztikus kritériumai.[50] A CIS esetek kb. 30-70 százalékában alakul ki később definitív SM.[50]
A relapszáló-remittáló esetek kb. 60 százaléka előbb-utóbb átmegy másodlagosan progresszív formába, amikor is a kórkép folyamatos súlyosbodása figyelhető meg a shubok között is.[51] A betegség kezdetétől a másodlagos progresszió megjelenéséig átlagosan 19 év telik el.[51]
A betegek körülbelül 10-20 százalékában a betegség egyből az úgynevezett primer progresszív formaként jelentkezik, a kezdeti tünetek után remisszió nélküli folyamatos súlyosbodás figyelhető meg.[52] A primer progresszív SM többnyire későbbi életkorban jelenik meg, mint a relapszáló-remittáló forma, nagyjából 40 éves korra tehető a kialakulása.
A progresszív-relapszáló a legritkább a négy altípus közül, melyben a kezdeti tünetek megjelenésétől számítva folyamatos súlyosbodás figyelhető meg, akárcsak a primer progresszív SM-ben, de azzal ellentétben erre akut rosszabbodások is rakódnak.[1]
A sclerosis multiplexnek vannak speciális, atípusos formái is, mint a Marburg-féle SM, a Baló-féle koncentrikus sclerosis, vagy a Schilder-féle diffúz sclerosis.[53][54] Régebben ide sorolták a Devic-betegséget (neuromyelitis optica) is, melyről azonban kiderült, hogy az SM-től eltérő patogenezisű demielinizációs kórkép.[55]
Kezelése
A betegség egyelőre nem gyógyítható, csak a lefolyása késleltethető és a tünetek enyhíthetők. A kezelések célja az akut rosszullétek („shubok”) megelőzése, illetve az idegi funkciók megőrzése, a funkcióvesztés megakadályozása vagy lassítása.[1][56]
Akut kezelés
A tünetekkel járó shubok kezelésére átmenetileg nagy dózisú intravénás vagy szájon át adott szteroidot alkalmaznak (pl. metilprednizolon).[57] Noha a szteroidok hatékony gyulladáscsökkentők, és az akut rosszullétek, visszaesések kezelésében eredményesen alkalmazhatók, a betegség hosszútávú lefolyását lényegesen nem befolyásolják, így tartósan rendszerint nem alkalmazzák őket.[58] A szteroidokra nem reagáló esetekben plazmaferezist is végezhetnek.[59]
Hosszútávú kezelés
A relapszáló-remittáló formában több gyógyszert is alkalmaznak hosszútávú kezelésként. Első vonalbeli szereknek az interferonok és a glatiramer-acetát használatosak, melyek nagyjából egyenlő arányban, kb. 30 százalékban csökkentik a relapszusok előfordulását.[60] Másodvonalbeli kezelésként a fingolimod vagy a natalizumab adható.[61] Bár a natalizumab hatékonyabb a rosszullétek megelőzésében, a potenciális mellékhatásai miatt (pl. Progresszív multifokális leukoenkefalopátia, PML) többnyire nem alkalmazzák elsőként, csak súlyos, vagy az első vonalbeli szerekre rezisztens betegség esetén.[62] Harmadik vonalbeli szerként alkalmazzák még a mitoxantront is, azonban felhasználásának gátat szabnak a mellékhatásai.[63] Újabb gyógyszerek is megjelentek a betegség kezelésében, például a teriflunomid,[64] a dimetil-fumarát[65] és az alemtuzumab.[66]
Progresszív SM
Az elsődlegesen progresszív forma nehezen kezelhető, 2011-ig egyedül a mitoxantronról derült ki, hogy csekély mértékben ugyan, de lassíthatja a betegség progresszióját.[63] 2015-ben Pryce és munkatársai, egy tanulmányban beszámoltak arról, hogy a 3 éves, III. klinikai fázisban lévő vizsgálatok során a szájon át adagolt Δ9-THC, a progresszív SM-ben szenvedő betegek számára tervezett vizsgálat eredményeinek elemzése szerint, bár a THC-kezeléssel gyógyulást nem sikerült elérni, de bizonyítottan, (a placebóhoz viszonyítva) jelentős mértékben lelassította a betegség progresszióját.[67]
Alternatív medicina
Felmérések szerint az SM-ben szenvedők több mint fele (körülbelül 50-70 százaléka) vesz igénybe különböző alternatív gyógymódokat.[68] Elsősorban a régebb óta fennálló, súlyosabb neurológiai károsodásokkal rendelkező nőbetegekre jellemző, akik kevésbé elégedettek a konvencionális orvosi kezelésekkel.[68][69] Fontos szempont még az is, hogy szemben a hagyományos orvosi kezeléssekkel, melyek sokszor súlyos mellékhatásokkal járnak, az alternatív módszerek a betegek számára gyakran biztonságosabbnak tűnnek.[70]
A betegek beszámolói szerint a leggyakrabban kipróbált alternatív gyógymódok a különböző relaxációs technikák (pl. jóga), étrend-kiegészítők, a D-vitamin (Coimbra-protokoll), gyógynövények (köztük az orvosi marihuána),[71] a túlnyomásos oxigén terápia[72] a homeopátia[70] és az akupunktúra.[73] A betegség kialakulásakor kifejezetten javasolt a gyulladáscsökkentő omega-3 zsírsavtartalmú élelmiszerek, például a tengeri halak fogyasztása. A magyarországi édesvízi halak kisebb arányban tartalmazzák ezt, de ezek közül kiemelkedik a busa és a kecsege. A leggazdagabb növényi omega-3 forrás a lenmag.[36]
Az alternatív gyógymódok, különösen abban az esetben, ha a beteg hisz bennük, sokat segíthetnek a betegség elviselésében; ugyanakkor ezeknek a módszereknek a hatékonyságáról nem áll rendelkezésre elegendő klinikai bizonyíték.[68]
Új terápiák, és kutatási eredmények
Orvosi kannabisz
2016-ig, összesen 27 országban hagyták jóvá spray formájában, vényköteles gyógyszerként, Sativex néven, mely a marihuánából kivont két hatóanyaggal kémiailag azonos hatóanyagot tartalmaz,[74] mely hatásosnak bizonyult a Sclerosis multiplex esetén a görcsösség, a remegés, az alvászavar, a rendellenes hólyagműködés esetében, valamint egyik összetevője a THC, a progresszió lassításában.
Görcsösség, fájdalomcsillapítás
A marihuána, sclerosis multiplex betegségre gyakorolt hatásának kutatása úgy indult, hogy a marihuánával való hatásos alternatív gyógyászati (ön)kezelések eredményeiől szóló anekdoták mögött rejlő potenciális terápiás hatások ellenőrzése végett 2000-ben Baker és munkatársai a marihuána hatóanyagainak hatásait vizsgálták olyan egereken, melyekben korábban, mesterségesen, sclerosis multiplex betegséget idéztek elő. A kísérletekről a Nature magazinban megjelent cikkben, a remegés és izommerevség enyhüléséről számoltak be.[75] Bár Zajicek és munkatársai már 2003-ban mutattak fel eredményeket a görcsösség és egyéb tünetek esetében,[76] de komolyabb klinikai próba csak 1 évvel később 2004-ben történt, amikor Wade és munkatársai egy kettős vakon értékelt, randomizált, placebo-kontrollált vizsgálat során, melyben 160 páciens vett részt, azt az eredményt kapták, hogy a marihuána hatóanyagait tartalmazó Sativex nevű gyógyszer hatásos a sclerosis multiplex betegség bizonyos tüneteinek kezelésében: jelentős mértékben csökkentette a betegek görcsösségét.[77] Ezt később mások is megerősítették, például Zajicek és munkatársai és 2005-ben,[78] és Novotna és munkatársai 2011-ben,[79] majd Koppel és munkatársai 2014-ben főként a fájdalomcsillapításban, és az izommerevség okozta fájdalmas görcs kezelése esetében.[80] Iskedjian, 2007-ben meta analízissel vizsgálta a kannabisz alapú terápiákat és megállapította, hogy a kannabidiolt és THC-t tartalmazó spray, hatásos a sclerosis multiplex betegség során jelentkező neuropátiás fájdalom terápiás kezelésében.[81]
Alvászavar kezelése
Rog és munkatársai randomizált, kontrollált klinikai próba során igazolta, hogy egy kannabisz hatóanyagú gyógyszer alkalmas a fájdalom és az alvászavar hatásos terápiás kezelésére, a sclerosis multiplex betegség esetén.[82] Majd 2007-ben szintén Rog és munkatársai egy nem kontrollált, 2-év időtartamú klinikai próba során, arra az eredményre jutottak, hogy a THC és a kannabidiol hatásos, a sclerosis multiplex betegséggel összefüggésbe hozható neuropátiás fájdalom enyhítésében, valamint a 2-év során nem találtak bizonyítékot függőség kialakulására.
A betegek enyhének, illetve közepesen súlyosnak ítélték a mellékhatások erősségét, mely főként a szédülés és a hányinger volt.[83] A kedvező eredményeket Serpell és munkatársai is megerősítették, (kontrollált, klinikai próba során). Eredményeik szerint a gyógyszer hosszú távú szedése sem okozott függőséget, viszont akik hosszabb ideig maradtak a kísérletbe azok esetében a kezelés hatására több eredményt tudtak felmutatni.[84]
2016-ban Haupts és munkatársai, egy nagy egyedszámú klinikai próba során vizsgálták a Kannabidiolt-és THC-t is tartalmazó Sativex gyógyszer, esetleges mellékhatásait, a betegek által való elviselhetőségét. Ők e gyógyszert, a vizsgálati eredmények alapján a betegek által jól tolerálhatónak értékelték, valamint megállapították, hogy a sclerosis multiplexben szenvedő betegek görcsösséggel kapcsolatos alvásproblémáin is képes volt javítani.[85]
A progresszió lassítása
2015-ben Pryce és munkatársai egy tanulmányban arról számoltak be, hogy egy három év hosszúságú, III. klinikai fázisban lévő vizsgálat során a szájon át adagolt Δ9-THC, a progresszív SM-ben szenvedő betegek esetében, (a placebóval történő kezelés eredményeihez viszonyítva) jelentős mértékben lelassította a betegség súlyosbodását.[67]
Hólyag diszfunkció
Brady és munkatársai, 2004-ben hatásosnak találták a marihuána kivonatokat a hólyag diszfunkció kezelésében, előrehaladott sclerosis multiplexben szenvedő betegek esetében.[86] Ezt később mások is megerősítették, bár Kavia és munkatársai szerint az ő kísérletük eredménye statisztikailag nem minősült jelentősnek, ennek ellenére úgy találták, hogy a marihuána hatóanyagokat tartalmazó sativex kezelés eredményez némi javulát a hólyag diszfunkció esetében.[87]
Gyulladáscsökkentés
A nem kizárólag tüneti kezelésre összpontosító hatások kutatásával kapcsolatban is történtek előrelépések. 2003-ban Pryce és munkatársai megállapították, hogy a kannabinoidok gátolni tudják a neurodegenerációt a sclerosis multiplex modellben, így felvetették annak lehetőségét, hogy a kannabisz alkalmas lehet a neurodegeneratív folyamatok lassítására.[88] Mecha és munkatársai felhívták a figyelmet a kannabidiol gyulladáscsökkentő hatásának jelentőségére az olyan gyulladással járó kóros állapotok esetében, mint a sclerosis multiplex.[89] Bár a sclerosis multiplex kezelésére alkalmazott gyógyszerek nem tartalmaznak kannabigerolt, Granja és munkatársai a kannabigerol kinon sclerosis multiplexben jelentkező krónikus ideggyulladást enyhítő hatását figyelték meg, mely arra utal, hogy a kannabigerol és más fitokannabinoidok nem csak a tünetekre hatnak közvetlenül, hanem szerepük lehet a tüneteket kiváltó gyulladás csökkentésében is.[90] 2015-ben Giacoppo és munkatársai az önmagában alkalmazott tisztított kannabidiol hatását vizsgálva kimutatták, hogy egerekben gátolja a neuronális apoptózist (programozott sejthalált) az SM-ben szerepet játszó neurodegeneratív folyamatokban.[91]
Epidemiológia
Általában 20-40 életév között a leggyakoribb a megjelenése. A betegség Magyarországon a becslések szerint 6-8000 embert érint, évente 3-500 új esetet diagnosztizálnak.[92] A világon mintegy 2,5 millió SM-beteg van. A nők között magasabb a megbetegedési arány.[93]
Életmódváltás
Sem a betegnek, sem a környezetének nem könnyű együtt élni az SM-mel. Emiatt sokan nem foglalkoznak a még nagyobb „áldozatokkal” járó egészséges életmóddal, pedig ha egy SM beteg próbálja növelni a fizikai aktivitását és odafigyel a kiegyensúlyozott étkezésre, akkor több pozitív változást is tapasztalhat magán:
- állóképesség-javulás
- mozgáskészség maximalizálása
- ízületek hajlékonyságának javulása
- egészségesebb szív
- kevésbé lesz fáradékony
- a depressziós tünetei enyhülhetnek
Mindamellett fontos, hogy a gyógytorna és egyéb fizikoterápia során a teljesítőképességet maximum 80 százalékig vegyék igénybe, illetve a terhelés mennyiségét és minőségét minden esetben igazítsák a beteg aktuális állapotához.[94]
Kórjelzés/prognózis

|
nincs adat
<13
13–16
16–19
19–22
22–25
25–28
|
28–31
31–34
34–37
37–40
40–43
>43 |
A betegség várható lefolyása és a prognózis nagyban függ annak pontos altípusától, de számít a nem, az életkor és a kezdeti tünetek is.[7] A női nem, a relapszáló-remittáló kórforma, a látóidegfő gyulladásával vagy érzészavarral, illetve a fiatalkorban kezdődő betegség, valamint kevés akut rosszullét jelentkezése a diagnózist követő néhány évben – mind kedvezőbb prognózist valószínűsítenek.[7]
A diagnózistól számított várható átlagos túlélés nagyjából 30 év, ez 5-10 évvel elmarad az egészséges egyének várható élettartamától.[1] A halálozások kétharmada közvetlenül a betegség következményeiként lép fel (pl. fertőzések), de az SM betegek körében nagyobb arányú az öngyilkosság is.[1][95] Noha a betegek többsége az életük végére járásképtelenné válik, a diagnózist követően tíz évvel 90 százalékuk, 15 évvel pedig 75 százalékuk képes önállóan járni.[96]
Világnapja
- A sclerosis multiplex világnapja május 30.[97]
Jegyzetek
Források
További információk
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.


