Kinezin
From Wikipedia, the free encyclopedia
A kinezin az eukarióta sejtekben lévő mozgatóproteinekhez tartozó fehérje. A mikrotubulusok szálai mentén mozognak, és az adenozin-trifoszfát hidrolíziséből nyernek energiát (így ATPázok). A kinezinek aktív mozgása számos sejtfunkciót, például a mitózist, a meiózist és a sejt által szállított anyagok transzportját (például az axonális vagy az intraflagelláris transzport) segíti. A legtöbb kinezin a mikrotubulusok +-vége felé halad, ami a legtöbb sejtben a sejt központjából a periféria felé való transzportot jelent.[1] Ez a transzport az anterográd transzport. Ezzel szemben a dineinek a mikrotubulusok mínusz-vége felé haladnak retrográd transzportban.

Felfedezés
Az első felfedezett kinezinek mikrotubulus-alapú anterográd sejtbelitranszport-motorok,[2] melyeket 1985-ben fedeztek fel citoplazmatikus mozgásuk alapján polipok óriásaxonjában.[3]
A szupercsalád első tagja, a kinezin-1 4 részből – 2 azonos mozgatóegységből (kinezin-nehézlánc (KHC)) és 2 egyéb egység (kinezin-könnyűlánc (KLC)) – álló gyors axonális organellumtranszport-motor. Ezeket mikrotubulus-affinitáson alapuló tisztítással fedezték fel neuronkivonatokban.[4] 1993-ban felfedeztek egy heterotrimer MT-alapú motort, a kinezin-2-t, mely két eltérő KHC-alapú és egy „KAP” egységből áll, melyet tüskésbőrűpete/embriókivonatból nyertek ki,[5] és a fehérjekomplexek (intraflagelláris transzport) axonémaközi szállításában fontos a ciliogenezis során.[6] Molekuláris genetikai és genomikai megközelítések alapján a kinezinek külön mozgató szupercsaládot alkotnak, melyek az eukarióta sejtek számos sejtbeli mozgási eseményéhez fontosak.[7][8][9][10] Például az emlősgenomok több mint 40 kinezint kódolnak,[11] melyek legalább 14 családba (kinezin-1-től kinezin-14-ig) tartoznak.[12]
Szerkezet
Teljes szerkezet
A kinezinek alakja eltérő, de a kinezin-1 motorja két KHC-ből áll, melyek két KLC-t kötnek, melyek eltérő anyagokra eltérő szerkezetűek.
A kinezin-1 nehéz lánca N-terminális globuláris fejből (mozgatódomén) áll, melyet rövid, rugalmas nyak köt a törzshöz, mely hosszú α-helikális tekercsdomén, és C-terminális farokban ér véget, mely a könnyű láncokkal kölcsönhat. A két KHC-törzs tekerccsé áll össze, mely a dimerizációjukat irányítja. Gyakran a szállított anyag a könnyű láncokhoz köt a tetratrikopeptid-szakasznál, de egyes anyagok a C-terminális doménekhez kötnek.[13]
Kinezin-motordomén
A fej a kinezin alapja, aminosavsorrendje a kinezinek közt állandósult. Minden fejen két külön kötőhely van: egy a mikrotubulusnak, egy az ATP-nek. Az ATP-kötés és -hidrolízis és az ADP-felszabadítás megváltoztatják a mikrotubulusok kötőhelyeinek konformációját, ez okozza a mozgását. Számos szerkezeti elem, például a központi β-redő- és az I-es és II-es váltódomén mediálhatja a két kötőhely és a nyakdomén kölcsönhatásait. A két család számos közös szerkezeti elemmel rendelkezik, ilyen például az I-es és II-es váltó.


Bázikus kinezinszabályzás
A kinezinek alap-enzimaktivitása gyakran alacsony, és a mikrotubulusok általi aktivációkor nő meg.[15] Továbbá sok kinezin képes öngátlásra a farok- és a mozgatódomén kötésével.[16] Ez további szabályzással, például adaptorok, szállított anyag vagy más mikrotubulus-asszociált fehérjék kötésével szűnhet meg.[17][18][19]
Szállítás
A sejtben a kis molekulák, például a gázok és a glükóz oda diffundálnak, ahol kellenek. A sejttestben szintetizált nagy molekulák és a sejtalkotók, például a vezikulumok és a sejtszervecskék, például a mitokondriumok túl nagyok és a citoszol túl sűrű ahhoz, hogy a célba tudjanak diffundálni. A mozgatófehérjék a nagy szállítmányokat a sejten át szállítják a célállomáshoz. A kinezinek a mikrotubulusok mentén egy irányban mozogva szállítják az ilyen anyagokat, lépésenként 1 ATP-molekulát hidrolizálva.[20] 2000-ben feltételezték, hogy ez az, ami minden lépést lehetővé tesz, és a felszabaduló energia mozdítja előre a fejet.[21] Azonban 2006-ban a fej előre történő diffúziójáról és a mikrotubulushoz való, a szállítmányt mozgató kötőerőről számoltak be.[22] Továbbá vírusok, például a HIV is a kinezineket használja a vírusszállításra összeállása után.[23]
A szállított anyagokat in vivo több motor mozgatja.[24][25][26][27]
Mozgásirány
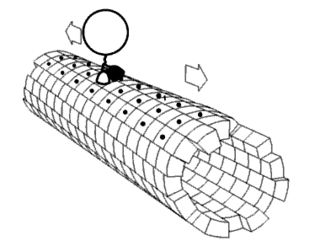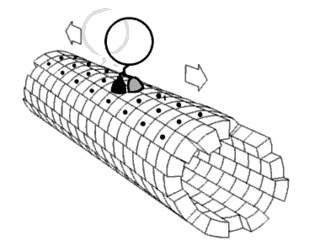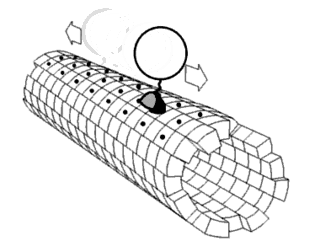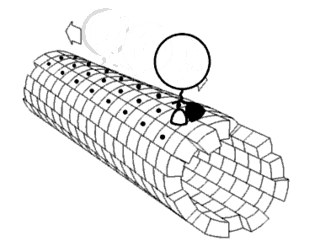
A mozgatófehérjék meghatározott irányban haladnak a mikrotubuluson. A mikrotubulusok polárisak, vagyis a fejek csak egy irányban kötnek a mikrotubulushoz, míg az ATP-kötés minden lépésnek meghatározza az irányát nyakkötő-cipzárazás révén.[28]
2000 óta ismert volt, hogy a kinezinek a mikrotubulusok plusz-vége felé mozgatnak anyagokat (anterográd transzport).[29] Azonban 2011-ben felfedezték, hogy az élesztőcsírasejtekben a kinezin-5-családba tartozó Cin8 kinezin a mínusz-vég felé is tud haladni (retrográd transzport). Ez azt jelenti, hogy ezen egyedi élesztőkinezinek képesek két irányba mozogni.[30][31][32] A kinezinről 2011-ig csak csoportban való retrográd mozgás ismert, ahol az antiparallel motorok megkísérelnek elválasztani mikrotubulusokat.[33] E kétirányúságot megfigyelték azonos körülmények közt, ahol a szabad Cin8 a mínusz-, a keresztkötött a plusz-vég felé mozog keresztkötött mikrotubulusokon. Egy ezek sebességét mérő tanulmány szerint sebességük 25–55 nm/s az orsópólusok irányába.[34] Különböző ionos körülmények közt vizsgálva kiderült, hogy a Cin8 sebessége akár 380 nm/s is lehet.[34] Feltehetően az élesztőkinezin-5-mozgatók, például a Cin8 és a Cut7 más Cin8-mozgatókkal való kapcsolódás eredménye, és segít a dinein szerepének betöltésében élesztők esetén, szemben a humán homológgal, a plusz-irányú Eg5-tel.[35] E felfedezés a kinezin-14-család fehérjéiben (például a Drosophila melanogaster NCD, az élesztő KAR3 és az Arabidopsis thaliana ATK5 fehérjéjében) lehetővé teszi az ellentétes irányú mozgást.[36] This is not typical of kinesin, rather, an exception to the normal direction of movement.

Egy másik mozgatófehérje-típus, a dineineké a mikrotubulus mínusz-vége felé mozog, tehát a sejt központjába (retrográd transzport). Ez például axon terminális részéből a szómába történő szállítást jelent.
Mozgásmechanizmus
2023-ban a kinezin mozgásának valós idejű felvételét készítették el mikrotubuluson.[37] „Kéz kéz felett” mechanizmusban a kinezinfejek egymás felett haladnak, így a vezető- és követőfejek szerepe cserélődik.
- A ciklus a vezetőfej szervetlenfoszfát-kibocsátásával (Pi) kezdődik.
- A követőfej leválik a mikrotubulusról, és a jobbra tolt kötetlen állapotba fordul.
- A vezetőfej ATP-t köt, így a nyak hozzáköt, a követőfejet a vezető körül távolabbra mozdítva. A követőfej kötetlen marad.
- A vezetőfej ATP-je hidrolizálódik.
- A követőfej ATP-t bocsát ki, és a mikrotubulushoz köt, vezetővé válva.[38][39][40][41][42][43]
Elméleti modellek
Számos elméleti modell van a molekuláris mozgatófehérjére.[44][45][46] Sok kérdés maradt az elméleti vizsgálatok után – nem ismert a fehérjeszerkezetek, a hőmérséklet-változások szerepe és az energiaátalakítás módja. Így jobb, a molekulaszerkezetet és a kísérleti eredményeket jobban összekapcsoló megközelítések kellenek.
Az egymolekulás dinamika már jól ismert,[47] de e molekulák nagy csapatokban dolgoznak.
Az egymolekulás dinamika a különböző kémiai állapotokon és a mechanikai lépésekről szóló megfigyeléseken alapul.[48] Kis ADP-koncentráció esetén viselkedését a két kemomechanikai ciklus versengése határozza meg, melyek a fékezőerőt határozzák meg. Egy harmadik ciklus válik fontossá nagy ADP-szint mellett.[48] Egyciklusú modellek is ismertek. Seiferth et al. bemutatták, hogy változnak a sebességhez és entrópiatermeléshez hasonló mennyiségek, ha szomszédos állapotok egyesülnek többciklusú modellben, amíg a ciklusszám csökken.[49]
2001-ben kimutatták, hogy a mikrotubulusokon mozgó kinezinek egymással kölcsönhatnak,[50][51] ezek rövid távúak és gyengék (1,6±0,5 KBT). Egy modell figyelembe veszi e kölcsönhatásokat,[47] ahol a dinamikus sebességek a kölcsönhatási energia szerint változnak. on. Pozitív energia esetén a kötéskeletkezési sebesség (q) nő, a kötésbomlási (r) csökken. A be- és kilépési sebességeket is változtatja az energia. A második hely betöltésekor a bemeneti sebesség αq, az utolsó előttiékor a kilépési sebesség βr. Ez az elméleti megközelítés lehetővé teszi a Monte Carlo-szimulációk eredményeinek vizsgálatát, különösen nagyon nagy negatív energia esetén. A normális teljesen aszimmetrikus egyszeri kiviteles folyamat (TASEP) eredményei e modellből számíthatók 0 energia esetén:
Mitózis
2005-ben kimutatták, hogy a mikrotubulus-alapú molekulamotorok (beleértve számos kinezint) fontosak a mitózisban. A kinezinek a megfelelő orsóhosszhoz, prometafázis és metafázis során a mikrotubulus-elválasztáshoz, anafázis során a mikrotubulusok mínusz-végeinek depolimerizációjához kellenek. A kinezin-5 az orsóban elválasztja, a kinezin-13 depolimerizálja a mikrotubulusokat.[52]
Kinezin-szupercsalád
A humán kinezinek a következő fehérjék, melyek a szabványos nevezéktan szerint 14 családban (kinezin-1–kinezin-14) vannak:[12]
- 1A – KIF1A, 1B – KIF1B, 1C – KIF1C: kinezin-3
- 2A – KIF2A, 2C – KIF2C = kinezin-13
- 3B – KIF3B vagy 3C – KIF3C, 3A - KIF3A: kinezin-2
- 4A – KIF4A, 4B – KIF4B: kinezin-4
- 5A – KIF5A, 5B – KIF5B, 5C – KIF5C: kinezin-1
- 6 – KIF6: kinezin-9
- 7 – KIF7: kinezin-4
- 9 – KIF9: kinezin-9
- 11 – KIF11: kinezin-5
- 12 – KIF12: kinezin-12
- 13A – KIF13A, 13B – KIF13B: kinezin-3
- 14 – KIF14: kinezin-3
- 15 – KIF15: kinezin-12
- 16B – KIF16B: kinezin-3
- 17 – KIF17: kinezin-2
- 18A – KIF18A, 18B – KIF18B: kinezin-8
- 19 – KIF19: kinezin-8
- 20A – KIF20A, 20B – KIF20B: kinezin-6
- 21A – KIF21A, 21B – KIF21B: kinezin-4
- 22 – KIF22: kinezin-10
- 23 – KIF23: kinezin-6
- 24 – KIF24: kinezin-13
- 25 – KIF25: kinezin-14
- 26A – KIF26A, 26B – KIF26B: kinezin-11
- 27 – KIF27: kinezin-4
- C1 – KIFC1, C2 – KIFC2, C3 – KIFC3: kinezin-14
Kinezin-1-könnyűláncok:
- 1 – KLC1, 2 – KLC2, 3 – KLC3, 4 – KLC4
Kinezin-2-asszociált protein:
- KIFAP3 (más néven KAP-1, KAP3)
Jegyzetek
Fordítás
További információk
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

