Vajsav
From Wikipedia, the free encyclopedia
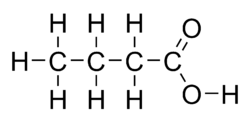
A vajsav vagy butánsav egy szerves vegyület, egy telített monokarbonsav. Színtelen, kellemetlen szagú, maró folyadék. Vízzel korlátlanul elegyedik, de vizes oldatából kisózható. Ez azt jelenti, hogy ha vizes vajsavoldathoz vízben jól oldódó sókat adnak, a vajsav cseppekként kiválik. Van egy szerkezeti izomerje, ez az izovajsav. A sóit és az észtereit butirátoknak (vagy butanoátoknak) nevezik. A természetben megtalálható a vajban és az izzadságban.
| Vajsav | |||
 Szerkezeti képlet | |||
 | |||
 | |||
| IUPAC-név | Butánsav | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 107-92-6 | ||
| PubChem | 264 | ||
| ChemSpider | 259 | ||
| EINECS-szám | 203-532-3 | ||
| DrugBank | DB03568 | ||
| KEGG | C00246 | ||
| MeSH | Butyric+acid | ||
| ChEBI | 30772 | ||
| RTECS szám | ES5425000 | ||
| SMILES | CCCC(=O)O | ||
| InChIKey | FERIUCNNQQJTOY-UHFFFAOYSA-N | ||
| Beilstein | 906770 | ||
| Gmelin | 26242 | ||
| UNII | 40UIR9Q29H | ||
| UN-szám | 2820 | ||
| ChEMBL | CHEMBL14227 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C4H8O2 | ||
| Moláris tömeg | 88,1051 g/mol | ||
| Megjelenés | Színtelen, kellemetlen szagú folyadék | ||
| Sűrűség | 0,96 g/cm³, 20 °C[1] | ||
| Olvadáspont | -5 °C[1] | ||
| Forráspont | 163 °C[1] | ||
| Oldhatóság (vízben) | korlátlanul elegyedik[1] | ||
| Savasság (pKa) | 4,83[2] | ||
| Veszélyek | |||
| Főbb veszélyek | Maró (C)[3] | ||
| R mondatok | R34[3] | ||
| S mondatok | (S1/2), S26, S36, S45[3] | ||
| Lobbanáspont | 72 °C[1] | ||
| LD50 | 2000 mg/kg (patkány, szájon át)[1] | ||
| Rokon vegyületek | |||
| Rokon karbonsavak | Propionsav, Valeriánsav | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Kémiai tulajdonságai
- Meggyújtva kékes színű lánggal elég,
- negatív standardpotenciálú fémekkel hidrogént fejleszt,
- bázisokkal sót,
- alkoholokkal pedig észtert képez (egyensúlyi reakció).
Előfordulása a természetben
Vajsav baktériumok. Ezzel a névvel számos spóraképző, anaerob baktériumfajt jelölnek (Clostridium butyricum, C. acetobutylicum, C. pasteurianum, C. beijerinckii stb.), amelyek cukorból, gyakran keményítőből is vajsavat, butil-alkoholt képeznek, miközben ecetsav, szén-dioxid és hidrogéngáz keletkezik.[4] A természetben megtalálható. Előfordul például a vajban, az izovajsavval együtt, glicerinnel alkotott észtere alakjában. A vajban körülbelül 3-4%-nyi mennyiségben található. A vaj avasodásakor a kellemetlen szagot a vajsav szabaddá válása okozza. Előfordul az izzadságban és a húsban is. A Ginkgo biloba termése erjedésekor vajsav szabadul fel, ezért közparkokban csak a hím növényeket ültetik.
Az úgynevezett vajsavas erjedéskor is vajsav keletkezik. Egyes baktériumok képesek vajsavas erjesztésre, ezek a vajsavbaktériumok, ilyen például a Clostridium butyricum. Ez semleges közegben a cukrokat úgy bontja le, hogy főként vajsav és ecetsav keletkezik.
Előállítása
Keményítőből, cukrokból, glicerinből állítható elő vajsavas erjesztéssel. Szintetikusan n-butanol vagy butiraldehid oxidációjával nyerhető.
Felhasználása
A vajsavat vajsavészterek előállítására használják fel. Ezek kellemes illatú vegyületek, emiatt az illatszeripar használja fel őket. A kisebb szénatomszámú vajsavésztereket oldószerként is alkalmazzák.[1] Felhasználják gyógyszerek és kártevőirtó szerek előállítására is.[1]
Jegyzetek
Források
További információk
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
