From Wikipedia, the free encyclopedia
Az akut mieloid leukémia (AML: acut myeloid leukaemia) vagy más néven akut mielogén leukémia a vérképzőrendszerből kiinduló daganatos betegség, melyre az abnormális mieloid előalakok akut felszaporodása jellemző a vérben és a csontvelőben. Az AML a leggyakoribb felnőttkori akut leukémia, incidenciája a korral növekszik, de gyerekekben is előfordul. Viszonylag ritka betegség, ennek ellenére egy 2002-es amerikai becslés szerint az USA-ban előforduló összes daganatos halálozás 1,2%-áért felelős.[1] Nem egységes kórkép, számos megjelenésében és agresszivitásában jelentősen eltérő betegséget foglal magában. Az akut voltukból adódóan gyorsan súlyosbodnak, kezelés nélkül rövid időn belül a beteg halálát okozhatják.
| Akut mieloid leukémia | |
 | |
| Csontvelőből aspirált AML-es sejtek. A nyilak Auer-pálcákra mutatnak. | |
| 'Szinonimák | Akut mielogén leukémia (AML) |
| Latinul | Leukaemia myeloidea acuta |
| Angolul | Acute myeloid leukemia |
| Osztályozás | |
| BNO-10 | C92.0 |
| BNO-9 | 205.0 |
| ICDO | M9861/3 |
| ' | ... |
| Leírás | |
| Érintett szervek | csontvelő, vér |
| Etiológia | genetikai betegségek, kémiai anyagok, ionizáló sugárzás |
| Főbb tünetek | fáradékonyság, gyengeség, vérzékenység, visszatérő fertőzések |
| Diagnosztika | vérkép, csontvelő szövettan, áramlási citometria, genetikai vizsgálatok |
| Kezelés | kemoterápia, célzott molekuláris terápiák, csontvelő átültetés |
| Adatbázisok | |
| OMIM | 602439 |
| DiseasesDB | 203 |
| MedlinePlus | 000532 |
| eMedicine | med/34 |
| MeSH ID | D015470 |
A Wikimédia Commons tartalmaz Akut mieloid leukémia témájú médiaállományokat. | |
Fő tünetek a visszatérő fertőzések, vérzékenység, étvágytalanság, fáradékonyság. Diagnosztikája és terápiája erre felkészült hematológiai osztályokon történik. Utóbbira főleg kemoterápiás készítményeket, sugárkezelést és csontvelő átültetést alkalmaznak. A várható 5 éves túlélés széles határok között változik, nagyban függ a betegség pontos altípusától.
Az akut mieloid leukémiák a többi daganatos betegséghez képest viszonylag ritkák, azonban a daganattal összefüggő halálozások nem csekély részéért felelősek.[2] Életkor szerinti eloszlását figyelembe véve két fő korcsoportban fordul elő, az egyik csúcs a kora gyermekkorra esik, a másik pedig az időskorra.[3]
Az incidenciáját férfiakban 4,5/100.000; nőkben 3,1/100.000 főnek találták az Egyesült Államokban,[4] ez az életkorral növekszik, az átlagos életkor 67 év.[4]
Gyermekkorban a leukémiák a leggyakrabban előforduló daganatok közé tartoznak, ezen belül az AML kb. 15-20%-ot tesz ki.[5] (A leggyakoribb leukémia gyermekkorban az ALL.)
Az AML valójában gyűjtőfogalom, a fehérvérűség azon heveny típusai tartoznak bele, melyek a vérképzés mieloid vonalából indultak ki. A különálló betegségek csoportosítására két besorolást használnak kiterjedten. Az egyik a FAB (French-American-British), a másik pedig a később kialakított WHO klasszifikáció. Előbbi elsősorban a tumorsejtek morfológiája alapján osztályozza a betegségeket, míg a WHO besorolása inkább a várható prognózist tartja szem előtt.
| Az 1976-os FAB (French-American-British) klasszifikáció:[6] | |||
|---|---|---|---|
| Típus | Teljes név | Genetikai eltérések | Gyakoriság |
| AML-M0 | Minimálisan differenciált akut mieloblasztos leukémia | 5%[7] | |
| AML-M1 | Akut mieloblasztos leukémia, granulocita érés nélkül | 15%[7] | |
| AML-M2 | Akut mieloblasztos leukémia, granulocita éréssel | t(8;21)(q22;q22), t(6;9) | 25%[7] |
| AML-M3 | Akut promielocitás leukémia (APL) | t(15;17)(q22;q12) | 10%[7] |
| AML-M4 | Akut mielomonocitás leukémia | inv(16)(p13q22), del(16q) | 20%[7] |
| AML-M4eo | Akut mielomonocitás leukémia csontvelői eozinofíliával | inv(16), t(16;16) | 5%[7] |
| AML-M5 | M5a: Akut monoblasztos leukémia, M5b: Akut monocitás leukémia | del (11q), t(9;11), t(11;19) | 10%[7] |
| AML-M6 | Akut eritroid leukémia (M6a: eritroleukémia, M6b: tisztán eritroid) | 5%[7] | |
| AML-M7 | Akut megakarioblasztos leukémia | t(1;22) | 5%[7] |
A ritkán előforduló akut bazofil leukémia (ABL) nem szerepel az 1976-os FAB besorolásban, azonban 1999-ben javasolták a felvételét a listába, AML-M8 néven.[8]
| Az akut mieloid leukémiák WHO osztályozása:[9][10] | ||
|---|---|---|
| Név | Leírás | BNO |
| AML visszatérő genetikai abnormalitásokkal | Ebbe a csoportba az alábbi 4 tartozik:
|
Eltérő BNO kódokkal rendelkeznek |
| AML több sejtvonalat érintő diszpláziával |
|
M9895/3 |
| Terápiát követő AML és MDS | Előzetes kemoterápia (alkiláló szerek, topoizomeráz II gátlók), illetve sugárkezelés következtében kialakult AML, rendszerint terápia rezisztens, rossz prognózisú | M9920/3 |
| AML-NOS (másképp nem osztályozható) | Ide tartozik:
|
M9861/3 |
Az akut mieloid leukémiák hátterében számos kiváltó tényező ismeretes, például egyéb hematológiai betegségek, az ionizáló sugárzás, bizonyos kémiai anyagok, valamint genetikai hajlam is szerepet játszhat a kialakulásukban.
A mielodiszpláziás szindrómák (MDS) és a krónikus mieloproliferatív betegségek (CMPN vagy CMPD) egyaránt átmehetnek akut mieloid leukémiába. Ennek valószínűsége nagyban függ attól, hogy a beteg milyen MDS-ben vagy CMPD-ben szenved.[11] Például amíg az excesszív blasztszaporulattal járó refrakter anémia II-es típusában (RAEB-II) kb. 33%-ban alakul ki AML, addig a gyűrűszideroblasztos refrakter anémiában (RARS) ez az arány csak 1-2%.[12]
Azt, hogy meddig tekintenek egy kórképet MDS-nek és mikortól számít akut mieloid leukémiának, a vérben vagy a csontvelőben előforduló éretlen mieloid előalakok, az ún. mieloblasztok aránya határozza meg. Az AML diagnózisának jelenlegi WHO kritériuma az, hogy legalább 20%-nyi mieloblasztnak kell lennie.[13]

Számos kémiai ágens, különösen a kemoterápiában használt alkiláló szerek növelik az AML kialakulásának valószínűségét. Ennek magyarázata az, hogy ezek a szerek DNS-károsodásokat okoznak a sejtekben (a daganatellenes hatásukat is így fejtik ki), aminek következtében nagyobb arányban jöhetnek létre olyan DNS hibák, melyek később maguk is daganat kialakulását eredményezik. Az előzetes terápiát követően kialakuló AML (akár kemoterápia, akár sugárkezelés váltotta ki) nagy fokban rezisztens a kezelésekre. Gyakoriak a jellegzetes genetikai eltérések, különösen az 5-ös és a 7-es kromoszómákat érintő abnormalitások (pl. az 5q deléció).[14] Mivel egyre több daganatos beteget sikerül kemoterápiával meggyógyítani, a kezelések késői szövődményeként kialakuló másodlagos AML incidenciája növekvő tendenciát mutat.[15]
A benzolnak és a poliaromás szénhidrogéneknek ismert a daganatkeltő hatása, és ezt az AML vonatkozásában is számos tanulmány alátámasztotta.[16][17]
Az ionizáló sugárzások hatására ugyancsak gyakrabban alakul ki AML. Ez manapság leginkább az orvosi tevékenységgel függ össze (daganatos betegek terápiás besugárzása, diagnosztikus vizsgálatok közül pedig például a röntgenvizsgálat, vagy a CT), de jól ismert az is, hogy a Hirosima és Nagaszaki városokat ért atomtámadás után a túlélők között jelentősen gyakrabban fordult elő AML.[18]
Egyes veleszületett genetikai betegségekben nagyobb arányban fordul elő AML, ezek közül a legismertebb a Down-kór[19] és a Fanconi-anémia.[20] Születtek beszámolók olyan családokról is, ahol az AML halmozottabban fordult elő,[21] egy tanulmányban pedig azt találták, hogy az AML-es betegek elsőfokú rokonainak háromszoros kockázatuk van a betegség kialakulására az átlagnépességhez képest.[22]
A dohányzásról rég óta ismert, hogy fokozza a leukémiák, köztük az AML kialakulásának a kockázatát.[23][24] A dohányzás nem csak a betegség kialakulásának a valószínűségét növeli, hanem negatívan befolyásolja a terápiák eredményességét is.[25]
A terhesség alatti jelentős alkoholfogyasztás növeli a születendő gyermek kockázatát AML-re.[26]
Az akut mieloid leukémiák lényege, hogy a vérképzés valamelyik mieloid előalakjában olyan genetikai hibák jönnek létre, amelyek meggátolják a sejtek további kiérését (differenciációját), és az adott előalak daganatos felszaporodásához vezetnek. A mieloid vonal sejtjeinek kiérése bonyolult, több lépcsős folyamat, melyet más-más gének szabályoznak.[27] Ez a magyarázata annak, hogy az AML egy sokszínű, heterogén betegségcsoport.
Az akut mieloid leukémiák jelentős részében olyan kromoszóma transzlokációkat lehet kimutatni, amelyek eredményeképpen a sejtekben kóros fúziós fehérjék jönnek létre. Ezek az esetek többségében olyan fehérjéket érintenek, amik a sejtosztódást vagy a további differenciációt szabályozzák. Az egyik leggyakrabban előforduló ilyen transzlokáció a 8-as kromoszómán kódolódó ETO vagy más néven RUNX1T1, és a 21-es kromoszómán található AML1 vagy RUNX1 géneket érintő átrendeződés. A RUNX1 gén egy CBF-nek (angolul:Core-binding factor) nevezett transzkripciós faktor alfa-2 alegységét (CBFα2) kódolja, míg a RUNX1T1 egy CBFA2T1-nek nevezett transzkripciós faktort kódol. A transzlokáció során e két gén fuzionál, fehérjetermékük pedig meggátolja a CBF-en keresztüli génátírást, ami számos tumor szupresszor gént érint.[28][29]
Szintén a CBF-et érinti a 16-os kromoszóma hosszú karján elhelyezkedő CBFβ (CBF béta alegysége) és a 16-os kromoszóma rövid karján található MYH11 (simaizom miozin nehézlánc 11) gének inverziója.[30]
Az akut promielocitás leukémiára (AML-M3) jellemző t(15;17)(q22;q12) (PML/RARA) transzlokáció eredményeképpen a 15-ös kromoszómán elhelyezkedő PML (promielocitás leukémia gén) és a 17-es kromoszómán található RARA (retinsav receptor alfa) egymás mellé kerül. Termékük ebben az esetben is egy fúziós fehérje, mely számos gén átírását meggátolja, ezáltal akadályozva a promielociták további kiérését granulocitákká. Csupa-transz-retinsav (angolul:all trans retinoic acid, ATRA, tretinoin) kezeléssel ezek a kóros sejtek rávehetők a további differenciálódásra, amit az akut promielocitás leukémia kezelésében ki is használnak, ezáltal ez az AML egyik leghatékonyabban kezelhető altípusa.[31]
2008-ban megszekvenálták egy AML-es beteg tumorsejtjeit, ezzel az AML volt az első olyan daganatos betegség, mely esetében rákos sejtek teljes genomja ismertté vált.[32] A vizsgálat egyúttal több olyan génhibát is leírt, amit korábban nem társítottak AML-lel.

Mint a fehérvérűségeknél általában, a legtöbb tünetet az AML esetében is a normális vérsejtek kiszorítása okozza a tumoros sejtek által. Noha a fehérvérsejtszám emelkedett, a felszaporodó kóros előalakok az immunvédekezésben nem vesznek részt, így gyakoriak a fertőzések. A vörösvérsejt szám csökken, vérszegénység alakul ki, ami fáradékonyságban, terhelésre könnyen jelentkező fulladásban nyilvánul meg. A vérlemezkék száma is kevesebb, ami vérzékenységhez vezet. Utóbbira a kisebb sérülésekre jelentkező véraláfutások, vérömlenyek, vagy újonnan jelentkező rendszeres orr- és fogínyvérzések hívhatják fel a figyelmet.
Az AML gyakran nem specifikus, általános tünetekkel kezdődik. Jellemző az étvágycsökkenés, fogyás, fáradékonyság, láz, a visszatérő fertőzések, továbbá a bőrön zúzódások, illetve kis, pontszerű vérzések (petechia) is lehetnek. Gyakoriak a csont- és izűleti fájdalmak is.
Az akut promielocitás leukémia (AML-M3) gyakran jár súlyos véralvadási zavarokkal (pl. Disszeminált intravaszkuláris koagulációval), ami sürgősségi ellátást tehet szükségessé.[33]
A leukémiás sejtek szolid tumorokat (kloróma, vagy mieloid szakróma) képezhetnek a csontvelőn kívül, leggyakrabban a bőrben, vagy a fogínyben, annak duzzanatát okozva. AML-ben az ALL-el ellentétben nem jellemző a nyirokcsomók jelentős duzzanata.
A klinikai tünetek mellett az első vizsgálat a perifériás vérkép elemzése, ahol jelentős fehérvérsejt szaporulat (leukocitózis) mutatható ki, esetenként éretlen blasztokkal. Gyakori eltérés a csökkent vörösvérsejt- és vérlemezkeszám is. AML-ben nem szükségszerű a magas fehérvérsejtszám, sőt, előfordulhat leukopénia is. Ezek az eltérések a vérképben felvetik az AML lehetőségét, melyet ezt követően csontvelő aspiráció és biopszia követ. Ezek patológiai vizsgálata szolgáltatja a végleges és részletes diagnózist.
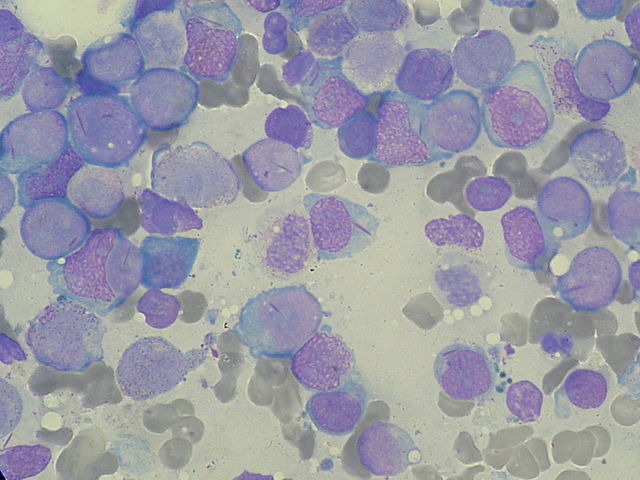
Minden betegből, akinél felmerül az AML lehetősége, csontvelő aspirációt végeznek. A vér- és a csontvelőkeneteket rendszerint May-Grümwald-Giemsa, vagy Wright-Giemsa festést követően fénymikroszkóp alatt vizsgálják.[34] AML diagnózisának WHO szerinti feltétele, hogy a sejtek legalább 20%-a éretlen blaszt (mieloblaszt, monoblaszt vagy megakarioblaszt) legyen. (Az 1976-os FAB ajánlásában ez 30%.[6]) Az egyszerű fénymikroszkópos vizsgálat is adhat információt a daganatsejtek eredetére vonatkozóan, ennek pontosítására azonban különböző citokémiai vizsgálatok is végezhetők, pl. mieloperoxidáz (MPO) vagy nem-specifikus észteráz (NSE) enzimek hozzáadásával. A daganatsejtek morfológiája is árulkodó lehet, a felhalmozódó sejtek utalnak az AML altípusára, így az akut mieloblasztos leukémiákban (AML-M0, M1, M2) mieloblasztok, az akut promielocitás leukémiában (AML-M3) promielociták láthatók nagy számban a kenetben. A granulocita éréssel kísért akut mieloblasztos leukémia (AML-M2) és az akut promielocitás leukémia (AML-M3) esetében továbbá a sejtek citoplazmájában azurofil festődésű, pálcika alakú zárványokat (ún. Auer-pálcák) lehet látni, akárcsak a mielodiszpláziás szindrómák közé sorolt blasztszaporulattal járó refrakter anémia II-es típusában (RAEB-II) előforduló blasztokban.[35]
A sejtek immunfenotípusa, vagyis annak meghatározása, hogy milyen molekulák vannak jelen a sejtek felszínén illetve a citoplazmájukban, nagy segítséget nyújt az AML különböző csoportjainak elkülönítésében. A sejteken először immunjelölést végeznek, majd áramlási citométerrel meghatározzák, hogy a sejtek hány százalékában van jelen a vizsgált antigén.[36] A több egyidejűleg vizsgált marker segítségével kapott mintázat alapján lehet meghatározni a betegben kialakult AML sejtvonal szerinti eredetét. Például az AML-M0 (AML minimális differenciálódással) esetében a tumoros blasztok a vérképzés korai fázisában jelen lévő markerekre (CD34, CD38, HLA-DR) pozitívak, ellenben nem mutatható ki bennük semmilyen későbbi sejtvonalra (pl. monocita) jellemző marker sem.
| AML diagnosztikájában használt markerek:[34] | |
|---|---|
| Sejtvonal | Pozitív markerek |
| Prekurzor | CD34, CD38, CD117, CD133, HLA-DR |
| Granulocita vonal | CD13, CD15, CD16, CD33, CD65, citopazmatikus mieloperoxidáz (cMPO) |
| Monocita vonal | nem-specifikus észteráz (NSE), CD11c, CD14, CD64, lizozim, CD4, CD11b, CD36, NG2 homológ |
| Megakariocita vonal | CD41 (glikoprotein IIb), CD61 (glikoprotein IIIa), CD42 (glikoprotein Ib) |
| Eritroid vonal | CD235a |

A citogenetikai vizsgálatok arra irányulnak, hogy a sejtekben jelen lévő esetleges kromoszomális eltéréseket (főleg transzlokációkat) kimutassák. Bizonyos transzlokációk jellegzetesek az egyes altípusokra, illetve jelentős prognosztikai jelentőséggel bírnak, így meghatározásuk fontos információval szolgál a betegség várható kimenetelét illetően, hozzájárulva ahhoz, hogy a megfelelő agresszivitású kezelést kaphassa a beteg. A WHO klasszifikációja jelentős figyelmet szentel a talált citogenetikai eltéréseknek, a tumorsejtekben kimutatható aberrációk továbbá nagyban meghatározzák a beteg kockázat szerinti besorolását.[37] A tumorsejtekben található kromoszóma eltéréseket leggyakrabban fluoreszcens in situ hibridizációval (FISH) mutatják ki. A fénymikroszkóppal nem detektálható genetikai hibák kimutatására a PCR alkalmas.
| Az MRC 1998-as kockázati kategóriái a citogenetikai eltérések alapján:[38] | |||
|---|---|---|---|
| Kockázat | Genetikai abnormalitás | 5 éves túlélés | Visszaesés (relapszus) gyakorisága |
| Kis kockázatú | t(8;21), t(15;17), inv(16) | 70% | 33% |
| Közepes kockázatú | normál kariotípus, +8, +21, +22, 7q vagy 9q deléció, 11q23 abnormalitások, egyéb strukturális vagy számbeli kromoszóma hiba | 48% | 50% |
| Nagy kockázatú | -5, -7, 5q deléció, abnormális 3q, összetett citogenetikai eltérések | 15% | 78% |
Az újonnan jelentkező AML-es esetek mintegy felében nem azonosítható kromoszomális eltérés, ugyanakkor ezen betegcsoporton belül is kimutathatók olyan genetikai aberrációk, melyek prognosztikai jelentőséggel bírnak, ilyen többek között az FLT3, az MLL, vagy a nukleofozmint kódoló NPM1 gének eltérései.[39]
Az FLT3 (angolul:FMS-like tyrosine kinase 3) gén tandem repetitív mutációk jelenlétét kedvezőtlenebb kórlefolyással társították.[40] Ugyanakkor egy 2005-ös tanulmányban az FLT3 tandem mutációkat hordozó betegeknél rutinszerűen végzett csontvelő átültetés nem javította a túlélési statisztikákat.[41] Egy 2009-es dél-koreai vizsgálatban azt találták, hogy az FLT3 mutációknak főként a monocita sejtvonalat érintő AML-ben van igazán prognosztikai jelentősége.[42] Az FLT3 elleni célzott, szelektív tirozin-kináz gátló gyógyszereket is vizsgáltak, ilyen szer többek között a quizartinib, mely a klinikai vizsgálatokban kedvező hatásúnak bizonyult.[43]
Az FLT3 mellett a c-KIT proto-onkogén mutációk jelentőségét is vizsgálják AML-ben, mivel ezen molekula ellen is rendelkezésre állnak szelektív tirozin-kináz gátlók (pl. imatinib, sunitinib).[44]
Az akut mieloid leukémiák kezelése elsősorban kemoterápiás szereken alapul, de bizonyos esetekben csontvelő átültetés is szükséges lehet. A kezelések során a különböző citosztatikumokat nagy dózisban alkalmazzák, így a várható mellékhatások miatt nagy hangsúlyt kapnak az ún. kiegészítő (szupportív) kezelések is. Mindezekből kifolyólag az ilyen betegek ellátása rendszerint erre felkészült onko-hematológiai központokban zajlik.
A választott kezelési sémát nagyban meghatározza, hogy a beteg melyik kockázati csoportba sorolható (kis, közepes, nagy kockázatú), illetve milyen általános állapota és kísérőbetegségei vannak.
Az AML kezelése két szakaszra osztható. Először nagy dózisú kemoterápiás kezeléssel ún. indukciót végeznek, melynek célja, hogy a leukémiás sejtek számát a kimutathatósági szint alá csökkentse. Amennyiben ez sikerül, vagyis a csontvelőben a blasztok aránya kevesebb, mint 5%, a vérben egyáltalán nem láthatóak blasztok, a granulocita szám 1000/μl; a vérlemezke szám pedig 100.000/μl feletti, akkor teljes terápiás válaszról vagy más szavakkal komplett remisszióról beszélnek.[34] Ez még nem jelent gyógyulást, a kezelés elhagyásával a betegség kiújul, hiszen a kimutathatósági szint alatt is maradhatnak a betegben daganatos sejtek, melyekből újra fellángolhat a betegség.[45] Éppen ezért a remisszióba került betegnél is folytatni kell a kezelést, ezt a második szakaszt hívják posztremissziós (remisszió utáni) kezelésnek. Ennek célja a megmaradt tumorsejtek elpusztítása, ezáltal a végleges gyógyulás elérése. Ez utóbbi történhet szintén kemoterápiás szerek alkalmazásával, vagy (főleg a magasabb kockázatú esetekben) csontvelő átültetéssel is.
Minimális reziduális betegségnek (angolul: Minimal residual disease, MRD) nevezzük azt az állapotot, amikor a beteg a kezelés során vagy azt követően klinikailag ugyan remisszióba került, de finomabb módszerekkel (pl. PCR) kimutatható a leukémiás sejtek jelenléte a szervezetében.[46] MRD pozitív betegeknél a hagyományos kemoterápiákkal rendszerint nem érhető el tartós gyógyulás, ezért ezekben az esetekben csontvelő átültetést javasolnak.[47]

Az akut promielocitás leukémia (AML-M3) sajátos genetikai háttérrel (RARA-PML transzlokáció) és klinikummal (súlyos vérzésveszély, DIC) rendelkezik és a kezelése is nagyban eltér a többi altípusétól. Indukciós kezelésként csupa-transz-retinsavat (ATRA, tretinoin) alkalmaznak valamilyen antraciklin típusú kemoterápiás szerrel (pl. idarubicin vagy daunorubicin) kombinálva.[48] Az ATRA hatására az érésben addig megrekedt promielociták tovább differenciálódnak. Az ATRA kezelés már önmagában is komplett remisszióhoz vezet,[49] azonban a tartós gyógyulás eléréséhez szükséges antraciklinnel is kiegészíteni a kezelést. Az ATRA-hoz hasonló hatást fejt ki az arzén-trioxid is, melyet elsősorban visszaesést követően használnak.[50] Ha a visszaesés után alkalmazott kezeléssel sikerül ismét remissziót elérni, akkor csontvelő átültetés javasolt.
Az ATRA kezelés mellékhatásaként egyes betegekben kialakulhat az ún. ATRA szindróma, mely lázzal, testsúlygyarapodással, légzési nehézséggel, veseelégtelenséggel, alacsony vérnyomással járó potenciálisan életveszélyes tünetegyüttes.[51] Idejében kezdett dexametazon adásával az ATRA szindróma rendszerint jól kezelhető.
Az ATRA bevezetése a terápiába alapjaiban változtatta meg az akut promielocitás leukémia kezelését. A korábban nem túl jó prognózisú betegség ma az AML legjobban kezelhető típusa, az 5 éves túlélés (ami egyúttal végleges gyógyulást jelent) 80% körüli.[52][53] A betegség korai szakban történő halálozása azonban továbbra is jelentős, ennek hátterében a betegséggel járó súlyos véralvadási zavarok (DIC) állnak.[54][55]
A nem promielocitás AML-ek indukciós kezelésében az ún. "7+3" sémát alkalmazzák kiterjedten. Ennek során a beteg hét napon keresztül folyamatos citarabin kezelésben részesül, melyhez az első három napon antraciklin (leggyakrabban daunorubicin) adása is társul.[34] Ezzel a kezeléssel a kis kockázatú betegek kb. 60-80%-ában komplett remisszió érhető el.[34][56] A kis kockázatú, fiatal betegeknél négy ciklus intenzív kemoterápiát javasolnak, a hosszabb távú, fenntartó kezelés nem növeli tovább a gyógyulás valószínűségét.[57]
A közepes és nagy kockázatú betegeknél is a "7+3" séma szerint végzik az indukciós kezelést, mivel jelenleg nem áll rendelkezésre ennél hatékonyabb kombináció. Ha ezzel sikerül remissziót elérni, akkor csontvelő átültetés javasolt, mivel ezzel nagyobb arányban érhető el végleges gyógyulás, mint a posztremissziós kemoterápiával.[58][59]
Az AML terápiájában nagy hangsúlyt kapnak a kiegészítő kezelések is, melyek elsődleges célja a kemoterápiák okozta mellékhatások csökkentése. A legnagyobb veszélyt az ilyen betegekre a fertőzések jelentik, mivel az intenzív kemoterápia hatására jelentősen csökken az immunvédekezésben részt vevő sejtek száma.[60] A fertőzések megelőzésére a szigorú higiéniás szabályokon túlmenően (pl. elkülönítés, szájmaszk viselése a velük kapcsolatba kerülő személyzetnél, látogatóknál, kézfertőtlenítés, stb.) az ilyen betegeknek megelőző célzattal antibiotikumot és gombaellenes szereket adnak, mivel a baktériumok mellett a súlyosan immunhiányos betegekre a gombás fertőzések jelentik a legnagyobb veszélyt.[61][62]
A fertőzések kivédésében szintén nagy segítséget jelentenek a fehérvérsejtek képzését fokozó ún. kolónia stimuláló faktorok (G-CSF, GM-CSF).[63] Ezek alkalmazásával hamarabb rendeződik a kemoterápiás kezelések után a neutrofil granulociták száma, így a betegek rövidebb ideig szorulnak antibiotikumokra, és csökkenhet a kórházban töltött napok száma is.[64]
A kezelések mellékhatásaként nem csak az immunvédekezésben részt vevő sejtek száma csökken, a kemoterápiás szerek a teljes vérképzést károsítják, így a kezelések alatt a betegek vörösvérsejt és vérlemezke pótlásra is szorulhatnak.[65]
Leukémiás megbetegedés ritkán jelentkezik terhesség alatt, nagyjából minden 10.000 terhességre jut egy ilyen eset.[66] A terhesség önmagában nincs érdemi hatással a betegség lefolyására, ugyanakkor a kezelések jelentős kockázatot jelentenek a születendő magzatra nézve, így az ilyen betegek kezelésében szülész-nőgyógyász, hematológus és neonatológus együttműködésére van szükség. A kezelést az anya érdekében minél előbb meg kell kezdeni. Az első trimeszterben alkalmazott kemoterápia jelenti a legnagyobb veszélyt a magzatra, a második és a harmadik trimeszterben már kisebb a kockázat.[67] A leukémiás betegekben gyakoribb a vetélés, koraszülés, alacsony születési súly, illetve az első trimeszterben alkalmazott kemoterápiás kezelések mellett a különböző fejlődési rendellenességek is.
Az AML terápiájába is bevezettek célzott biológiai kezeléseket. Az egyik ilyen szer a gemtuzumab ozogamicin volt. A gemtuzumab egy CD33 molekula elleni monoklonális antitest, melyhez kémiailag egy citotoxikus hatású vegyületet kapcsoltak. A CD33 molekula az éretlen mieloid blasztokon található, ezért logikus gyógyszercélpontnak tűnt az akut mieloid leukémiák kezelésében. A gemtuzumab ozogamicint 2000-ben törzskönyvezték az Egyesült Államokban, a kezelést elsősorban olyan betegeknél alkalmazták, akikben a betegség kiújult.[68] 2010-ben a gyógyszert gyártó Pfizer visszavonta a szert piacról, miután a klinikai vizsgálatok számos súlyos mellékhatás mellett nem igazolták a hatékonyságát.[69][70] A visszavonás óta több kisebb tanulmányban is felvetették, hogy a szer alkalmazásának bizonyos válogatott beteganyagon lehet létjogosultsága.[71]
A leukémiák az összes gyermekkori daganatos megbetegedés kb. negyedét képezik,[72] ennek további 15-20 százaléka AML.[5] Ez Magyarországon mintegy 15-20 új beteget jelent évente,[72] világviszonylatban pedig 7/1.000.000 fő a 15 év alatti korcsoportban az éves incidenciája.[73] A gyermekkori AML-es betegek több, mint 70 százaléka meggyógyul,[74] bár az alkalmazott kezeléseknek lehetnek a későbbi felnőttkorban megjelenő szövődményei.
Bár a gyermekkori AML diagnosztikája és terápiája sokban hasonlít a felnőttkori betegségnél leírtakhoz, vannak jelentős különbségek is. A gyermekkori AML-ben előfordulnak olyan citogenetikai eltérések is, melyek a felnőttkori betegségre nem jellemzőek.[75] Ezek segíthetnek megítélni a betegség várható agresszivitását.[76] A diagnosztikában további különbség, hogy gyermekeknél minden esetben végeznek lumbálpunkciót az esetleges központi idegrendszeri érintettség felderítésére, míg felnőtteknél ez nem rutinszerű.[73] A vizsgálat végzésével egyidejűleg kemoterápiás szereket (pl metotrexát, citarabin) adnak az agy-gerincvelői folyadékba, mivel az intravénásan adott kemoterápia nehezen jut át a vér-agy gáton, így az agyban esetlegesen megbúvó tumorsejtek túlélhetnék a kezelést. Megelőző célzattal végezhetnek koponya besugárzást is,[73] bár ennek jogosultságát több szerző is kétségbe vonja,[77] így utóbbit inkább csak abban az esetben javasolják, ha a levett agy-gerincvelői folyadékban tumorsejteket találnak,[78] mivel a gyermekkori koponya besugárzásnak lehetnek későbbi káros hatásai.
Indukciós kezelésként gyermekkorban is a "7+3" sémát alkalmazzák, vagyis a beteg hét napon keresztül folyamatos citarabin kezelést kap, melyet az első három napon antraciklin típusú szerrel egészítenek ki.[73] Gyakran még egy harmadik szert is hozzáadnak a kombinációhoz, leggyakrabban 6-tioguanint vagy etopozidot. Sikeres indukciós kezelést követően posztremissziós kemoterápiát alkalmaznak. Csontvelő átültetést csak nagy kockázatú, vagy az indukciós kezelés után kiújuló betegség esetén javasolnak.[73]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.