Electroforese en xel de poliacrilamida
From Wikipedia, the free encyclopedia
Remove ads
Remove ads
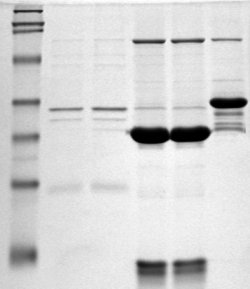
A electroforese en xel de poliacrilamida (ou PAGE, do inglés polyacrylamide gel electrophoresis) é unha técnica amplamente usada en bioquímica, química forense, xenética, bioloxía molecular e biotecnoloxía para separar macromoléculas biolóxicas, xeralmente proteínas ou ácidos nucleicos, segundo a súa mobilidade electroforética. A mobilidade electroforética é función da lonxitude, conformación e carga da molécula. A electroforese en xel de poliacrilamida é unha ferramenta poderosa usada para analizar mostras de ARN. Cando o xel de poliacrilamida é desnaturalizado despois da electroforese, pode obterse información sobre a composición da mostra de especies de ARN.[1] Existen principalmente dous grandes tipos de electroforese en xeles de poliacrilamida, que son: PAGE nativa (non desnaturalizante) e SDS-PAGE (desnaturalizante).

A poliacrilamida fórmase a partir da acrilamida. A hidratación de acrilonitrilo ten como resultado a formación de moléculas de acrilamida (C3H5NO) pola nitrilo hidratase.[2] A acrilamida é tóxica para o sistema nervioso humano, polo que deben seguirse todas as medidas de seguridade cando se traballa con ela. Antes da adición de auga o monómero de acrilamida é un po, pero é soluble en auga, polo que engadindo auga se polimeriza formando a poliacrilamida.[2] Ao facer xeles de poliacrilamida por medio da hidratación da acrilamida pode regularse o tamaño dos poros do xel. Un incremento das concentracións de acrilamida causa unha diminución do tamaño do poro do xel resultante da polimerización. O xel de poliacrilamida con poros pequenos é de grande axuda para examinar mellor moléculas máis pequenas, xa que as moléculas pequenas poden entrar nos poros e viaxar a través do xel, mentres que as moléculas grandes quedan atrapadas nas aberturas dos poros.
Como en todas as formas de electroforese en xel, as moléculas poden facerse "correr" no xel no seu estado nativo, conservando as estruturas de orde elevda das moléculas. Este método denomínase PAGE nativa. Alternativamente, pode engadirse un desnaturalizante químico para eliminar estas estruturas e converter a molécula nunha molécula sen estrutura cuxa mobilidade depende só da súa lonxitude (porque os complexos proteína-SDS teñen todos unha proporción masa-carga similar). Este procedemento chámase SDS-PAGE ou electroforese en xel de poliacrilamida con dodecil sulfato sódico. A SDS-PAGE é un método de separación de moléculas baseado nas diferenzas nos seus pesos moleculares. Ao pH ao cal se realiza a electroforese en xel as moléculas de SDS están cargadas negativamente e únense a proteínas nunha proporción establecida de aproximadamente unha molécula de SDS por cada dous aminoácidos.[3] Deste modo, o deterxente dálle a todas as proteínas unha proporción uniforme carga-masa. Ao unirse ás proteínas o deterxente destrúe as súas estruturas secundaria, terciaria e cuaternaria, desnaturalizándoas e converténdoas en cadeas polipeptídicas aproximadamente liñais cargadas negativamente. Cando se someten a un campo eléctrico na PAGE, as cadeas polipeptídicas cargadas negativamente viaxan cara ao ánodo con diferente mobilidade. A súa mobilidade ou distancia á que viaxan as moléculas é inversamente proporcional ao logaritmo do seu peso molecular.[4] Comparando a proporción relativa da distancia viaxada por cada proteína coa lonxitude do xel (Rf) poden extraerse conclusións sobre o peso molecular relativo das proteínas, nas que a lonxitude do xel é determinada pola distancia viaxada por unha pequena molécula usada como tinguidura de control (tracking dye).[5]
Para os ácidos nucleicos, o desnaturalizante máis comunmentre usado é a urea. Para as proteínas úsase o dodecil sulfato sódico (SDS), que é un deterxente aniónico aplicado ás mostras proteícas para cubrir as proteínas e facer que incorporen dúas cargas negativas con cada molécula de SDS unida en cada dous aminoácidos da proteína desnaturalizada.[6] O 2-mercaptoetanol pode tamén utilizarse para distorsionar as pontes disulfuro establecidas entre os complexos proteicos, o que axuda a desnaturalizar mellor a proteína. Na maioría das proteínas, a unión de SDS á cadea polipeptídica causa unha distribución homoxénea da carga por unidade de masa, o que ten como resultado o fraccionamento polo seu tamaño aproximado durante a electroforese. As proteínas que teñen un maior contido hidrofóbico (por exemplo, moitas proteínas de membrana, e aquelas que interaccionan con surfactantes no seu ambiente nativo) son intrinsecamente máis difíciles de tratar axeitadamente usando este método, debido á maior variabilidade na proporción de SDS unido.[7] Procedimentalmente, poden usarse xuntas a PAGE nativa e a SDS-PAGE para purificar e separar as diversas subunidades dunha proteína. A PAGE nativa mantén a forma oligomérica intacta e mostrará unha banda no xel que é representativa do nivel de actividade. A SDS-PAGE desnaturaliza e separa a forma oligomérica nos monómeoros que a constitúen, mostrando bandas que son representativas dos seus pesos moleclares. Estas bandas poden utilizarse para identificar e avaliar a pureza da proteína.[6]
Remove ads
Procedemento
Preparación da mostra
As mostras poden ser calquera material que conteña proteínas ou ácidos nucleicos. Estas poden ter unha procedencia biolóxica directa, por exemplo de células eucariotas ou procariotas, tecidos, virus, mostras ambientais ou proteínas purificadas. No caso dos tecidos sólidos ou células, estes adoitan ser primeiro rotos mecanicamente usando unha batedora (para grandes volumes de mostra), ou un homoxenizador (para pequenos volumes), por sonicación ou ciclado a alta presión, e pode usarse unha combinación de técnicas bioquímicas e mecánicas, como diversos tipos de filtración e centrifugación, para separar os distintos compartimentos celulares e orgánulos antes da electroforese. Biomoléculas sintéticas como oligonucleótidos poden utilizarse tamén como analitos.

A mostra a analizar pode opcionalmente mesturarse cun desnaturalizante químico se se desexa, xeralmente o SDS para o caso das proteínas ou a urea para os ácidos nucleicos. O SDS é un deterxente aniónico que desnaturaliza as estruturas secundarias, e as terciarias non unidas por pontes disulfuro, e xera ademais unha carga negativa en todas as proteínas en proporción á súa masa. A urea rompe as pontes de hidróxeno entre os pares de bases dos ácidos nucleicos. Quentar a mostra a polo menos 60 °C promove unha maior desnaturalización.[8][9][10][11]
Ademais do SDS, as proteínas poden opcionalmente ser tratadas brevemente con calor ata preto a ebulición en presenza dun axente redutor, como o ditiotreitol (DTT) ou o 2-mercaptoetanol (beta-mercaptoetanol/BME), que axuda a desnaturalizar as proteínas ao reducir quimicamente as pontes disulfuro, debilitando así algunhas formas de pregamento terciario das proteínas, e rompendo a estrutura cuaternaria da proteína (sepáranse as subunidades do oligómero). Este método denomínase SDS-PAGE redutora.
Pode engadirse á solución unha tinguidura de control, que adoita ter unha maior mobilidade electroforética que os analitos e permite ao experimentador trazar o avance da solución a través do xel durante o percorrido electroforético.

Preparación de xeles de acrilamida
Os xeles constan normalmente de acrilamida, bisacrilamida, o desnaturaliante opcional (SDS ou urea), e un tampón cun pH axustado. A solución nalgunhas ocasións pode ser desgasificada ao baleiro para previr a formación de burbullas de aire durante a polimerización. Alternativamente, pode engadirse butanol ao xel de resolución (para proteínas) despois de que se verte este, xa que o butanol elimina as burbullas e fai a superficie máis lisa. [12] Engádese unha fonte de radicais libres e un estabilizador, como o persulfato amónico e o TEMED para iniciar a polimerización.[13] A reacción de polimerización crea un xel debido á bisacrilamida engadida, a cal pode formar enlaces cruzados entre dúas moléculas de acrilamida. A proporción de bisacrilamida/acrilamida pode variarse con propósitos especiais, pero xeralmente é de 1 parte por cada 35. A concentración de acrilamida do xel pode variarse tamén, xeralmente entre o 5% e o 25%. Os xeles con porcentaxe baixa son mellores para resolver moléculas de peso molecular moi elevado, mentres que cómpren porcentaxes moito máis altas de acrilamida para resolver pequenas proteínas. O diámetro medio do poro dos xeles de poliacrilamida está determinado pola concentración total de acrilamidas (% T, onde T = concentración total de acrilamida e bisacrilamida) e a concentrción do axente que forma os enlaces cruzados, a bisacrilamida (%C, onde C = concentración de bisacrilamida).[14] O tamaño do poro redúcese reciprocamente á %T. En canto á %C, a concentración do 5% produce os poros máis pequenos, xa que a influencia da bisacrilamida no tamaño do poro describe unha gráfica con forma de parábola co vértice no 5%.

Os xeles adoitan polimerizarse entre dúas placas de vidro nun molde de xel, cun peite inserido na parte superior para crear os pozos para depositar a mostra. Despois de que o xel foi polimerizado o peite pode ser eliminado e o xel está listo para iniciar unha electroforese.

Electroforese
Na PAGE utilízanse varios sistemas rampón dependendo da natureza da mostra e do obxectivo experimental. Os tampóns utilizados no ánodo e cátodo poden ser o mesmo ou diferentes.[10][15] [16]


Aplícase un campo eléctrico a través do xel, causando que os ácidos nucleicos ou as proteínas cargadas negativamente migren a través do xel afastándose do eléctrodo negativo (que aquí é o cátodo, dado que é unha cela electrolítica en vez de galvánica) e achegándose ao eléctrodo positivo (o ánodo). Dependendo do seu tamaño, cada biomolécula móvese de xeito diferente a través da matriz do xel: as pequenas moléculas deslízanse máis facilmente a través dos poros do xel, mentres que as máis grandes teñen máis dificultade. O xel faise "correr" xeralmente durante unhas poucas horas, aínda que isto depende da voltaxe aplicada ao xel; a migración ocorre máis rapidamente a voltaxes maiores, pero estes resultados son normalmente menos exactos que os obtidos aplicando voltaxes baixas. Pasado o período de tempo establecido, obsérvase que as biomoléculas migraron a diferentes distancias segundo o seu tamaño. As biomoléculas máis pequenas viaxan a máis distancia ao longo do xel, mentres que as grandes permanecen preto do punto de orixe. Deste xeito, as biomoléculas poden ser separadas de forma moi aproximada de acordo co seu tamaño, o cal depende principalmente do peso molecular en condicións desnaturalizantes, pero depende tamén das conformacións de orde superior en condicións nativas. A mobilidade no xel defínese como a migración viaxada cun gradiente de voltaxe de 1V/cm e mídese en unidades de cm2/sec/V.[6] Con fins analíticos, a mobilidade relativa das biomoléculas, Rf, a proporción da distancia que viaxou a molécula no xel con respecto á distancia total que se desprazou a tinguidura de control represéntase graficamente fronte ao peso molecular da molécula (ou ás veces o logaritmo de MW, é dicir, a masa molar media, ou o Mr, o raio molecular). Estes gráficos ou plots tipicamente liñais representan os marcadores estándar ou curvas de calibración que son amplamente utilizados para a estimación cuantitativa de diversos tamaños moleculares.[6]
Porén, certas glicoproteínas, compórtanse de forma anómala nos xeles con SDS. Ademais, a análise de proteínas máis grandes de entre 250 000 e 600 000 Da tamén pode ser problemática debido a que eses polipéptidos se moven impropiamente nos sistemas de xeles que se adoitan utilizar.[17]
Procesamento posterior

Despois da electroforese, o xel pode tinguirse; para as proteínas xeralmente con Azul Brillante Coomassie R-250 (CCB, do inglés Coomassie Brilliant Blue R-250) con autorradiografía, e para os ácidos nucleicos con bromuro de etidio; ou para ambos, con tinguidura de prata. Isto permite a visualización das proteínas separadas, ou seguir facendo un maior procesamento (por exemplo, con western blot). Despois da tinguidura, as diferentes especies de biomoléculas aparecen como bandas diferenciadas no xel. É común facer "correr" tamén marcadores de peso molecular que teñen un peso molecular coñecido nun carreiro separado do xel para calibrar o xel e determinar a masa molecular aproximada de biomoléculas descoñecidas comparando a distancia viaxada en relación co marcador.
Para proteínas a SDS-PAGE é normalmente o ensaio de pureza elixido debido á súa fiabilidade e facilidade de uso. A presenza de SDS e o paso desnaturalizante fan que as proteínas se separen, aproximadamente segundo o seu tamaño, pero pode ocorrer unha migración anormal dalgunhas proteínas. Distintas proteínas poden tamén quedar tinguidas de maneira diferente, o cal interfire coa cuantificación por tinguidura. A PAGE pode tamén utilizarse como unha técnica preparativa para a purificación de proteínas. Por exemplo, a electroforese en xel de poliacrilamida continua nativa preparativa cuantitativa (QPNC-PAGE) é un método para separar metaloproteínas nativas en matrices biolóxicas complexas.
Remove ads
Ingredientes químicos e as súas funcións
Xel de poliacrilamida. Coñecíase como un medio de incrustación potencial para facer cortes de tecidos para preparacións xa en 1964, e dous grupos independentes empregaron o xel de poliacrilamida na electroforese en 1959.[18][19] Posúe varias características electroforéticas desexables que fan que sexa un medio moi versátil. É un xel sintético, termoestable, transparente, forte, e relativamente inerte quimicamente e pode ser preparado cun amplo rango de tamaño medio de poros.[20] O tamaño do poro dun xel e a reproducibilidade do tamaño do poro do xel están determinados por tres factores, a cantidade total de acrilamida presente (%T) (T = concentración total de acrilamida e bisacrilamida monómero), a cantidade de axente que xera enlaces cruzados (%C) (C = concentración de bisacrilamida), e o tempo de polimerización da acrilamida (cf. QPNC-PAGE). O tamaño do poro diminúe cando se incrementa a %T; con enlaces cruzados, un 5%C orixina o menor tamaño de poro. Calquera incremento ou diminución na %C desde o 5% fai incrementar o tamaño do poro, xa que o tamaño do poro con respecto á %C é unha función parabólica co vértice en 5%C. Isto parece deberse ao empaquetmento non homoxéneo das febras do polímero no xel. Este material xelatinoso pode tamén soportar altos gradientes de voltaxe, é axeitado para varios procedementos de tinguidura e destinguidura e poden ser dixerido para extraer fraccións sepradas ou secadas para autorradiografía e rexistro permanente.
Compoñentes
Os xeles de poliacrilamida están compostos dun xel de concentración (stacking gel) e un xel separador ou de resolución. O xel de concentración ten unha maior porosidade en relación co xel separador, e permite que as proteínas migren nunha área concentrada. Ademais, os xeles de concentración ou stacking xeralmente teñen un pH de 6,8, xa que as moléculas neutras de glicina do tampón permiten unha mobilidade das proteínas máis rápida, así como unha concentración de acrilamida máis baixa e diferfente contido iónico. Isto permite qaue as proteínas dunha mostra cargada se concentren nunha banda estreita durante os primeiros minutos da electroforese antes de entrar na porción do xel separador. Os xeles de concentración non son necesarios cando se usan xeles de gradiente. Por outra parte, os xeles separadores teñen un pH de 8,8, no que a glicina aniónica fai máis lenta a mobilidade das proteínas. Os xeles separadores permiten a separación das proteínas e teñen unha porosidade relativaemnte baixa. Aquí, as proteínas son separadas baseándose no tamaño (en SDS-PAGE) e tamaño/carga (PAGE nativa).[21]
O tampón químico estabiliza o pH no valor desexado dentro do xel e no tampón electroforético. A elección do tampón tamén afecta a mobilidade electroforética dos contraións do tampón e, por tanto, a resolución do xel. O tampón debería tamén non ser reactivo e non modificar ou reaccionar coa maioría das proteínas. Poden utilizarse diferentes tampóns como tampóns de ánodo e cátodo, dependendo da aplicación. Poden utilizarse moitos valores de pH nun só xel, por exemplo na electroforese DISC. Tampóns comúns usados na PAGE son: Tris, Bis-Tris, ou imidazol.
Os contraións equilibran a carga intrínseca do ión tampón e tamén afectan a forza do campo eléctrico durante a electroforese. Xeralmente evítase o uso de ións moi cargados e móbiles en tampóns de cátodo de SDS-PAGE, pero poden estar incluídos no propio xel, onde migran por diante das proteínas. En aplicacións como a DISC SDS-PAGE os valores de pH dentro do xel poden variar para cambiar a carga media dos contraións durante o funcionamento da electroforese para mellorar a resolución. Os contraións máis usados son a glicina e a tricina. A glicina foi utilizada como fonte de ións que van á cola ou ións lentos, porque o seu pKa é de 9,69 e mobilidade do glicinato é tal que a mobilidade efectiva pode establecerse nun valor por debaixo do das proteínas máis lentas coñecidas con carga negativa neta no rango de pH. O mínimo pH deste rango é de aproximadamente 8,0.
Cando a acrilamida (C3H5NO; mW ou masa molar media: 71.08) está disolta en auga, ten lugar a súa lenta e espontánea autopolimerización, uníndose as moléculas cabeza con cola para formar polímeros de cadeas simples longas. A presenza dun sistema xerador de radicais libres acelera moito a polimerización. Este tipo de reacción coñécese como polimerización por adición de vinilo. Unha solución destas cadeas de polímeros faise viscosa pero non forma un xel, porque as cadeas simplemente se deslizan unhas sobre outras. Para a formación do xel cómpre que se produza o enlace de varias cadeas entre si. A acrilamida é carcinóxena,[22] e tamén unha neurotoxina e unha toxina reprodutora.[23] É igualmente esencial almacenar acrilamida nun lugar frío, escuro e seco para reducir a autopolimerización e a hidrólise.
A bisacrilamida (N,N′-metilenobisacrilamida) (C7H10N2O2; mW: 154.17) é o axente de formación de enlaces cruzados máis usado para xeles de poliacrilamida. Quimicamente pode considerarse como dúas moléculas de acrilamida acopladas cabeza con cabeza nos seus extremos non reactivos. A bisacrilamida pode establecer enlaces cruzados entre dúas cadeas de poliacrilamida, orixinando así o xel.
O dodecil sulfato sódico (SDS) (C12H25NaO4S; mW: 288.38) (utilizado só en xeles desnaturalizantes de proteínas) é un forte axente deterxente usado para desnaturalizar proteínas nativas orixinando polipéptidos individuais. Esta desnaturalización, que se refire a unha desnaturalización construtiva, non se realiza pola total linearización da proteína, senón por cambios conformaconais na que a proteína para a ter unha combinación de pregamentos aleatorios e estruturas secundarias helicoidais.[7] Cando unha mestura de proteínas se quenta a 100 °C en presenza de SDS, o deterxente envolve o esqueleto do polipéptido. Únese aos polipéptidos nunha proporción de peso constante de 1,4 g SDS/g de polipéptido. Neste proceso, as cargas intrínsecas dos polipéptidos son desprezables comparadas coas crgas negativas proporcionadas polo SDS. Así, os polipéptidos despois do tratamento convértense en estruturas con forma de bastón que posúen unha densidade de carga uniforme, xa que teñen a mesma carga negativa neta por unidade de peso. As mobilidades electroforéticas destas proteínas son unha función linear do logaritmo do seu peso molecular. Sen SDS, diferentes proteínas con pesos moleculares similares migrarían de forma diferente debido a diferenzas na proporción masa-carga, xa que cada proteína ten un punto isoeléctrico e un peso molecular particular segundo a súa estrutura primaria. Isto coñécese como PAGE nativa. Engadir SDS resolve este problema, xa que se une á proteína e causa o seu despregamento, dándolle unha carga negativa uniforme en toda a lonxitude do polipéptido.
A urea (CO(NH2)2; mW: 60.06) é un axente caotrópico que incrementa a entropía do sistema ao interferir coas interaccións intramoleculares mediadas por forzas non covalentes como os enlaces de hidróxeno e forzas de van der Waals. A estrutura macromolecular é dependente do efecto neto destas forzas, e, por tanto, un incremento de solutos caotrópicos desnaturaliza as moléculas.
O persulfato amónico (N2H8S2O8; mW: 228.2) é unha fonte de radicais libres e úsase con frecuencia como iniciador para a formación de xeles. Unha fonte alternativa de radicais libres é a riboflavina, que xera radicais libres nunha reacción fotoquímica.
A TEMED (N, N, N′, N′-tetrametiletilenodiamina) (C6H16N2; mW: 116.21) estabiliza radicais libres e mellora a polimerización. A taxa de polimeriación e as propiedades do xel resultante dependen das concentracións de radicais libres. Incrementando a cantidade de radicais libres prodúcese unha diminución na lonxitude media da cadea do polímero, un incremento na turbidez do xel e unha diminución na elasticidade do xel. A diminución da cantidade producirá o efecto inverso. Deberían utilizarse as concentracións catalíticas máis baixas que permitan a polimerización nun período de tempo razoable. O persulfato amónico e o TEMED son usados normalmente a concentracións equimolares no rango de 1 a 10 mM.
Compostos químicos usados no procesamento e visualización

Os seguintes compostos químicos e procedementos utilízanse para procesar o xel e as mostras de proteínas visualizadas nel.
Tinguidura de control (tracking dye).- Como as proteínas e os ácidos nucleicos son na súa maioría incoloros o seu avance polo xel durante a electroforese non pode seguirse facilmente. Por tanto, normalmente no tampón das mostras para PAGE inclúense tinguiduras aniónicas de mobilidade electroforética coñecida. Unha tinguidura de control moi común é o azul bromofenol (BPB, ou 3',3",5',5" tetrabromofenolsulfonftaleína). Esta molécula está coloreada a pH alcalino e neutro e é unha molécula pequena cargada negativamente que se move cara ao ánodo. Ao ser unha molécula moi móbil móvese por diante da maioría das proteínas. Cando alcanza o extremo anódico do medio electroforético a electroforese é detida. Pode unirse debilmente a algunhas proteínas e dálles unha cor azul. Outras tinguiduras de control comúns son o xileno cianol, que ten menor mobilidade, e o Orange G, que ten maior mobilidade.
Axudas para a carga.- A maioría dos sistemas de PAGE son cargados desde a parte superior en pozos que hai no xel. Para asegurar que a mostra se afunde ata o fondo do xel, o tampón da mostra é suplementado con aditivos que incrementan a densidade da mostra. Estes aditivos deberían ser non iónicos e non reactivos coas proteínas para evitar interferir coa electroforese. Aditivos comúns son o glicerol e a sacarosa.
O Azul Brillante Coomassie R-250 (ou CBB, do inglés Coomassie Brilliant Blue) (C45H44N3NaO7S2; mW: 825.97) é a tinguidura de proteínas máis usada. É unha tinguidura aniónica, que se une non especificamente ás proteínas. A estrutura deste azul Coomassie é predominantemente non polar, e é utilizado usualmente en solucón metanólica acidificada con ácido acético. As proteínas no xel son fixadas polo ácido acético e tinguidas simultaneamente. O exceso de tingidura incorporada no xel pode ser eliminada destinguindo coa mesma solución pero sen a tinguidura. As proteínas son detectadas como bandas azuis sobre un fondo claro. Como o SDS é tamén aniónico, pode interferir co proceso de tinguidura. Por tanto, recoméndanse grandes volumes de solución de tinguidura, de polo menos dez veces o volme do xel.
O bromuro de etidio (EtBr) é unha tinguidura común para ácidos nucleicos. O EtBr permite visualizar doadamente o ADN ou ARN nun xel, xa que o EtBr fluoresce cunha cor laranxa baixo a luz ultravioleta.[24] O bromuro de etidio únese ás cadeas de ácidos nucleicos polo proceso de intercalación. [25] É importante utilizar con coidado o EtBr, xa que é carcinóxeno. Debido a isto, moitos investigadores optan por usar tinguiduras como o SYBR Green e o SYBR Safe, que son alternativas máis seguras que o EtBr.[26] O EtBr é utilizado engadíndoo simplemente á mestura do xel. Unha vez que se fixo "correr" o xel, o xel pode ser visto usando un sistema de fotodocumentación.[25]
A tinguidura de prata utilízase cando son necesarios métodos de detección máis sensibles, xa que a tinguidura clásica Azul Brillante Coomassie xeralmente detecta bandas de 50 ng de proteína, pero a tinguidura de prata incrementa a sensibilidade ata 10 a 100 veces máis. Isto está baseado na química do revelado fotográfico. As proteínas son fixadas ao xel cunha solución de metanol diluída, que é incubada cunha solución de nitrato de prata ácido. Os ións de prata son reducidos á súa forma metálica polo formaldehido a pH alcalino. Unha solución ácida, como a de ácido acético detén o revelado.[27] A tinguidura de prata foi introducida por Kerenyi e Gallyas como un procedemento sensible para detectar cantidades traza de proteínas en xeles.[28] A técnica foi aplicada despois ao estudo doutras macromoléculas biolóxicas que eran separadas en diversos soportes.[29] Hai moitas variables que poden influír na intensidade da cor e cada proteína ten as súas propias características de tinguidura. Usar vidros limpos, reactivos puros e auga de alta pureza son os puntos clave para facer unha tinguuidura con éxito.[30]
A autorradiografía, tamén usada para a detección de bandas de proteínas despois dunha electroforese en xel, utiliza isótopos radioactivos para etiquetar proteínas, as cales son despois detectadas usando unha película de raios X.[31]
O western blot é un proceso polo cal as proteínas separadas no xel de poliacrilamida son transferidas a unha memnbrana estable e manipulable de nitrocelulosa, nailon ou PVDF. Despois é posible aplicar técnicas inmunoquímicas para visualizar as proteínas transferidas e identificar adecuadamente os incrementos ou diminucións ralativos da proteína de interese.
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads