Masa celular interna
From Wikipedia, the free encyclopedia
Remove ads
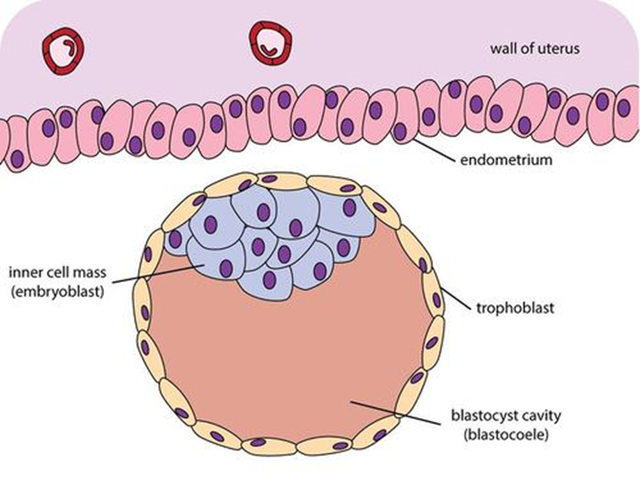
A masa celular interna[1][2] (MCI) do blastocisto,[3] tamén chamada embrioblasto (coñecido como pluriblasto en marsupiais) é unha estrutura que aparece nas etapas iniciais do desenvolvemento do embrión. É a masa de células que está dentro do blastocisto que dará lugar ás estruturas defintivas do feto. A masa celular interna fórmase nas etapas temperáns do desenvolvemento embrionario, previas á implantación no endometrio do útero.[4] A masa celular interna está totalmente rodeada por unha soa capa de células trofoblásticas, que constitúen o trofoectoderma. Posteriormente, no oitavo día de desenvolvemento, a masa celular interna ou embrioblasto diferénciase en dúas capas: epiblasto e hipoblasto.
.
Remove ads
Seguintes etapas do desenvolvemento
A separación física e funcional da masa celular interna (MCI) do trofoectoderma (TE) é unha característica especial do desenvolvemento dos mamíferos e a primeira liñaxe de células específica destes embrións. Despois da fecundación no oviduto, o embrión de mamífero sofre unha rolda relativamente lenta de segmentacións para producir unha mórula de 8 células. Cada célula da mórula, chamada blastómero, incrementa a superficie de contacto coas súas veciñas nun proceso chamado compactación. Isto orixina unha polarización das células da mórula, e ulteriores segmentacións dan lugar a un blastocisto de aproximadamente 32 células.[5] Nos ratos, a nova masa celular interna consta de 12 células internas e o trofoecoderma que as rodea consta de 20–24 células.[6][7] Hai variacións entre especies de mamíferos en canto ao número de células que hai no estadio de compactación; os embrións bovinos mostran as diferenzas relacionadas coa compactación xa no estadio de 9-15 células e en coellos non ata despois do estadio de 32 células.[8] Hai tamén variación interespecifica nos padróns de expresión de xenes nos embrións temperáns.[9]
A MCI e o TE xeran tipos de células claramene diferentes a medida que empeza a implantación e continúa a embrioxénese. As células trofoectodérmicas forman tecidos extraembrionarios, que actúan como soporte do embrión propiamente dito. Ademais, estas células bombean fluído no interior do blastocisto, causando a formación dun blastocisto polarizado que ten a MCI adherida a un dos extremos do trofoectoderma (ver figura). Esta diferenza na localización celular causa que as células da MCI expostas á cavidade chea de líquido acabarán por converterse no endoderma primitivo (ou hipoblasto), mentres que o resto das células se transformaran no ectoderma primitivo (ou epiblasto). O hipoblasto contribúe á formación das membranas extraembrionarias e o epiblasto dará lugar ao embrión final propiamente dito, así como a algúns tecidos extraembrionarios.[5]
Remove ads
Regulación da especificación celular
Como a segregación de células pluripotentes da masa celular interna do resto do blastocisto é parte integral do desenvolvemento dos mamíferos, realizáronse moitas investigacións para dilucidar os mecanismos celulares e moleculares correspondentes deste proceso. Hai un interese primario en saber que factores de transcrición e moléculas de sinalización dirixen as divisións asimétricas dos blastómeros que orixinan as chamadas células internas e externas e así a especificación das liñaxes celulares. Porén, debido á natureza variable e reguladora dos embrións de mamíferos, as evidencias experimentais para establecer estes destinos iniciais das células seguen sendo incompletas.[6]
A nivel de transcrición, os factores de transcrición Oct4, Nanog, Cdx2 e Tead4 foron implicados no establecemento e reforzamento da especificación da MCI e o TE nos embrións temperáns de ratos.[6]

- Oct4: Oct4 exprésase na MCI e participa no mantemento da súa pluripotencia, un papel que foi estudado nas MCIs derivadas de células nais embrionarias de ratos.[10] As células knockout xenéticas Oct4 tanto in vivo coma en cultivo mostran características morfolóxicas de TE. Demostrouse que unha diana transcricional de Oct4 é o xene Fgf4. Este xene normalmente codifica un ligando segregado pola MCI, o cal induce a proliferación do TE polar adxacente.[10]
- Nanog: Nanog tamén se expresa na MCI e participa no mantemento da súa pluripotencia. En contraste con Oct4, os estudos de ratos nulos para Nanog non mostran a reversión das MCI a unha morfoloxía similar á do TE, pero demostran que a perda de Nanog impide que a MCI xere o endoderma primitivo.[11]
- Cdx2: Cdx2 exprésase intensamente no TE e cómpre para manter a súa especificación. Os ratos knockout para o xene Cdx2 sofren compactación, pero perden a integridade epitelial de TE durante o estadio de blastocisto tardío. Ademais, a expresión de Oct4 elévase seguidamente nestas células do TE, o que indica que Cdx2 xoga un papel na supresión de Oct4 nesta liñaxe de células. Ademais, as células nais embrionarias poden xerarse a partir dos ratos nulos para Cdx2, o que demostra que Cdx2 non é esencial para a especificación das MCIs.[12]
- Tead4: Igual que Cdx2, Tead4 é necesario para o funcionamento do TE, aínda que o factor de tanscrición exprésase de maneira ubicua. Os ratos nulos para Tead4 sofren igualmente a compactación, pero non conseguen xerar a cavidade blastocélica. Igual que os embrións nulos para Cdx2, os embrións nulos para Tead4 poden orixinar células nais embrionarias, o que indica que Tead4 é dispensable para a especificación da MCI.[13] Traballos recentes mostraron que Tead4 pode axudar a regular á alza Cdx2 no TE e a súa actividade transcricional depende do coactivador Yap. A localización nuclear de Yap en células externas permite que contribúan á especificidade do TE, mentres que as células internas secuestran Yap no citoplasma por medio dunha fosforilación.[14]
Xuntos estes factores de transcrición funcionan nun bucle de retroalimentación positiva que reforza a MCI á distribución celular no TE. A polarización inicial dos blastómeros ocorre no estadio de 8-16 células. Obsérvase unha polaridade apical-basolateral pola visualización de marcadores apicais como Par3, Par6 e aPKC, así como o marcador basal E-cadherina.[6] O establecemento desa polaridade durante a compactación pénsase que xera unha identidade ambiental ás células internas e externas do embrión. Consecuentemente, a expresión estocástica dos factores de tanscrición antes mencionados é amplificada nun bucle de retroalimentación que especifica que as células externas estean destinadas ao TE e as células internas á MCI. No modelo, un ambiente apical activa Cdx2, o cal regula á alza a súa propia expresión por medio dun factor de transcrición situado augas abaixo chamado Elf5. En concerto cun terceiro factor de transcrición, Eomes, estes xenes actúan suprimindo xenes de pluripotencia como Oct4 e Nanog nas células externas.[6][12] Así, o TE queda especificado e diferenciado. Porén, as células internas non activan o xene Cdx2, e expresan altos niveis de Oct4, Nanog e Sox2.[6][7] Estes xenes suprimen Cdx2 e as células internas manteñen a pluripotencia e xeran a MCI e finalmente o resto do embrión propiamente dito.
Aínda que esta dicotomía de interaccións xenéticas é claramente necesaria para dividir os blastómeros do embrión de rato tanto da MCI coma do TE e as identidades do TE, a iniciación destes bucles de retroalimentación segue debaténdose. Tampouco está claro se están establecidos estocásticamente ou por medio dunha asimetría incluso mais temperán, e as investigacións actuais buscan identificar marcadores máis temperáns de asimetría. Por exemplo, algúns investigadores correlacionan as dúas primeiras segmentacións durante a embrioxénese con respecto aos polos animal e vexetal prospectivos cunha especificación deinitiva. A división asimétrica de información epixenética durante estas primeiras dúas segmentacións, e a orientación e orde na cal ocorren, pode contribuír á posición da célula tanto dentro coma fóra da mórula.[15][16]
Remove ads
Células nais
Os blastómeros illados da MCI de embrións de mamíferos que crecen en cultivos celulares denomínanse células nais embrionarias. Estas células pluripotentes, cando crecen nun medio coidadosamente coordinado, poden dar lugar ás tres capas xerminaris (ectoderma, endoderma e mesoderma) do corpo adulto.[17] Por exemplo, o factor de transcrición LIF4 é necesario para manter in vitro as células nais de rato.[18] Os blastómeros son disociados dunha masa celular interna illada nun blastocisto temperán, e o seu código transcricional gobernado por Oct4, Sox2 e Nanog axuda a mantelos en estado indiferenciado.
Un beneficio da natureza regulatoria na cal se desenvolven os embrións de mamíferos é a manipulación dos blastómeros da masa celular interna para xerar ratos knockout. Nos ratos as mutacións nun xene de interese poden ser introducidas por retrovirus en células nais embrionarias cultivadas, e estes poden ser reintroducidos na masa celular interna dun embrión intacto. O resultado é un rato quimérico, que se desenvolve cunha porción das súas células que conteñen o xenoma da célula nai embrionaria. O obxectivo deste procedemento é incorporar o xene mutado nunha liña xerminal de rato para que a súa proxenie perda un ou ambos os alelos do xene de interese. Os xenetistas aprovéitanse desta técnica de manipulación das células da masa interna para estudaren a función de xenes do sistema mamaliano.[5][17]
Galería
- Vesícula blastodérmica do morcego Vespertilio murinus.
- Corte a través do disco embrional de Vespertilio murinus.
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

