Beta-lactama
From Wikipedia, the free encyclopedia
Unha beta-lactama (β-lactama) ou anel beta-lactámico é unha lactama que forma un anel de catro membros.[1] As lactamas son amidas cíclicas. A denominación beta do seu nome refírese a que o seu átomo de nitróxeno está unido ao átomo de carbono β en relación ao carbonilo. A β-lactama máis simple posible é a 2-azetidinona. Os aneis β-lactámicos forman parte da estrutura de importantes antibióticos, chamados antibióticos beta-lactámicos, como a penicilina. Algunhas bacterias son resistentes a eses antibióticos porque teñen un encima beta-lactamase, que rompe o anel β-lactámico.


Importancia clínica
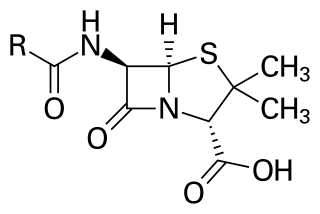
O anel β-lactámico forma parte da estrutura central de varias familias de antibióticos, os principais son as penicilinas, cefalosporinas, carbapenems e monobactams, que son, por tanto, chamados tamén antibióticos β-lactámicos. Case todos estes antibióticos funcionan inhibindo a biosíntese da parede celular. Isto ten un efecto letal sobre as bacterias, aínda que toda poboación de bacterias adoita conter un subgrupo que é resistente a antibióticos β-lactámicos. A resistencia bacteriana só ocorre como resultado da expresión dun dos moitos xenes que existen do encima β-lactamase. Documentáronse máis de 1 800 encimas β-lactamases diferentes en varias especies de bacterias.[2] Estes encimas varían amplamente na súa estrutura química e eficiencia catalítica.[3] Cando as poboacións bacterianas teñen estes subgrupos resistentes, o tratamento con antibióticos β-lactámicos pode ter como resultado que a cepa resistente se faga máis frecuente e, por tanto, a especie sexa máis virulenta. Os antibióticos derivados da β-lactama poden considerarse como unha das clases de antibióticos máis importantes, pero tendente a presentar resistencia clínica. A β-lactama mostra as súas propiedades como antibiótico imitando o substrato natural D-Ala-D-Ala para o grupo de encimas chamados proteínas de unión á penicilina (PBP, do inglés penicillin binding proteins), que teñen como función establecer enlaces cruzados co peptidoglicano da parede celular bacteriana.[4]
Historia
A primeira β-lactama sintética preparouna Hermann Staudinger en 1907 ao facer reaccionar a base de Schiff da anilina e o benzaldehido coa difenilcetena[5][6] nunha cicloadición [2+2] (o Ph na figura indica un grupo funcional fenilo):
Ata 1970, a maioría das investigacións sobre as β-lactamas realizábanse cos grupos da penicilina e cefalosporina, pero desde entón, describíronse unha ampla variedade de estruturas.[7]
Síntese
A síntese Breckpot é a síntese de β-lactamas substituídas a partir da ciclación de ésteres de beta aminoácidos usando o reactivo de Grignard .
Reactividade
Debido á tensión de anel (ring strain), as β-lactamas son hidrolizadas máis doadamente que as amidas liñais ou lactamas máis grandes. Esta tensión increméntase máis pola fusión a un segundo anel, como se observa na maioría dos antibióticos β-lactámicos. Esta tendencia débese a que o carácter amida da β-lactama é reducido pola aplanaridade do sistema. O átomo de nitróxeno dunha amida ideal ten hibridación sp2 debido á resonancia, e os átomos con hibridación sp2 teñen xeometría de enlace planar trigonal. Como se forza unha xeometría de enlace piramidal no átomo de nitróxeno pola tensión de anel, a resonancia do enlace amida queda reducida, e o carbonilo compórtase de forma parecida a unha cetona. O premio Nobel Robert Burns Woodward describiu un parámetro h que mide a altura da pirámide trigonal definida polo nitróxeno (como o apex) e os seus tres átomos adxacentes. h corresponde á forza do enlace β-lactama e os valores máis baixos (máis planar; máis similar a unha amida ideal) son máis fortes e menos restritivos.[8] Os monobactams teñen valores h entre 0,05 e 0,10 ángstroms (Å). Os cefems teñen valores h de 0,20–0,25 Å. Os penams teñen valores entre 0,40 e 0,50 Å, mentres que os carbapenems e clavams teñen valores entre 0,50 e 0,60 Å, sendo as máis reactivas das β-lactamas en canto á hidrólise.[9]
Outras aplicacións
Un novo estudo suxeriu que as β-lactamas poden experimentar unha polimerización de apertura do anel para formar enlaces amida, e converterse en polímeros de nailon-3. Os esqueletos destes polímeros son idénticos aos dos péptidos, que lles dan biofuncionalidade. Estes polímeros de nailon-3 poden imitar a péptidos de defensa do hóspede.[10]
Tamén se informou de axentes antiproliferativos que actúan sobre a tubulina que teñen na súa estrutura β-lactamas.[11][12]
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


