Ácido graxo sintase
From Wikipedia, the free encyclopedia
A ácido graxo sintase (en inglés Fatty acid synthase ou FAS) é un encima que nos humanos está codificado no xene FASN[1] situado no cromosoma 17 e que intervén na síntese de ácidos graxos.[2][3][4][5]
| Ácido graxo sintase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
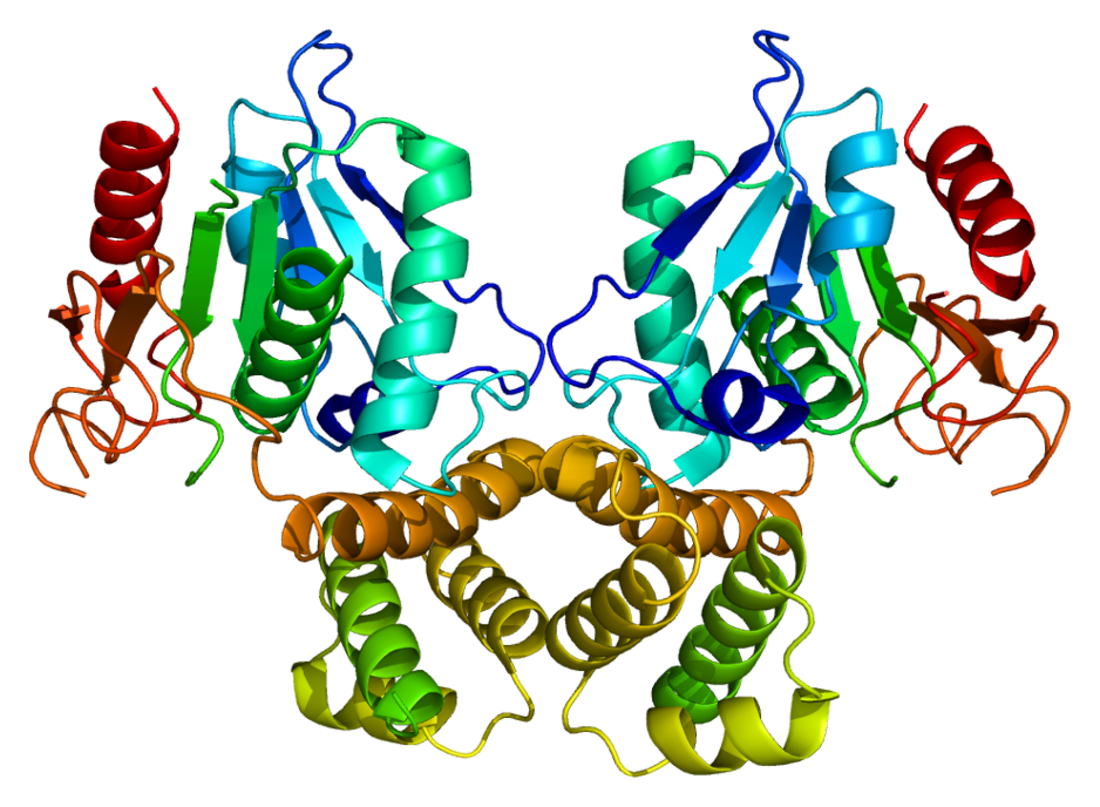
| PDB 1xkt | |||||||||
| Identificadores | |||||||||
| Número EC | 2.3.1.85 | ||||||||
| Número CAS | 9045-77-6 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
A ácido graxo sintase é un complexo multiencimático composto por dous polipéptidos idénticos de 272 kDa multifuncionais que cataliza a síntese de ácidos graxos, no cal os substratos van pasando dun dominio funcional ao seguinte.[6][7][8][9]
A súa principal función é catalizar a síntese de palmitato a partir de acetil-CoA e malonil-CoA, que achegan grupos de dous carbonos, en presenza de NADPH, orixinando ácidos graxos de cadea longa saturados.[5]
Funcións metabólicas
- Véxase tamén: Síntese de ácidos graxos.
Os ácidos graxos son ácidos alifáticos fundamentais para a produción de enerxía e o seu almacenamento, manter estruturas celulares e servir como intermediarios na biosíntese de hormonas e outras importantes moléculas. Sintetízanse por medio dunha serie de reaccións de condensación de Claisen descarboxilativas a partir de acetil-CoA e malonil-CoA. En cada rolda de elongación da cadea o grupo beta ceto redúcese a unha cadea carbonada completamente saturada pola acción secuencial dunha cetorredutase (KR), unha deshidratase (DH), e unha enol redutase (ER). A cadea de ácido graxo en crecemento é transportada sucesivamente aos sitios activos destes encimas do complexo mentres está unido covalentemente ao grupo prostético fosfopanteteína dunha proteína portadora de acilos (ACP), e é liberado pola acción dunha tioesterase (TE) cando a cadea carbonada chega a unha lonxitude de 16 carbonos, correspondente ao ácido palmítico.
Clases
Hai dúas clases de ácido graxo sintases (FAS):
- Sistemas de tipo I, que utilizan un só polipéptido multifuncional grande e son comúns en mamíferos e fungos (aínda que a disposición estrutural en ambos difire). Un sistema de ácido graxo sintase de tipo I tamén se encontra no grupo CMN de bacterias, formado por corinebacterias, micobacterias, e nocardias. Nestas bacterias, o sistema FAS I produce ácido palmítico, e coopera co sistema FAS II para producir unha maior diversidade de produtos lipídicos.[10]
- Tipo II, que se encontra en arqueas e bacterias, caracterízase polo uso de encimas monofuncionais discretos para a síntese de ácidos graxos. Investíganse inhibidores desta vía (FASII) como posibles antibióticos.[11]
O mecanismo de elongación e redución de FAS I e FAS II é o mesmo, xa que os dominios dos encimas FAS II son en grande medida homólogos dos dominios dos seus equivalentes nos polipéptidos multiencimáticos FAS I. Porén, as diferenzas na organización dos encimas (integrados en FAS I, e discretos en FAS II) dá lugar a moitas diferenzas bioquímicas importantes.[12]
A historia evolutiva das ácido graxo sintases está moi entrelazada coa das policétido sintases (PKS). As policétido sintases usan un mecanismo similar e dominios homólogos para producir metabolitos secundarios lipídicos. Ademais, as policétido sintases tamén mostran unha organización de tipo I e tipo II. O FAS I en animais crese que se orixinou por modificación da PKS I de fungos, mentres que o FAS I de fungos e do grupo CMN bacteriano parece que se orixinaron por separado por medio da fusión dos xenes de FAS II.[10]
Estrutura
A FAS de mamíferos consiste nun homodímero de dúas subunidades proteicas idénticas, nas cales tres dominios catalíticos na sección N-terminal (-cetoacil sintase (KS), malonil/acetiltransferase (MAT), e deshidratase (DH)), están separadas por unha rexión central de 600 residuos dos catro dominios C-terminais (enoíl redutase (ER), -cetoacil redutase (KR), proteína portadora de acilos (ACP) e tioesterase (TE)).[13][14] En total son, pois, sete dominios.
O modelo convencional da organización da FAS (modelo cabeza con cola) está en grande medida baseado nas observacións de que o reactivo bifuncional 1,3-dibromopropanona (DBP) pode entrelazar o sitio activo cisteína tiol do dominio KS nun monómero de FAS co grupo prostético fosfopanteteína do dominio ACP do outro monómero.[15][16] A análise de complementación dos dímeros de FAS que teñen diferentes mutacións en cada monómero estableceu que os dominios KS e MAT poden cooperar coa ACP de cada monómero,[17][18] e unha reinvestigación dos experimentos de entrelazamento de DBP revelaron que o sitio activo de KS Cys161 tiol podía entrelazarse co ACP 4'-fosfopanteteína tiol de cada monómero.[19] Ademais, informouse recentemente que unha FAS heterodimérica que contén só un monómero competente pode facer a síntese do palmitato.[20]
As observacións anteriores parecen incompatibles co modelo clásico "cabeza con cola" da organización da FAS, e propúxose un modelo alternativo, que predí que os dominios KS e MAT de ambos os monómeros se sitúan próximos ao centro do dímero da FAS, onde poden acceder á ACP de cada subunidade.[21]
Resolveuse unha estrutura de cristalografía de raios X de baixa resolución do encima FAS de porco (homodímero)[22] e de lévedo (heterododecámero)[23] xunto con imaxes de ~6 Å de resolución de crio-electromicroscopia (crio-EM) da estrutura da FAS de lévedo.[24]
Mecanismo de traslado do substrato
As estruturas resoltas das FAS de lévedo e mamífero presentan dúas organizacións distintas dos dominios/encimas catalíticos moi conservados nesta máquina celular multiencimática. A FAS de lévedo ten unha estrutura de tipo barril ríxida moi eficiente con seis cámaras de reacción que sintetizan ácidos graxos independentemente, mentres que a FAS de mamífero ten unha estrutura flexible con só dúas cámaras de reacción. Porén, en ambos os casos a ACP conservada actúa como o dominio móbil responsable do traslado dos substratos de ácido graxo intermedios a varios centros catalíticos. A primeira visión estrutural directa deste mecanismo de traslado do substrato obtívose por análise de crio-EM, no cal a ACP se observa unida a varios dominios catalíticos na ácido graxo sintase con forma de barril de lévedo.[24] Os resultados da crio-EM indican que a unión da ACP a varios sitios é asimétrica e aleatoria, como tamén indican os estudos de simulación por computadora.[25]
Regulación
O metabolismo e a homeostase da FAS está regulada transcricionalmente polos Factores Estimuladores de Augas Arriba (Upstream Stimulatory Factors) USF1 e USF2) e pola proteína que se une ao elemento regulador de esterois-1c (SREBP-1c) en resposta á alimentación/insulina en animais vivos.[26][27]
Aínda que o receptor X hepático (LXRs) modula a expresión da SREBP-1c durante a alimentación, a regulación da FAS pola SREBP-1c é dependente de USF.[27][28][29][30]
Os acilfloroglucinois illados do fento Dryopteris crassirhizoma mostran unha actividade inhibidora da ácido graxo sintase.[31]
Importancia clínica
A FAS foi investigada como posible oncoxene.[32] A FAS está sobrerregulada nos cancros de mama e é un indicador de mal prognóstico e pode tamén ser útil como diana quimioterapéutica.[33][34] A FAS pode tamén estar implicada na produción dun ligando endóxeno para o receptor nuclear PPARalfa, diana dos medicamentos fibrato para a hiperlipidemia,[35] e é investigado como unha posible diana de medicamentos para o tratamento da síndrome metabólica.[36]
Nalgunhas liñas de células cancerosas, esta proteína viuse que estaba fusionada co receptor de estróxenos alfa (ER-alfa), no cal o extremo N-terminal do FAS está fusionado en pauta co extremo C-terminal do ER-alfa.[5]
Informouse unha asociación coa doenza mioma uterino.[37]
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.