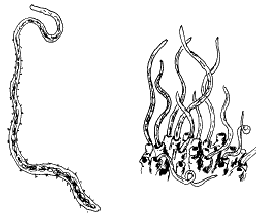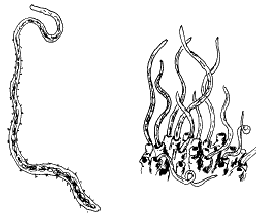Top Qs
Chronologie
Chat
Contexte
Tubifex
espèce de vers De Wikipédia, l'encyclopédie libre
Remove ads
Les tubifex (genre Tubifex) sont de petits vers oligochètes fins, rougeâtres, qui vivent en colonie sur le fond des mares, étangs, cours d'eau lents. Ils constituent des colonies très denses, en taches. En zone tempérée, ils peuvent littéralement tapisser certaines parties des fonds de cours d'eau pollués où on les trouve généralement avec des larves de chironomes et une espèce de sangsue, qui sont les seuls à également supporter des taux d'oxygène très bas et un haut niveau de pollution organique[1],[2].
Remove ads
Description, mode de vie
Résumé
Contexte




Les tubifex mesurent quelques centimètres de long pour environ 1 mm de diamètre, leur corps est rose clair. Les colonies (de la taille d'une assiette) sont constituées de centaines d'individus relativement peu espacés les uns des autres. Chacun a une partie de son corps plongée dans le substrat (vase), où ils puisent leur nourriture (débris végétaux en décomposition) et ce qui leur permet de s'enfouir totalement à la moindre alerte (la colonie disparaissant brutalement… pour réapparaître quelques minutes plus tard). La partie enfoncée correspond à la « tête » tandis que la partie terminale qui ondule, chargée en hémoglobine, fixe et sert de réserve en oxygène[3].
Ces vers peuvent vivre pendant des mois presque sans oxygène et résistent à des records de pollution organique, là où la plupart des autres espèces disparaissent. En cas d'assèchement de leur milieu, ils s'enkystent et peuvent survivre plusieurs semaines, en attendant que les conditions s'améliorent.
Ils jouent un rôle pionnier[4] de dépollueur primaire dans les sédiments très pollués en matière organique, mais ils peuvent aussi bioaccumuler certains polluants et contribuer à les (re-)disperser (bioturbation). Les tubifex peuvent avoir concentré (bioconcentration) des polluants de la vase (« métaux lourds » notamment) et transporter des microbes pathogènes comme Myxobolus cerebralis ou Mycobacterium qui provoque des maladies intestinales aux poissons[5],[6]. Une population dense de tubifex est un indicateur de dystrophisation du milieu, ou au moins de forte pollution organique (par exemple en aval de rejets insuffisamment traités de papeteries ou d'abattoirs).
Remove ads
Aquariophilie
En raison de leur taille, les tubifex constituent une nourriture vivante appréciée des petits poissons d'aquarium avec toutefois le risque inhérent aux parasites qu'ils peuvent véhiculer, à divers microbes (streptocoques, staphylocoques fécaux, et toxiques (botulique…) et aux polluants (métaux lourds notamment) qu'ils ont pu absorber et bioaccumuler dans les sédiments (le tubifex est typique des milieux les plus pollués et est à ce titre un des bioindicateurs utilisés par les écotoxicologues[7]). Leur récolte est interdite par les particuliers dans certains pays, ils peuvent être vendus pour l'aquariophilie ou la pêche, frais ou congelés en magasin spécialisé. Il est nécessaire de les faire dégorger plusieurs jours dans de l'eau courante avant de les utiliser comme nourriture pour poisson[8].
Remove ads
Toxicologie
Ils servent de bioindicateurs et sont parfois utilisés (avec un autre oligochète d'eau douce (Lumbriculus variegatus) pour évaluer la toxicité in vitro de certains produits ou métaux lourds dans un sédiment[9]
Liste d'espèces
Selon NCBI (25 janvier 2021)[10] :
- Tubifex blanchardi
- Tubifex ignotus
- Tubifex montanus
- Tubifex newaensis
- Tubifex smirnowi
- Tubifex tubifex
Selon ITIS (25 janvier 2021)[11] :
- Tubifex ignotus (Stolc, 1886)
- Tubifex nerthus Michaelsen, 1908
- Tubifex newaensis (Michaelsen, 1903)
- Tubifex tubifex (Müller, 1774)
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads