loi de chimie physique De Wikipédia, l'encyclopédie libre
En chimie physique, la loi de l'ébulliométrie permet de quantifier l'élévation de la température d'ébullition d'un solvant en fonction de la quantité de soluté ajouté.
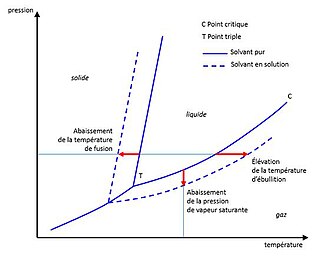
Elle est, avec la loi de la cryométrie et la loi de la tonométrie, l'une des trois lois énoncées à partir de 1878 par François-Marie Raoult[1] concernant les propriétés colligatives d'une solution chimique liquide. Avec la loi de l'osmométrie, énoncée par Jacobus Henricus van 't Hoff en 1896 et concernant le phénomène de l'osmose, ces lois ont notamment permis d'établir des méthodes de détermination expérimentale de la masse molaire des espèces chimiques.
Remarque
Lorsque l'on considère un solvant contenant un soluté , la température d'ébullition du solvant avec le soluté est plus haute que la température d'ébullition du solvant seul. La loi de l'ébulliométrie s'énonce ainsi :
« L'élévation de la température d'ébullition est proportionnelle à la fraction molaire du soluté. »
Soit (en remarquant que pour un corps pur la température d'ébullition est égale à la température de vaporisation) :
| Loi de l'ébulliométrie : |
avec :
La constante ébullioscopique ne dépend que des propriétés du solvant :
avec :
Sous cette forme, la constante ébullioscopique a la dimension d'une température, elle s'exprime en kelvins (K).
Autrement dit, à pression constante, la température d'ébullition du solvant pur passe à en présence d'un soluté. L'enthalpie de vaporisation étant une grandeur positive, la constante ébullioscopique est positive. Ainsi l'ajout d'un soluté fait-il augmenter la température d'ébullition du solvant à pression constante (, soit ).
La loi de l'ébulliométrie a été établie expérimentalement, mais elle peut se démontrer théoriquement. Cette loi n'est valable que sous les hypothèses suivantes :
La loi de l'ébulliométrie est souvent exprimée en fonction de la molalité du soluté, qui représente la quantité de soluté pour 1 kg de solvant (en mol/kg) :
La constante ébullioscopique vaut alors :
avec la masse molaire du solvant (en g/mol). Sous cette forme, la constante ébullioscopique s'exprime en K·kg/mol, elle ne dépend toujours que des propriétés du solvant pur.
On note :
On a, par définition de la fraction molaire, pour le soluté :
Si la quantité de soluté est négligeable devant celle du solvant :
La masse de solvant est donnée par :
La molalité du soluté est donnée par définition par :
On a par conséquent le rapport :
La masse molaire étant exprimée le plus souvent en g/mol et la molalité en mol/kg, il est nécessaire d'introduire un facteur de conversion :
Si le soluté se dissocie dans la solution liquide, comme par exemple un sel se dissociant en ions, l'expression de la loi est modifiée par le facteur de van 't Hoff :
La constante , elle, n'est pas modifiée.

Pour un solvant pur au point d'ébullition, à sa température d'ébullition , on a l'égalité des potentiels chimiques des deux phases gaz et liquide :
avec :
On introduit, à pression constante, un soluté dans le solvant liquide. La température d'ébullition du solvant est modifiée et devient . Le potentiel chimique du solvant en phase liquide idéale s'écrit, avec la fraction molaire du solvant dans cette phase :
On considère qu'en phase gazeuse le solvant est le seul constituant. Au nouvel équilibre de phases on a toujours l'égalité des potentiels chimiques :
on a donc :
En soustrayant les termes de la relation (1) dans la relation (2) on a :
La relation de Gibbs-Duhem donne la variation du potentiel chimique du solvant pur à pression constante :
avec l'entropie molaire du solvant pur. On peut donc intégrer, en considérant une faible variation de température sur laquelle l'entropie molaire peut être considérée comme constante :
On peut par conséquent réécrire la relation (3) :
avec et les entropies molaires respectives du solvant pur gaz et liquide. En introduisant l'enthalpie de vaporisation du solvant :
Soit la fraction molaire du soluté. Puisque , alors par développement limité. Ainsi :
en considérant que on a :
On obtient finalement la loi de l'ébulliométrie :
L'ébulliométrie[3] est une technique permettant de déterminer la masse molaire d'un soluté.
On introduit une masse de soluté dans une masse de solvant, on mesure l'augmentation de la température d'évaporation du solvant.
On note :
La masse de soluté vaut :
La molalité du soluté vaut :
La température d'évaporation du solvant augmente de :
On peut en conséquence calculer la masse molaire du soluté selon :
La masse molaire du soluté, en g/mol, est obtenue selon :
Pour rappel, cette formule n'est valable que si la quantité de soluté est négligeable devant celle du solvant ().
Le tableau suivant donne les constantes ébullioscopiques de quelques solvants d'usage courant.
Note : un écart de température de 1 K étant égal à un écart de 1 °C, la constante ébullioscopique peut indifféremment s'exprimer en K·kg/mol ou en °C·kg/mol.
| Solvant | Constante ébullioscopique molale (K·kg/mol) |
Température de vaporisation (°C) |
|---|---|---|
| Acide acétique | 3,07[5] - 3,22[6] | 117,9 |
| Benzène | 2,53[5] - 2,64[6] | 80,1 |
| Disulfure de carbone | 2,37 | 46 |
| Tétrachlorure de carbone | 4,95 | 76,7 |
| Naphtalène | 5,8 | 217,96 |
| Phénol | 3,04[5] - 3,54[6] | 182 |
| Eau | 0,51 | 100 |
| Chloroforme | 3,63 | 62 |
| Cyclohexane | 2,92 | 80,75 |
| Éthanol | 1,22 | 78,5 |
| Nitrobenzène | 5,20 | 211 |

Lorsque l'on ajoute du sel à de l'eau, celle-ci, à pression atmosphérique, bout au-delà de 100 °C : une solution saturée en sel bout à 109 °C.
Seamless Wikipedia browsing. On steroids.