En chimie, un ligand non innocent (de l'anglais non-innocent ligand) est un ligand d'un complexe métallique, généralement un métal de transition, dont l'état d'oxydation ne peut être déterminé. Cette indétermination implique que l'on suppose, par mesure de simplification, que les réactions d'oxydoréduction dans les complexes métalliques sont localisées soit au niveau du métal soit au niveau du ligand[1]. Cette terminologie dérive de celle employée par C. K. Jørgensen en 1966, décrivant des ligands « innocents » et « suspects » selon qu'ils laissent l'état d'oxydation de l'atome central être déterminé[2]. Ces complexes ont généralement une activité oxydoréductrice à faible potentiel.
Réactions d'oxydoréduction de complexes de ligands innocents et non innocents
Résumé
Contexte
Par convention, on considère que les réactions d'oxydoréduction sur des complexes métalliques sont localisées sur le métal. La réduction de MnO4− en MnO42− est ainsi décrite comme un changement de l'état d'oxydation du manganèse de +7 à +6. L'état d'oxydation du ligand oxyde O2− demeure inchangé, valant -2. On dit que le ligand oxyde est innocent. [Co(NH3)6]3+ / [Co(NH3)6]2+ est un autre exemple de couple d'oxydoréduction à centre métallique : le ligand ammoniac NH3 est innocent dans cette transformation.

Conversion du [Ni(S2C2Ph2)2]2− en Ni(S2C2Ph2)2.
La réaction d'oxydoréduction a lieu sur les ligands et non sur l'ion métallique.
Le comportement rédox non innocent de certains ligands est illustré par le bis(stilbènedithiolate) de nickel [Ni(S2C2Ph2)2]z−. Comme pour tous les complexes bis(1,2-dithiolène) d'ions métalliques nd8, il est possible d'identifier trois d'états d'oxydation correspondant à z = 2, 1 et 0. Si les ligands sont toujours considérés dianioniques, comme on le fait pour évaluer l'état d'oxydation formel, alors z = 0 implique que l'état d'oxydation du nickel vaut +4. Cela signifie que l'état d'oxydation de l'atome de nickel central varie de +2 à +4 dans les transformations ci-dessus. Cependant, cet état d'oxydation formel diffère de l'état d'oxydation réel déduit par spectroscopie de la configuration de l'orbitale d de l'atome métallique, qui reste égal à +2. Le stilbène-1,2-dithiolate se comporte comme un ligand rédox non innocent, et le processus d'oxydoréduction se déroule en réalité sur les ligands plutôt que sur le métal. Cela conduit à la formation de complexes de ligands radicalaires. Le complexe neutre (z = 0), qui montre un caractère diradicalaire singulet partiel[3], est par conséquent mieux décrit comme un complexe du cation de nickel Ni2+ avec deux anions radicalaires S2C2Ph2• −. Le diamagnétisme de ce complexe provient du couplage antiferromagnétique entre les électrons célibataires des deux radicaux des ligands. Les états d'oxydation élevés des complexes de cuivre avec des ligands diamidophényle qui sont stabilisés par des liaisons hydrogène intramoléculaires à plusieurs centres sont un autre exemple de ligands non innocents[4].
Ligands non innocents typiques
- Le ligand nitrosyle –NO se lie aux métaux selon une géométrie coudée dans laquelle NO est traité comme l'ion pseudohalogénure NO− ou selon une géométrie linéaire dans laquelle NO est traité comme l'ion nitrosonium NO+ ;
- Le ligand dioxygène –O2 peut être non innocent dans la mesure où présente deux états d'oxydation, superoxyde O2− et peroxyde O22−[5].
- Les ligands ayant une délocalisation π étendue, comme les porphyrines, les phtalocyanines et les corroles[6], ainsi que les ligands de formule générale [D–CR=CR–D]n−, où D = O, NR’, avec R et R’ = alkyle ou aryle, sont souvent non innocents. En revanche, les ligands de la forme [D–CR=CR–CR=D]− tels que NacNac et acac sont innocents ;
- Les catécholates et les 1,2-dioxalènes apparentés[7] ;
- Les dithiolènes (en), tels que les maléonitriledithiolates (voir l'exemple du [Ni(S2C2Ph2)2]z− plus haut) ;
- Les 1,2-diimines (en), telles que les dérivés du 1,2-diamidobenzène, de la 2,2’-bipyridine et de la diméthylglyoxime. Le complexe Cr(2,2’-bipyridine)3 est un dérivé de Cr(III) lié à trois ligands [bipyridine]−. En revanche, l'oxydation à un électron de [Ru(2,2’-bipyridine)3]2+ fait intervenir le ruthénium et non le ligand, qui, dans ce cas, se comporte comme un ligand innocent habituel ;
- Les ligands contenant du ferrocène peuvent être oxydés sur le cation de fer du ferrocène plutôt que sur le centre métallique catalytique[8] ;
- Les ligands pyridine-2,6-diimine (en) peuvent être réduits par un ou deux électrons[9],[10] :
Ligands non innocents en biologie et en catalyse homogène
Résumé
Contexte
La plupart des réactions biologiques font intervenir des systèmes innocents, comme les centres [4Fe-4S], mais certains processus enzymatiques font intervenir des cofacteurs non innocents qui apportent aux métalloenzymes le complément rédox nécessaire à leur activité. Les équivalents rédox supplémentaires apportés par ces ligands non innocents permettent également de contrôler la catalyse homogène[11],[12],[13].
Les porphyrines peuvent être des ligands innocents (-2) ou non innocents (-1). Une porphyrine non innocente assure ainsi l'oxydation pendant le cycle catalytique de la chloroperoxydase et du cytochrome P450, notamment dans la formation du composé I. En revanche, dans d'autres protéines héminiques telles que la myoglobine, il n'y a pas de réaction d'oxydoréduction sur le ligand, de sorte que la porphyrine de ces protéines est innocente.
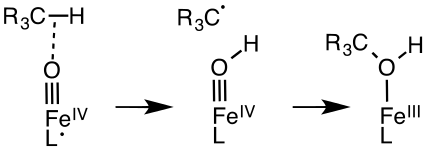
Le cycle catalytique de la galactose oxydase (en) fait intervenir des ligands non innocents[14],[15]. La galactose oxydase convertit les alcools primaires en aldéhydes à l'aide d'oxygène O2 en formant du peroxyde d'hydrogène H2O2. Le site actif de cette enzyme présente un résidu de tyrosine coordonné à un cation de cuivre Cu2+. À l'étape clé du cycle catalytique, l'alcool est déprotoné par une base de Brønsted puis l'atome d'oxygène du radical tyrosinyle soustrait un atome d'hydrogène du carbone alpha du substrat alcoolate coordonné. Le radical tyrosinyle participe au cycle catalytique : une oxydation à un électron est réalisée par le couple Cu(II/I) et une autre par le radical tyrosinyle lui-même, soit un total de deux électrons. Un couplage antiferromagnétique entre spins non appariés du radical tyrosinyle et de l'orbitale 3d9 du centre Cu(II) donne un état fondamental diamagnétique, cohérent avec les modèles[16].
Notes et références
Bibliographie
Wikiwand - on
Seamless Wikipedia browsing. On steroids.