Enzyme de conversion de l'angiotensine 2
gène de l'espèce Homo sapiens De Wikipédia, l'encyclopédie libre
L'enzyme de conversion de l'angiotensine 2, ou ACE2 (de l'anglais Angiotensin-Converting Enzyme 2), est une enzyme liée à la face externe des membranes plasmiques de cellules du poumon, des artères, du cœur, du rein et de l'appareil digestif[3],[4],[5]. Elle joue un rôle important dans le système rénine-angiotensine-aldostérone (SRAA), qui joue un rôle physiologique majeur pour la régulation du coeur, du rein et de la pression sanguine[6],[7],[8],[9], qui régule l'homéostasie hydrosodée et la pression artérielle.
| Enzyme de conversion de l'angiotensine 2 | ||
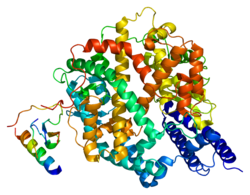 Enzyme de conversion de l'angiotensine 2 humaine (PDB 1R42[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Angiotensin I Converting Enzyme 2 | |
| Symbole | ACE2 | |
| Synonymes | ACEH | |
| N° EC | 3.4.17.23 | |
| Homo sapiens | ||
| Locus | Xp22.2 | |
| Masse moléculaire | 92 463 Da[2] | |
| Nombre de résidus | 805 acides aminés[2] | |
| Entrez | 59272 | |
| HUGO | 13557 | |
| OMIM | 300335 | |
| UniProt | Q9BYF1 | |
| RefSeq (ARNm) | NM_021804.2 | |
| RefSeq (protéine) | NP_068576.1 | |
| Ensembl | ENSG00000130234 | |
| PDB | 1R42, 1R4L, 1XJP, 2AJF, 3D0G, 3D0H, 3D0I, 3KBH, 3SCI, 3SCJ, 3SCK, 3SCL, 6ACG, 6ACJ, 6ACK, 6CS2 | |
|
GENATLAS • GeneTests • GoPubmed • HCOP • H-InvDB • Treefam • Vega | ||
| Liens accessibles depuis GeneCards et HUGO. | ||
Il s'agit d'une métallocarboxypeptidase (en) transmembranaire qui catalyse le clivage de l'angiotensine I 1–10 en angiotensine 1–9[4] et de l'angiotensine II 1–8, peptide induisant une vasoconstriction, en angiotensine 1–7, peptide induisant une vasodilatation[10],[11]. Elle s'oppose à l'action de l'enzyme de conversion de l'angiotensine (ACE), qui catalyse la conversion de l'angiotensine I en angiotensine II, de sorte que l'ACE2 réduit la concentration en angiotensine II[12] ; celle-ci agissant comme vasoconstricteur, cela fait de l'ACE2 une cible intéressante pour le traitement des maladies cardiovasculaires[12],[13].
L'ACE2 est le récepteur de certains coronavirus à la membrane plasmique des cellules. C'est le cas pour le coronavirus humain NL63, le SARS-CoV-1, coronavirus à l'origine du SRAS, et le SARS-CoV-2, à l'origine de la COVID-19[14],[15],[16],[17]. Plusieurs types de cellules humaines sont dotées d'ACE2, de même pour d'autres mammifères, dont – à titre d'exemple – le chat, le chien, le pangolin, le vison, le Hamster de Chine et d'autres rongeurs du groupe des Cricetidae[18],[19],[20],[21].
Le gène
L'enzyme de conversion de l'angiotensine 2 est codée par le gène ACE2 (angiotensin-converting enzyme 2), identifié en 2000[4]. Il est situé sur le chromosome X humain.
La protéine
Résumé
Contexte
Il s'agit d'une métalloprotéinase (métalloexopeptidase). Elle est présente principalement dans les cellules endothéliales vasculaires du cœur et intervient dans la fonction cardiaque. Elle est également exprimée dans le rein et dans les testicules[4]. Elle est donc moins ubiquitaire que son homologue, l'enzyme de conversion de l'angiotensine, renommée enzyme de conversion de l'angiotensine 1 (ACE1) depuis la découverte de l'ACE2.
La structure secondaire de l'ACE2 contient 20 hélices α et 9 hélices 310 qui totalisent environ 62 % de la structure. Elle contient également 6 feuillets β qui totalisent 3,5 % supplémentaires. La région extracellulaire de l'ACE2 humaine contient deux domaines : le domaine métallopeptidase à zinc et le domaine d'homologie aux collectines C-terminal, qui est désordonné ; le domaine métallopeptidase à zinc peut lui-même être divisé en deux sous-domaines, notés I et II, qui entourent le site actif, dont le sous-domaine I, du côté N-terminal, contient le cation de zinc Zn2+.
- Structure d'une ACE2 humaine montrant les sous-domaines I en rouge et II en bleu du domaine métallopeptidase à zinc ainsi que le début du domaine d'homologie aux collectines C-terminal en vert (PDB 1R42[1]).
- Site actif d'une ACE2 humaine avec le motif HEXXH + E montrant le cation de zinc Zn2+ en rouge coordonné aux résidus His374, His378 et Glu402, ainsi qu'à une molécule d'eau (en bleu).
Le cation de zinc Zn2+, qui intervient comme cofacteur dans le site actif de l'enzyme, est coordonné aux résidus His374, His378, Glu402 et à une molécule d'eau H2O (à l'état natif). Ces résidus forment la séquence HEXXH + E, où H = histidine, E = glutamate et X = acide aminé indéterminé ; ce motif est conservé dans les métallopeptidases à zinc. L'anion chlorure Cl– est coordonné aux résidus Arg169, Trp477 et Lys481 du côté C-terminal[1].
Rôle
Résumé
Contexte
Enzyme de conversion de l'angiotensine 2
| N° EC | EC |
|---|---|
| Cofacteur(s) | Zn2+[22] |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
L'ACE1 convertit l'angiotensine I (décapeptide) en angiotensine II (octapeptide) par clivage des deux résidus d'acides aminés C-terminaux :
L'ACE2 convertit l'angiotensine I 1-10 (décapeptide) en angiotensine 1-9 (nonapeptide) et l'angiotensine II 1-8 (octapeptide induisant une vasoconstriction) en angiotensine 1-7 (heptapeptide ayant des propriétés vasodilatatrices)[5],[23],[24] :
L'effet de l'ACE2 est antagoniste à celui de l'ACE1, en déplaçant l'équilibre de production depuis l'angiotensine I vers angiotensine 1-7, ce qui correspond fonctionnellement à un mécanisme de clairance de l'angiotensine II[25]. L'angiotensine 1-7 est un vasodilatateur qui antagonise les effets de l'angiotensine II en interagissant avec un récepteur couplé à une protéine G, l'oncogène Mas[26].
L’homéostasie du muscle cardiaque serait en partie sous la dépendance de l’expression de l’angiotensine II et de l’angiotensine 1-7. Alors que l’inactivation de l’ACE chez la souris induit une hypertension, celle de l’ACE2 entraîne des anomalies cardiaques : dilatation ventriculaire gauche, amincissement des parois et surtout hypocontractilité ventriculaire gauche[27]. Cependant, ceci n'a pas été retrouvé dans d'autres études qui montrent une fonction cardiaque normale de base[28], mais une augmentation de l'hypertrophie des parois de cardiaque en cas de surcharge de pression[29].
Le rôle de l'ACE2 dans le rein semble également essentiel[30]. Elle serait principalement localisée au niveau du tubule rénal. Les effets d'un antagoniste de l'ACE2, le MLN-4760, commencent à être évalués chez l'animal[31].
Régulation
Résumé
Contexte
Contrairement à l'ACE1, l'ACE2 est insensible aux inhibiteurs de l'enzyme de conversion[32]. Son expression s'élève en cas d'insuffisance cardiaque[33].
On a constaté que l'exercice physique, s'il est chronique, peut être l'un des stimuli importants de l'ACE2 dans le cerveau et sa périphérie[34],[35]. On a constaté en 2020 que « cependant, si l'exercice est clairement associé à de meilleurs résultats cardiovasculaires dans des situations chroniques, l'exercice peut contribuer à un plus grand risque d'infection par le SARS-CoV-2 ». Ainsi Keidar et al. avaient déjà rapporté en 2005 que l'antagoniste des minéralocorticoïdes, la spironolactone, avait quadruplé l'activité ACE2 dans les macrophages dérivés de monocytes de patients atteints de CHF[36] ; mais la spironolactone n'augmente pas significativement l'ACE2 cardiaque dans la CHF expérimentale[37]. Des études expérimentales montrent que les statines bloquent le SRAA, mais augmentent aussi l'expression de l'ACE2 selon Tikoo et al. la protéine ACE2 est environ deux fois plus présente dans le cœur et les reins de lapins athérosclérotiques traités à l'atorvastatine, en lien avec des modifications épigénétiques du gène ACE2[38].
Récepteur de certains coronavirus
Résumé
Contexte

L'ACE2 humaine se lie à l'enveloppe du coronavirus SARS-CoV, responsable du SRAS, à travers la glycoprotéine S du virus[40], qui forme un péplomère à sa surface. Cette protéine est ensuite clivée par une endopeptidase, la cathepsine L, lors du transit vers les endosomes[41] de sorte que le virus pénètre dans la cellule hôte par une endocytose dépendante du pH mais indépendante de la clathrine et des cavéoles[42]. Ce coronavirus dispose également d'une autre possibilité d'entrer dans la cellule par activation de la glycoprotéine S par la protéase transmembranaire à sérine 2 (TMPRSS2) conduisant à la fusion des membranes[43].
La glycoprotéine S du SARS-CoV est composée de deux sous-unités. La sous-unité S1 contient le domaine de liaison au récepteur, noté RBD (pour receptor-binding domain), susceptible de se lier à l'ACE2. Cette liaison provoque des changements conformationnels dans la sous-unité S2 qui facilitent la fusion de l'enveloppe virale avec la membrane plasmique de la cellule hôte[44]. Les résidus d'acides aminés 424 à 494 du domaine de liaison au récepteur forment le motif de liaison au récepteur, noté RBM (pour receptor-binding motif). Parmi les 14 résidus du RBM qui sont en contact direct avec l'ACE2 figurent six résidus de tyrosine qui participent à la reconnaissance spécifique de l'ACE2. Des résidus de cystéine participent également à cette reconnaissance en formant des ponts disulfure.
Les résidus Asn479 et Thr487 du RBM ont une influence sur l'évolution de la maladie du SRAS ainsi que du tropisme du virus SARS-CoV. Le résidu Asn479 est présent dans la plupart des séquences de glycoprotéines S de virus SARS-CoV retrouvés chez l'homme. Toute mutation affectant les résidus 479 et 487 du RBD est susceptible d'induire un changement dans le mode de transmission zoonotique ou interhumaine du SARS-CoV[39],[45].
Le domaine de liaison au récepteur du virus SARS-CoV de civette masquée présente un résidu de lysine en position 479 qui induit un encombrement stérique et des interférences électrostatiques avec des résidus de l'hélice N-terminale de l'ACE2 humaine, notamment l'His34. Une mutation Lys479 → Asn479 réduit ces blocages et accroît l'affinité entre le RBD de la glycoprotéine S virale et l'ACE2 humaine, ce qui permet une transmission zoonotique. De plus, les ponts salins formé en environnement hydrophobe entre les résidus Lys31 et Glu35 de l'ACE2 humaine ont pour effet de renforcer les interactions de cette dernière avec la glycoprotéine S du virus SARS-CoV. Le résidu Thr487 augmente également l'affinité entre le RBD viral et l'ACE2 humaine. Le groupe méthyle γ de ce résidu de thréonine assure le positionnement du résidu Lys353 de l'ACE2 de telle sorte qu'il forme un pont salin avec le résidu Asp38, ce qui pourrait favoriser la transmission interhumaine du virus[46],[47].
Un mécanisme semblable a été observé pour le coronavirus SARS-CoV-2[48], responsable du COVID-19. La protéine ACE2 interagit avec la protéine B0AT1/SLC6A19 qui la stabilise sur la membrane plasmique en formant un dimère d'hétérodimères[49], le domaine d'homologie aux collectines de l'ACE2 favorisant la dimérisation. ACE2 joue en outre le rôle de protéine chaperon pour B0AT[50].
Notes et références
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


