Cétène (molécule)
composé chimique De Wikipédia, l'encyclopédie libre
Le cétène est un gaz toxique de formule semi-développée H2C=C=O, instable dans les conditions normales de température et de pression. Son tautomère est l'éthynol.
| Cétène (molécule) | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | éthènone | |
| Synonymes |
carbométhène |
|
| No CAS | ||
| No ECHA | 100.006.671 | |
| No CE | 207-336-9 | |
| PubChem | 10038 | |
| ChEBI | 48003 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C2H2O [Isomères] |
|
| Masse molaire[1] | 42,036 7 ± 0,002 g/mol C 57,14 %, H 4,8 %, O 38,06 %, |
|
| Moment dipolaire | 1,422 15 D [2] | |
| Propriétés physiques | ||
| T° fusion | −150 °C [3] | |
| T° ébullition | −49 °C [3] | |
| Limites d’explosivité dans l’air | 5,5 - 18 Vol%[4]. | |
| Point critique | 65,0 bar, 106,85 °C [5] | |
| Thermochimie | ||
| ΔfH0gaz | −87,24 kJ·mol-1 [6] | |
| ΔvapH° | 20,4 kJ·mol-1 [6] | |
| Cp | 51,75 J·K-1·mol-1 (gaz,25 °C) [6]
|
|
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 9,617 ± 0,003 eV (gaz)[8] | |
| Précautions | ||
| SIMDUT[9] | ||
  D1A, F, |
||
| NFPA 704[10] | ||
| Écotoxicologie | ||
| DL50 | 1,3 g·kg-1 (rat, oral) [9] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier | ||
Propriétés physico-chimiques
Le cétène est un agent d'acétylation très puissant[3].

Utilisation
Résumé
Contexte
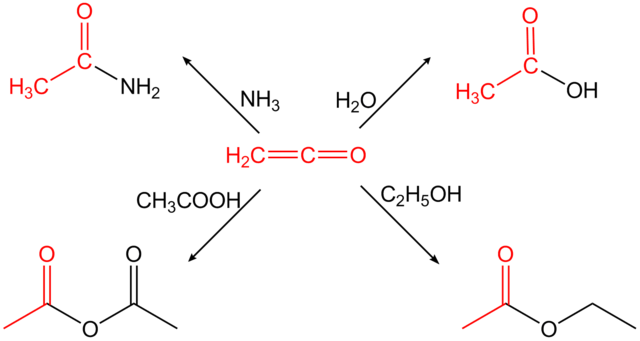
- Production de l'anhydride acétique
La majeure partie de la production du cétène est utilisée pour la production de l'anhydride acétique. Toutefois ce procédé est concurrencé par la carbonylation de l'acétate de méthyle[3].
- Production du dicétène
La seconde utilisation du cétène est la production du dicétène par dimérisation contrôlée[3].
- Production de l'acide sorbique
La réaction du cétène avec le crotonaldéhyde produit le bêta-lactone ou du polyester. Ces derniers sont ensuite convertis par voie thermique ou par voie catalytique en acide sorbique[3].

Production et synthèse
La principale voie de synthèse du cétène est la pyrolyse de l'acide acétique. Ce dernier est évaporé et chauffé à une température de 740 à 760 °C, puis du phosphate de triéthyle est ajouté comme catalyseur ainsi que de l'ammoniaque. L'ammoniaque empêche la recombinaison de l'eau et du cétène. Le mélange est ensuite refroidi à moins de 100 °C pour condenser l'eau et l'acide acétique n'ayant pas réagi, le cétène est alors absorbé dans un liquide de conditionnement ou récupéré sous forme de dicétène via une pompe à vide[3].

Notes et références
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





