Acétate de méthyle
composé chimique De Wikipédia, l'encyclopédie libre
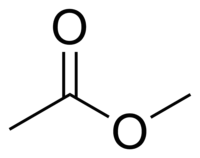
L'acétate de méthyle ou éthanoate de méthyle en nomenclature systématique, également connu comme l'ester méthylique de l'acide acétique parfois confondu avec l'acétone, est un liquide clair, très inflammable, à l'odeur agréable caractéristique de certaines colles et dissolvants pour vernis à ongles. L'acétate de méthyle a des caractéristiques très similaires à celles de l'acétate d'éthyle. L'acétate de méthyle est utilisé comme solvant dans des colles, peintures et nettoyants de vernis à ongles, en synthèse organique et pour des extractions. Il est très faiblement polaire (lipophile) et aprotique, il est assez soluble dans l'eau à température élevée. Il s'hydrolyse, spécialement à température élevée, en méthanol et en acide acétique en présence d'acides forts aqueux ou en acétate en présence d'une base forte aqueuse. Sa présence dans le milieu interstellaire a été détectée par spectroscopie en 2013[13].
| Acétate de méthyle | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | éthanoate de méthyle | ||
| No CAS | |||
| No ECHA | 100.001.078 | ||
| No CE | 201-185-2 | ||
| No RTECS | AI9100000 | ||
| PubChem | 6584 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C3H6O2 [Isomères] |
||
| Masse molaire[1] | 74,078 5 ± 0,003 4 g/mol C 48,64 %, H 8,16 %, O 43,2 %, |
||
| Moment dipolaire | 1,72 ± 0,09 D [2] | ||
| Diamètre moléculaire | 0,497 nm [3] | ||
| Propriétés physiques | |||
| T° fusion | −98 °C[4] | ||
| T° ébullition | 57-58 °C[4] | ||
| Paramètre de solubilité δ | 19,6 MPa1/2 (25 °C)[5]; 19,3 J1/2·cm-3/2 (25 °C)[3] |
||
| Masse volumique | 0,932 g·cm-3 à 25 °C[4] | ||
| T° d'auto-inflammation | 502,2 °C[4] | ||
| Point d’éclair | −13 °C[4] | ||
| Pression de vapeur saturante | 165 mmHg à 20 °C[4] | ||
| Point critique | 233,45 °C, 4,75 MPa, 0,331 l·mol-1[6] | ||
| Thermochimie | |||
| Cp | |||
| PCS | 1 592,2 kJ·mol-1[8] (liquide) | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,25 ± 0,02 eV (gaz)[9] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,359 3 [10] | ||
| Précautions | |||
| SGH | |||
| H225, H319, H336 et EUH066 |
|||
| NFPA 704 | |||
| Directive 67/548/EEC | |||
| [4] | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| LogP | 0,05[12] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier | |||
Synthèse
L'acétate de méthyle est synthétisé à partir d'acide acétique et de méthanol en présence d'un acide fort comme l'acide sulfurique dans une réaction d'estérification. La conversion de l'acétate de méthyle en ses composants, par hydrolyse acide, est une réaction du premier ordre vis-à-vis de l'ester tandis que la même hydrolyse en milieu basique est une réaction du second ordre vis-à-vis de l'ester et de la base.
Usage
L'anhydride acétique est produit par carbonylation d'acétate de méthyle avec un protocole inspiré du procédé Monsanto[14].
Métabolisme et toxicité
Après absorption orale, l'acétate de méthyle est décomposé partiellement dans l'estomac en méthanol et acide acétique par des estérases de la muqueuse gastrique. Une exposition élevée aboutit à retrouver l'acétate de méthyle dans le sang[15]. La demi-vie dans le sang est de 4 heures[16].
Sources "naturelles"
L'acétate de méthyle est aussi un composé volatile rencontré dans les plantes :
- Jus de raisin frais : 0,026 ppm(1)[17]
- Graines ensilées : 0.29 à 6.15 nL/L[18]
- Amandes avec coque : 0.10 nL/L[18]
- Fleurs de Kiwi (Actinidia chinensis) : 0.57%[19]
- Et aussi : Menthe (Water Mint, Crested Latesummer Mint), Ananas, Artemisia (Annual Mugwort), Papaye, Fleur de tournesol, Pommier, Pêche, Huile essentielle de gingembre[20].
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.










