Loading AI tools
composé chimique De Wikipédia, l'encyclopédie libre
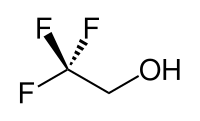
Le 2,2,2-trifluoroéthanol est un composé organique halogéné, portant une fonction alcool et de formule semi-développée CF3CH2OH. Aussi connu sous les noms TFE ou alcool trifluoroéthylique, ce liquide incolore miscible avec l'eau a une odeur rappelant celle de l'éthanol. En raison de l'électronégativité du groupe trifluorométhyle, cet alcool a un caractère acide plus marqué que l'éthanol. Ainsi, le TFE forme des complexes stables aussi avec des hétérocycles comme le THF ou la pyridine, en établissant des liaisons hydrogène.
| 2,2,2-Trifluoroéthanol | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 2,2,2-trifluoroéthanol | ||
| Synonymes |
fluorinol 85 |
||
| No CAS | |||
| No ECHA | 100.000.831 | ||
| No CE | 200-913-6 | ||
| No RTECS | KM5250000 | ||
| PubChem | 6409 | ||
| ChEBI | 42330 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore | ||
| Propriétés chimiques | |||
| Formule | C2H3F3O [Isomères] |
||
| Masse molaire[1] | 100,039 8 ± 0,002 1 g/mol C 24,01 %, H 3,02 %, F 56,97 %, O 15,99 %, |
||
| pKa | 12,37 à 25 °C[2] | ||
| Propriétés physiques | |||
| T° fusion | −44 °C[3] |
||
| T° ébullition | 77–80 °C[3] |
||
| Paramètre de solubilité δ | 23,9 J1/2·cm-3/2 (25 °C)[5] | ||
| Miscibilité | miscible dans l'eau et l'éthanol | ||
| Masse volumique | 1,373 g·cm-3 à 25 °C[3] | ||
| T° d'auto-inflammation | ~480 °C[3] | ||
| Point d’éclair | 29 °C[3] | ||
| Pression de vapeur saturante | 70 mmHg à 25 °C[3] 71,3 mmHg à 25 °C[2] |
||
| Propriétés optiques | |||
| Indice de réfraction | = 1,3[3] | ||
| Précautions | |||
| NFPA 704 | |||
| Directive 67/548/EEC[3] | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 1 680 mg·kg-1 (rat, s.c.)[2] 0,39 ml·kg-1 (lapin, s.c.)[2] 366 mg·kg-1 (souris, oral)[2] 240 mg·kg-1 (rat, oral)[2] 250 mg·kg-1 (souris, i.v.)[2] 158 mg·kg-1 (souris, i.p.)[2] 210 mg·kg-1 (rat, i.p.)[2] |
||
| CL50 | 2900 mg/m3/2H (souris, inhalation)[2] 470 ppm/6H (rat, inhalation)[2] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le trifluoroéthanol est produit industriellement par hydrogénation ou par réduction grâce à un hydrure, de dérivés de l'acide trifluoroacétique comme des esters ou son chlorure d'acyle[6].
Il peut être aussi préparé par hydrogénolyse de composés diol ou hémicétal de formule générale CF3−CHOH−OR (où R est un atome d'hydrogène (diol) ou un groupe alkyle contenant de un à huit atomes de carbone (hémicétal)) en présence d'un catalyseur au palladium déposé sur charbon actif et, en tant que co-catalyseur, d'amines tertiaires aliphatiques comme la triéthylamine.
Le trifluoroéthanol est utilisé comme solvant en chimie organique[7],[8]. L'oxydation de composés sulfurés avec le peroxyde d'hydrogène est effectivement conduite dans le TFE[9]. Il sert également de source du groupe trifluoroéthyle dans diverses réactions chimiques[10].
En biologie, le trifluoroéthanol est utilisé comme co-solvant dans les études du repliement des protéines par spectroscopie RMN : il peut effectivement solubiliser peptides et protéines. En fonction de sa concentration, le trifluoroéthanol peut fortement affecter la structure tridimensionnelle des protéines.
Le 2,2,2-trifluoro-1-vinyloxyéthane, un médicament qui s'inhale, présenté cliniquement sous le nom commercial Fluromar, est l'éther vinylique du trifluoréthanol. Cette molécule est préparée par la réaction de trifluoroéthanol avec l'acétylène[6].
Dans l'industrie, le trifluoroéthanol est employé comme solvant du nylon ainsi que dans des applications du domaine pharmaceutique.
L'oxydation du trifluoroéthanol produit du trifluoroacétaldéhyde et de l'acide trifluoroacétique.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.