Loading AI tools
science étudiant les molécules du vivant De Wikipédia, l'encyclopédie libre
La biologie moléculaire (parfois abrégée bio. mol.) est une discipline scientifique de la vie au croisement de la génétique, de la biochimie métabolique et de la physique, dont l'objet est la compréhension des mécanismes de fonctionnement de la cellule au niveau moléculaire. Le terme « biologie moléculaire », utilisé la première fois en 1938 par Warren Weaver, désigne également l'ensemble des techniques de manipulation d'acides nucléiques (ADN, ARN), appelées aussi techniques de génie génétique.
La biologie moléculaire est apparue au XXe siècle, à la suite de l'élaboration des lois de la génomique, transcriptomique, protéomique, métabolomique) de la biologie moléculaire pour étudier plus spécifiquement les cellules des micro-organismes[1].
La biologie moléculaire est apparue dans les années 1930, le terme n'ayant cependant été inventé qu'en 1938 par Warren Weaver. Warren Weaver était à l'époque directeur des Sciences Naturelles pour la Fondation Rockefeller et pensait que la biologie était sur le point de vivre une période de changements significatifs étant donné les avancées récentes dans les domaines tels que la diffractométrie de rayons X. Il a donc investi des sommes importantes provenant de l'Institut Rockefeller dans les domaines biologiques. Après la découverte de la structure en double hélice de l'ADN en 1953 par James Watson (1928-), Francis Crick (1916-2004), Maurice Wilkins (1916-2004) et Rosalind Franklin (1920-1958), la biologie moléculaire a connu d'importants développements pour devenir un outil incontournable de la biologie moderne à partir des années 1970[réf. nécessaire].
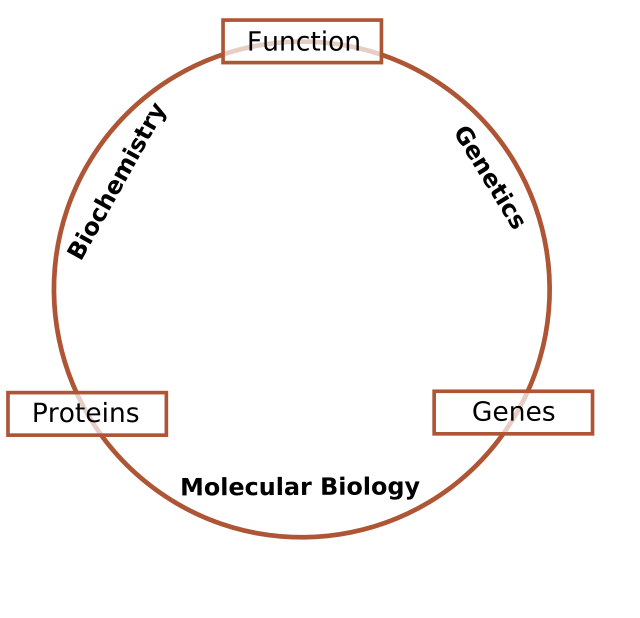
Les chercheurs en biologie moléculaire utilisent des techniques spécifiques pour la biologie moléculaire (voir plus loin Techniques de biologie moléculaire), mais les combinent de plus en plus avec les techniques et les idées provenant de la génétique et de la biochimie. Il n'y a pas de frontière bien définie entre ces disciplines, bien qu'il y en ait eu à une certaine époque. La figure ci-contre illustre une vue possible de la relation entre les domaines[réf. nécessaire] :
L'essentiel du travail en biologie moléculaire est quantitatif, et récemment beaucoup de travaux ont été faits à l'intersection de la biologie moléculaire et de l'informatique, dans la bio-informatique et dans la biologie calculatoire. Depuis les années 2000, l'étude de la structure et de la fonction des gènes, la génétique moléculaire, fait partie des sous-domaines les plus saillants de la biologie moléculaire. De plus en plus d'autres domaines de la biologie se concentrent sur les molécules, soit directement, en étudiant leurs interactions propres comme en biologie cellulaire et en biologie du développement, soit indirectement, quand les techniques de la biologie moléculaire sont utilisées pour déduire les attributs historiques des populations ou des espèces, comme dans les domaines de la biologie de l'évolution telles que la génétique des populations et la phylogénie. Il y a également une longue tradition d'étude des biomolécules « à partir du bas » en biophysique[réf. nécessaire].
Depuis la fin des années 1950 et le début des années 1960, les biologistes moléculaires ont appris à caractériser, isoler et manipuler les composants moléculaires des cellules et des organismes. Ces composants incluent l'ADN, support de l'information génétique, l'ARN, proche de l'ADN dont les fonctions vont de la copie provisoire d'ADN jusqu'aux réelles fonctions structurelles et enzymatiques et qui est une partie fonctionnelle et structurelle de l'appareil traductionnel, et les protéines, molécules structurelles et enzymatiques les plus importantes des cellules.[réf. nécessaire]

Une des techniques les plus élémentaires en biologie moléculaire pour étudier le rôle des protéines est le clonage d'expressions. Dans cette technique, l'ADN codant la protéine qui nous intéresse est cloné en utilisant la réaction en chaîne par polymérase (PCR en anglais pour Polymerase Chain Reaction) et/ou des enzymes de restriction dans un plasmide (qu'on appelle vecteur d'expression). Ce plasmide peut avoir des éléments de séquences promotrices spéciales pour diriger la production de la protéine en question et peut aussi avoir des marqueurs de résistance antibiotique pour aider à suivre le plasmide.Ce plasmide peut être inséré dans des cellules, soit de bactérie, soit d'animal. Introduire de l'ADN dans des cellules bactériennes est appelé transformation, et cela peut être complété de plusieurs manières : électroporation, micro-injection, consommation passive et conjugaison. Introduire de l'ADN dans des cellules d'eucaryotes, telles que des cellules animales, est appelé transfection. Plusieurs techniques différentes de transfection sont disponibles : transfection calcium phosphate, transfection de liposomes ou lipofection, électroporation ou encore par réactifs de transfection propriétaires tels que le Fugene ou le Genecellin. L'ADN peut alors être introduit dans les cellules en utilisant des virus ou des bactéries pathogènes comme transporteurs. Dans de tels cas, la technique est appelée transduction virale/bactérienne, et les cellules sont dites transduites[réf. nécessaire].
Dans les deux cas, le codage ADN pour la protéine qui nous intéresse est maintenant à l'intérieur d'une cellule, et la protéine peut désormais s'exprimer. Une variété de systèmes, tels que des promoteurs inductibles et des facteurs spécifiques signalant les cellules, sont disponibles pour aider la protéine qui nous intéresse à s'exprimer à haut niveau. De grandes quantités de protéines peuvent alors être extraites de la cellule bactérienne ou eucaryote. La protéine peut être testée pour connaître son activité enzymatique dans une variété de situations, elle peut être cristallisée pour qu'on puisse étudier sa structure tertiaire, ou, dans l'industrie pharmaceutique, on peut étudier l'activité de nouveaux médicaments sur la protéine en question[réf. nécessaire].
La réaction en chaîne par polymérase (PCR en anglais, pour Polymerase Chain Reaction) est une technique extrêmement flexible de copie d'ADN. En gros, la PCR permet à une simple séquence d'ADN d'être copiée des millions de fois, ou d'être altérée par des moyens prédéterminés. Par exemple, la PCR peut être utilisée pour introduire des sites d'enzymes de restriction, ou pour muter (changer) des bases particulières de l'ADN. La PCR peut aussi être utilisée pour déterminer si un fragment particulier d'ADN se trouve dans une bibliothèque d'ADN complémentaires. La PCR a de nombreuses variations, comme la PCR à transcription inversée (RT-PCR en anglais pour Reverse Transcription Polymerase Chain Reaction) pour l'amplification de l'ARN, et, plus récemment, la PCR temps réel (qPCR) qui permet des mesures quantitatives de molécules d'ADN et d'ARN[réf. nécessaire].
L'électrophorèse est un des principaux outils de biologie moléculaire. Le principe de base est que l'ADN, l'ARN et les protéines peuvent être séparées par des champs électriques. Dans l'électrophorèse en gel d'agarose, l'ADN et l'ARN peuvent être séparés en fonction de leur taille en faisant circuler l'ADN à travers un gel d'agarose. Les protéines peuvent être séparées en fonction de leur poids en utilisant un gel SDS-PAGE. Les protéines peuvent aussi être séparées par leur charge électrique, en utilisant ce qu'on appelle un gel isoélectrique.

Nommé ainsi d'après le nom de son inventeur, le biologiste Edwin Southern, le Southern blot est une méthode pour sonder la présence d'une séquence précise d'ADN à l'intérieur d'un échantillon d'ADN. Des échantillons d'ADN avant ou après digestion par une enzyme de restriction sont séparés par électrophorèse et transférés sur une membrane par marquage via action capillaire. La membrane peut alors être testée en utilisant une sonde ADN marquée avec un complément de la séquence en question. À l'origine, la plupart des protocoles utilisaient des marqueurs radioactifs ; cependant, maintenant, il existe des possibilités de marquages non radioactifs. Le Southern blot est utilisé moins souvent dans les laboratoires, du fait que la PCR permet déjà de détecter des séquences ADN spécifiques à partir d'échantillons d'ADN. Cependant, ces marquages sont encore utilisés pour certaines applications, telles que la mesure du nombre de copies transgéniques dans les souris transgéniques, ou dans l'ingénierie de lignes de cellules souches embryonnaires à gènes invalidés[réf. nécessaire].
Le northern blot est utilisé pour étudier les modèles d'expression d'un type spécifique de molécule d'ARN en comparaison relative avec un ensemble de différents échantillons d'ARN. C'est essentiellement une combinaison d'une dénaturation d'électrophorèse d'ARN, et d'un blot. Dans ce processus, l'ARN est séparé en fonction de la taille, puis est transféré sur une membrane qui est alors sondée avec un complément marqué pour la séquence intéressante. Les résultats peuvent être visualisés d'une variété de façons selon le marquage utilisé ; cependant, la plupart conduisent à une révélation de bandes représentant la taille de l'ARN détecté dans l'échantillon. L'intensité de ces bandes est liée à la quantité d'ARN ciblé dans les échantillons analysés. Le procédé est utilisé généralement pour étudier quand et combien d'expressions de gènes se produisent en mesurant la quantité de cet ARN présent dans les différents échantillons. C'est un des outils les plus fondamentaux pour déterminer quand certains gènes s'expriment dans les tissus vivants[réf. nécessaire].

Séparation des protéines par électrophorèse SDS-PAGE uniquement en fonction de leur poids (le SDS, ou sodium dodécylsulfate, dénature les structures tertiaire et quaternaire des protéines et les charge toutes négativement), puis transfert des protéines séparées sur membrane pour les rendre accessibles à divers marquages immunologiques ou autres.Les anticorps pour la plupart des protéines peuvent être créés par injection de petites quantités de protéine cible dans les animaux tels que la souris, le lapin, le mouton ou l'âne (anticorps polyclonaux) ou produits dans une culture de cellules (anticorps monoclonaux). Ces anticorps peuvent être utilisés dans une variété de techniques analytiques et préparatives[réf. nécessaire].
Dans le western blot (immunobuvardage), les protéines sont d'abord séparées en fonction de leur poids, dans un gel fin pris entre deux plaques de verre par une technique qu'on appelle SDS-PAGE (pour Sodium Dodecyl Sulphate Poly-Acrylamide Gel Electrophoresis). Les protéines dans le gel sont alors transférées sur un PVDF, nitrocellulose, nylon ou autre membrane de support. Cette membrane peut alors être sondée avec des solutions d'anticorps. Les anticorps qui s'attachent spécifiquement à la protéine en question peuvent alors être visualisés selon une variété de techniques, dont la colorimétrie, la chimiluminescence ou l'autoradiographie. Des méthodes analogues de western blot peuvent aussi être utilisées pour marquer directement des protéines spécifiques dans des cellules et des sections de tissus. Cependant, ces méthodes de marquages immunologiques sont plutôt associées à la biologie cellulaire qu'à la biologie moléculaire[réf. nécessaire].
Les termes western et northern sont des jeux de mots : les premiers blots étaient sur l'ADN, et comme ils ont été faits par Edwin Southern, ils ont pris le nom de Southern (southern veut dire « du sud » en anglais ; tandis que western signifie « de l'ouest » et northern, « du nord »). Il est peu probable que Patricia Thomas, inventrice du blot ARN, qui est devenu le northern blot, utilise vraiment ce terme[3]. Pour pousser la plaisanterie plus loin, on peut trouver, dans la littérature , des références vers des south-westerns (« du sud-ouest ») (interactions protéine-ADN) et des far-westerns (du « far-ouest ») (interactions protéine-protéine)[réf. nécessaire].
Une puce à ADN, aussi appelée microarray, est une collection de milliers de puits microscopiques sur un support solide tel qu'une lame de microscope; chaque puits contient un grand nombre de fragments d'ADN identiques qui permet de mesurer l'expression d'un gène particulier par complémentarité de séquence avec ARN correspondant. Les puces permettent ainsi de connaître le transcriptome, c'est-à-dire l'ensemble des gènes transcrit à un moment donné dans un groupe de cellules données[réf. nécessaire].Il y a plusieurs manières différentes de fabriquer des puces à ADN ; les plus courantes sont les puces à silicium, lames de microscope dont les taches ont 100 microns de diamètre, les puces qu'on peut adapter à ses besoins, et celles avec des taches plus grosses sur des membranes poreuses (macropuces). Les puces peuvent aussi être fabriquées pour des molécules autres que l'ADN. Par exemple, une puce à anticorps peut être utilisée pour déterminer quelle protéine ou bactérie est présente dans un échantillon de sang.Les puces à ADN sont ensuite lues à l'aide d'un scanner de micraorrays qui permettent d'acquérir le niveau de fluorescence de chaque spot présent sur la lame afin d'en analyser les données[réf. nécessaire].
Au fur et à mesure que de nouvelles procédures et de nouvelles technologies sont devenues disponibles, les anciennes sont rapidement abandonnées. Des exemples typiques sont les méthodes pour déterminer la taille des molécules d'ADN. Avant l'électrophorèse, avec agarose et polyacrylamide, on calculait la taille de l'ADN par sédimentation dans des gradients sucrés, une technologie lente et laborieuse nécessitant une instrumentation coûteuse ; et avant les gradients sucrés, on utilisait la viscométrie[réf. nécessaire].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.