Aminohapot
orgaanisten yhdisteiden ryhmä, joista proteiinit muodostuvat ja joiksi proteiinit ihmisen aineenvaihdunnassa pilkkoutuvat From Wikipedia, the free encyclopedia
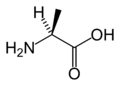
Aminohapot ovat orgaanisia yhdisteitä, joissa on sekä amino- (-NH2) että karboksyyliryhmä (-COOH) liittyneenä samaan molekyyliin.[1] Aminoryhmä on emäksinen ja karboksyyliryhmä hapan. Aminohapot polymeroituvat polypeptideiksi. Polypeptidiketjun pituuden ylittäessä 50 sitä aletaan yleensä kutsua proteiiniksi. Ihmiselle välttämättömiä aminohappoja on 20, joista 11 elimistö osaa itse valmistaa. Loput yhdeksän välttämätöntä aminohappoa on saatava ravinnosta. Soluissa aminohapot valmistetaan entsyymien ohjaamana.

Kemiallisia ominaisuuksia
Aminohapot esiintyvät tavallisimmin fysiologisessa pH:ssa (pH 7,4) kahtaisioneina, jolloin karboksyyliryhmä on negatiivisesti varautunut ja aminoryhmä on positiivisesti varautunut. Jos aminohapon aminoryhmä on sitonut saman aminohapon karboksyyliryhmän luovuttaman vetyatomin, tapahtumaa kutsutaan sisäiseksi suolanmuodostukseksi. Näin muodostunut COO−-ryhmä voi sitten toimia emäksenä ja NH3+-ryhmä happona. Koska aminohappo on sekä happo että emäs, sitä sanotaan amfolyyttiseksi yhdisteeksi.
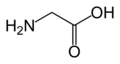
Aminohapot voivat polymeroitua, jolloin ne muodostavat peptidejä. Tällöin aminohapot liittyvät toisiinsa peptidisidoksin kondensaatioreaktiossa. Kaikki proteiinit ovat muodostuneet useista kymmenistä, jopa sadoista tai tuhansista polymeroituneista aminohapoista (polypeptidi). Proteiinien rakenneosina esiintyy yleisesti 20 erilaista alfa-aminohappoa – kaikkia lajeja ei kuitenkaan ole mukana jokaisessa proteiinissa, ja joissain tapauksissa peptidiketjussa oleva aminohappo voi muuntua vielä näistä 20 poikkeavaksi. Proteiinien aminohapot ovat optisesti aktiivisia ja kaikki L-isomeerejä, lukuun ottamatta yksinkertaisinta aminohappoa eli glysiiniä, jonka alfa-hiiliatomiin on amino- ja karboksyyliryhmän lisäksi liittynyt kaksi vetyatomia.
Aminohapot pysyvät koossa yli 100 °C:ssa proteiinien hajottua. Ensimmäisenä hajoavat kysteiini 175–178 °C:ssa ja glutamiini 185–186 °C:ssa, ja aminohapot alkavat kiehua vasta yli 200 °C:ssa.[2]
Aminohappojen ryhmittely
Aminohappojen tärkein biokemiallinen ominaisuus on niiden hydrofobisuus tai hydrofiilisyys ja happamuus tai emäksisyys. Kaikki happamat ja emäksiset aminohapot ovat hydrofiilisiä. Nämä ominaisuudet ovat tärkeitä muun muassa proteiinien alfa-kierteissä ja proteiinien laskostumisessa. Aineenvaihdunnassa on merkittävää myös se, mitä erityisryhmiä tai atomeja aminohappo sisältää.
| Erityisryhmä/Ominaisuus | Emäs | Hydrofobinen | Varaukseton hydrofiilinen | Happo |
|---|---|---|---|---|
| Typpipitoinen1 | histidiini, arginiini, lysiini | tryptofaani | asparagiini, glutamiini | − |
| Rikkipitoinen | − | metioniini | kysteiini, homokysteiini | − |
| Kaksoishappo2 | − | − | − | asparagiinihappo, glutamiinihappo |
| Aromaattinen | histidiini | fenyylialaniini, tryptofaani, tyrosiini | − | |
| Alkoholi | − | − | seriini, treoniini | − |
| Ei erityisryhmiä | − | glysiini, leusiini3, isoleusiini3, valiini3, alaniini, proliini4 | − | − |
| 1 Alfa-aminoryhmän lisäksi 2 Kaksi karboksyyliryhmää 3 sisältää metyyliryhmän 4 Proliinin aminoryhmä on osa viisirengasta ja sekundäärinen | ||||
Rakenteet
Rakenteet ja lyhenteet niille 20 aminohapolle, joita vastaa jokin geneettinen koodi.
- L-Alaniini (Ala / A)
- L-Arginiini (Arg / R)
- L-Asparagiini (Asn / N)
- L-Asparagiinihappo (Asp / D)
- L-Kysteiini (Cys / C)
- L-Glutamiinihappo (Glu / E)
- L-Glutamiini (Gln / Q)
- Glysiini (Gly / G)
- L-Histidiini (His / H)
- L-Isoleusiini (Ile / I)
- L-Leusiini (Leu / L)
- L-Lysiini (Lys / K)
- L-Metioniini (Met / M)
- L-Fenyylialaniini (Phe / F)
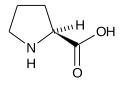
- L-Proliini (Pro / P)
- L-Seriini (Ser / S)
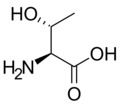
- L-Treoniini (Thr / T)
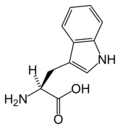
- L-Tryptofaani (Trp / W)
- L-Tyrosiini (Tyr / Y)
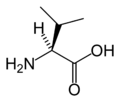
- L-Valiini (Val / V)
Biologinen rooli
Elimistössä on jopa kymmeniä aminohappoja, mutta vain kahtakymmentä aminohappoa vastaa jokin kolmen emäsparin yhdistelmä DNA:n geneettisessä koodissa. Kaikki DNA:n koodaamat aminohapot ovat ns. alfa-aminohappoja, joissa amiini- ja karboksyyliryhmä liittyvät samaan hiileen. Alfa-aminohapot ovat biokemiassa keskeisiä molekyylejä. Lisäksi aminohapoilla on erilliset L- ja D-muodot, mutta elimistön kaikki aminohapot ovat L-aminohappoja. Osa aminohapoista voi ihmisen elimistössä muuttua toisikseen. Niiden joukossa on kuitenkin kahdeksan välttämätöntä aminohappoa, joita ihminen ei kykene valmistamaan muista vaan joita on saatava riittävästi ravinnosta. Jotkut hormonit ovat oligopeptidejä, jotka koostuvat muutamista aminohapoista. Esimerkiksi oksitosiini, joka käynnistää kohdun ja maitorauhastiehyiden supistumisen, koostuu yhdeksästä aminohaposta. Vasopressiini, joka puolestaan osallistuu verenpaineen säätelyyn, rakentuu myös yhdeksästä aminohaposta. Oksitosiinin ja vasopressiinin aminohappoketjuissa on eroa yhden aminohapon verran, mikä kuitenkin vaikuttaa ratkaisevasti niiden toimintaan ihmiselimistössä. Sokeriaineenvaihdunnan säätelyssä keskeinen hormoni, insuliini on 51 aminohaposta muodostunut hormoni.
Välttämättömät aminohapot
- Pääartikkeli: Välttämättömät aminohapot
Välttämätön aminohappo on aminohappo, jota eliö ei itse pysty valmistamaan muista aineista, jolloin sen on saatava niitä ravinnosta.
Välttämättömien aminohappojen lista vaihtelee lajeittain. Eri eläinlajeilla lista välttämättömistä aminohapoista on erilainen ja tarve täytyy huomioida rehujen valmistuksessa.[3][4][5]
Raja välttämättömän ja ei-välttämättömän aminohapon välillä voi olla epäselvä, koska elimistö voi valmistaa aminohappoja toisista aminohapoista. Rikkipitoisia aminohappoja metioniinia ja homokysteiiniä voidaan valmistaa toisistaan mutta ei yksinkertaisemmista aineista. Samoin kysteiiniä voidaan valmistaa homokysteiinistä, mutta ei yksinkertaisemmista aineista. Niinpä rikkipitoisia aminohappoja käsitellään toisinaan yhtenä ryhmänä.
Ihmiselle välttämättömiä aminohappoja on 9: histidiini, tryptofaani, lysiini, metioniini, fenyylialaniini, treoniini, valiini, leusiini, isoleusiini.[6]
Valmistus
Soluissa aminohapot valmistetaan entsyymien ohjaamana. Eläimet saavat osan aminohapoista kasviravinnosta. Ihminen osaa tuottaa osan tarvitsemistaan aminohapoista kehossaan, mutta kahdeksaa aminohappoa ihmisen on saatava valmiina ravinnosta. Bakteerit, hiiva ja kasvit kykenevät tuottamaan kaikki tarvitsemansa aminohapot itse. Kemiallisesti aminohappoja voidaan valmistaa halogeenihapoista substituutioreaktiolla ammoniakin kanssa, jolloin halogeeniryhmä korvautuu aminoryhmällä. Reaktio tapahtuu noin 50 asteessa ja tarvitsee ammoniakkia ja suolahappoa. Aminohappoja syntyy myös aldehydeistä ammoniakin ja syaanivedyn avulla.[7]
Lyhenteet ja nimeämislogiikka
Kolmikirjaimiset lyhenteet saadaan englanninkielisistä nimistä niin, että aina vähintään kaksi ensimmäistä kirjainta kolmikirjaimisessa lyhenteessä vastaa koko nimen ensimmäisiä kirjaimia (kahta tai kolmea; esim. fenyylialaniini, eng. Phenylalanine, kolmikirjaiminen lyhenne on Phe) paitsi isoleusiinin tapauksessa, jossa lyhenne on "Ile" eikä esimerkiksi "Iso" tai "Isl" (Ile painottaa sitä, että isoleusiini on nimenomaan isomeeri leusiinille.) Koska englannin aakkosia on 26 kappaletta ja tavallisia aminohappoja 20, saadaan yksikirjaimiset lyhenteet hieman kolmikirjaimisia monimutkaisemmin seuraavasti;
- Aminohapoille annetaan yksikirjaimiset lyhenteet järjestyksessä yksinkertaisimmasta (pienimmästä) monimutkaisimpaan, mikä tarkoittaa sitä, että yksinkertaisimmat saavat nimet englanninkielisen alkukirjaimen mukaan, monimutkaisemmat useimmiten joko toisen alkukirjaimen (esim. R on arginiini, joka siis on monimutkaisempi kuin alaniini A) tai onomatopoeettisesti eli ääntämisen mukaan (fenyylialaniini (Phenylalanine) on F eikä P, koska proliini on pienempi (runko ja kolme hiiliatomia) kuin fenyylialaniini (jossa on metyyliryhmään kiinnittyneenä fenyyliryhmä eli 6 hiiliatomia) eli P on jo varattu, ja koska toinen alkukirjain H on jo varattu histidiinille, joka on pienempi (5-rengas on pienempi kuin fenyylialaniinin 6-rengas)). Tällä kasvavan monimutkaisuuden mukaan järjestämisellä saadaan nimettyä G (glysiini), A (alaniini), V (valiini), L (leusiini), I (isoleusiini), P (proliini), C (kysteiini eli "Cystein" englanniksi), M (metioniini), S (seriini), T (treoniini) ja H (histidiini) eli 11 tavallisimmasta 20 aminohaposta. Suomen kielen fenyylialaniini taas on englanniksi "Phenylalanine", jonka "Phe"-alku äännetään [fe], ja on saanut siitä F-lyhenteensä (kohta 3., ääntämisen mukaan).
- Toisen alkukirjaimen mukaan nimetään alkukirjaimen mukaan nimettyjä monimutkaisemmat aminohapot arginiini R (alaniinia, aspartaattia ja asparagiinia monimutkaisempi), tyrosiini Y (treoniinia, T, monimutkaisempi). Muiden aminohappojen toiset alkukirjaimet on jo käytetty, joten niitä ei voida nimetä tällä tavoin.
- Onomatopoeettisesti nimetään fenyylialaniini F, (P eli proliini sekä H eli histidiini ovat pienempiä kuin "Phenylalanine" eli fenyylialaniini), ja glutamiini (Glutamine, Q; G ja L ovat yksinkertaisempia kuin glutamiini, ja Q muistuttaa G:tä ääntämiseltään).
- Jäljellä olevat 5 aminohappoa ovat aspartaatti (D, aspartate), glutamaatti (E, glutamate), näiden kahden amidijohdannaiset asparagiini (N, asparagine) ja glutamiini (Q, glutamine, joka nimettiin jo onomatopoeettisesti), lysiini (K, lysine) ja aminohapoista monimutkaisin eli tryptofaani (W, tryptophan). Aspartaatin ja glutamaatin ero on se, että glutamaatin hiiliketju on yhdellä hiilellä pitempi kuin aspartaatin, joten samoin glutamaatti (E) on aakkosissa aspartaattia (D) seuraava (B on käyttämättä, mutta C on kysteiinin (cysteine) lyhenne, joten pari ei voi olla B ja C vaan käytetään D:tä ja E:tä glutamaatin ja aspartaatin lyhenteinä). Asparagiini (aspartaatin amidijohdannainen) on sivuketjun typestään (hapen tilalla) huolimatta neutraali (kuten glutamiinikin), joten lyhenteen N voi muistaa Neutraalista. Lysiini K (Lycine) on monimutkaisempi kuin edellä nimetyt N ja E, joten L (leusiini), Y (tyrosiini), C (kysteiini), I (isoleusiini), N ja E (asparagiini ja glutamaatti) on jo käytetty; K on aakkosissa lähinnä L:ää oleva käyttämätön kirjain (K on ennen L:ää -- M taas on pienempikokoisen metioniinin tunnus). Tryptofaani on monimutkaisin aminohapoista, ja sen sivuketjun fenyylirenkaan ja viisirenkaan toisen puolen hiiliketju muodostaa W:n muotoisen kuvion, joten se saa aakkosten häntäpään kirjaimen W lyhenteekseen.
Muistisääntö aminohapoista yksikirjaimisilla lyhenteillä
Aminohapot voidaan jakaa ryhmiin useammilla tavoilla sivuketjujen ominaisuuksiensa mukaan. Yksi ryhmittelytapa sivuketjujen mukaan[8] , kukin yksittäinen ryhmä kasvavan koon mukaan, (esimerkiksi GAVLI; koot G<A<V<L = I, leusiini ja isoleusiini ovat isomeerejä) on
- Alifaattiset (suoraketjuiset) (G)AVLI. Hiilien määrä sivuketjuissa (0), 1, 3, 4, 4 → (G)AVLI 1344, glysiini on suluissa koska sillä ei siis ole hiiliketjua
- Aromaattiset FYW; fenyylialaniini F = alaniini + fenyyliryhmä; Y = tyrosiini = F + -OH (eli fenoli), W eli tryptofaani on (sivuketjultaan) metyyliryhmään kiinnittynyt heterosyklinen 5-rengas kiinni fenyyliryhmässä eli summaltaan F + 5-rengas. Kaikki kolme ovat aromaattisia. (Myös histidiinin sivuketju on aromaattinen (koska sivuketjun heterosyklinen eli tässä tapauksessa typpeä sisältävä 5-rengas on tasomainen, sen kaikki atomit ovat sp2-hybridisoituneita ja sillä on pariton määrä (3) elektronipareja renkaan atomien p-orbitaaleilla eli käytettävissä delokalisoituneihin π-sidoksiin; täten se täyttää aromaattisuuden kolme vaatimusta, vaikkei sisälläkään fenyyliryhmää) [9],
- Rikkiä sisältävät CM; kysteiinissä hiilen ja rikin summa on 2, metioniinissä taas se on 4 → CM24 (CityMarket24). Kysteiini tekee rikkisiltoja proteiineissa (C.llä on terminaalinen -SH eli tioliryhmä), metioniini taas ei muodosta rikkisiltoja, mistä voi muistaa myös sen että kysteiinissä rikki on päässä eli terminaalinen, metioniinissa taas rikki ei ole terminaalinen vaan toiseksi viimeisenä osana neliosaista ketjua.
- Alkoholit ST; kummassakin hydroksyyliryhmä on kiinni ensimmäisessä alfahiileen kiinnittyneessä (sivuketjun) hiilessä. Seriinin (S) sivuketjussa on yksi hiili, treoniinin (T) sivuketjussa kaksi hiiltä → ST1 (huoltoasema) tai ST112 (numero 1 tulee siitä, että hydroksyyliryhmä on kiinni 1. hiilessä kummassakin sivuketjussa, 1 ja 2 ovat hiilten lukumäärät)
- Positiivisesti varautuneet K(H)R. Histidiinin (H) (joka on myös aromaattinen) sivuketju ei ole positiivisesti varautunut fysiologisessa pH:ssa, mutta pH:n laskiessa hieman sen varaus muuttuu positiivisemmaksi. Kaikkien kolmen (lysiini K, histidiini H ja arginiini R) sivuketjussa on 4 hiiliatomia, typpiatomeita taas lysiinillä on 1, histidiinillä 2 ja arginiinilla 3 → K(H)R1234, missä 1, 2 ja 3 ovat typen määrät sivuketjussa, 4 taas on hiilen määrä, joka on kaikilla sama.
- Negatiivisesti varautuneet aminohapot DE ja näiden amidijohdannaisaminohapot NQ; DENQ. Negatiivinen varaus tulee fysiologisessa pH:ssa karboksyyliryhmästä, joka on luovuttanut protoninsa (pKa karboksyylihapoilla on noin 5), jolloin jäljelle jää karboksylaattianioni. Amidiryhmässä taas C=O-sidos on jäljellä, mutta negatiivisesti varautuneen hapen on korvannut aminoryhmä (-NH2), joten negatiivista varausta ei fysiologisessa pH:ssa ole vaan sivuketju on neutraali. Glutamaatilla ja glutamiinilla (E ja Q) on yksi hiili enemmän (3 kpl) kuin aspartaatilla ja asparagiinillä (2 kpl, D ja N) → DENQ23(ag); aspartaatti on D ja glutamaatti E, asparagiini N ja glutamiini Q). Huomaa, että DENQ menee aakkosjärjestyksessä samoin kuin ag, 23 taas numerojärjestyksessä.
P eli proliini ei kuulu mihinkään näistä ryhmistä; se on syklinen, muttei aromaattinen, minkä lisäksi aminohapon rungon typpi ja alfa-hiili ovat mukana osana rengasta toisin kuin missään muussa aminohapossa; vaikka se on neutraali ja "sivuketju" sisältää vain hiiltä, se ei ole alifaattinen eikä aromaattinen. G eli glysiini on suluissa, koska siinä myöskään ei ole alifaattista hiiliketjua vaan pelkkä vety, mikä tekee siitä yksinkertaisimman (pienimmän) aminohapon. H eli histidiini on myös suluissa, koska se ei keskimäärin ole fysiologisessa pH:ssa positiivisesti varautunut; vasta pH:n laskiessa alle arvon 6,0 yli 50% todennäköisyydellä histidiinin sivuketju on positiivisesti varautunut.
Kun ryhmät laitetaan peräkkäin, saadaan seuraava muistisääntö (kun G, P ja H otetaan mukaan) (G)AVLI1344-FYW(P)-CM24-ST112-K(H)R1234-DENQ23(ag). ST1:n 1 ei siis kuvaa hiilen määrää, kuten ei myöskään KHR1234:n 1, 2 tai 3, vaan ST1:n 1 on hydroksyyliryhmän paikka sivuketjussa, hiilten määrä taas on 1 ja 2 (ST112). KHR:n 1, 2 ja 3 taas kuvaavat typen määrää sivuketjussa, 4 on hiilten määrä, joka on vakio. CM24:n 2 ja 4 kuvaavat siis hiilen ja rikin summaa; kysteiinissä (rikkisillat) rikki on ketjun päässä, metioniinissa taas toiseksi viimeisenä.
Katso myös
Lähteet
Aiheesta muualla
Wikiwand - on
Seamless Wikipedia browsing. On steroids.