یکی از عناصر شیمیایی From Wikipedia, the free encyclopedia
اکسیژن یکی از عناصر شیمیایی در جدول تناوبی است که نشان شیمیایی آن O و عدد اتمی آن ۸ است. این عنصر که عضوی از خانوادهٔ عناصر گروه کالکوژن، یعنی گروه شانزدهم در جدول تناوبی است، نافلزی بسیار واکنشپذیر و عاملی اکسیدکننده است که به آسانی موجب اکسید شدن عناصر و ترکیبات شیمیایی میشود. از نظر جرمی، پس از هیدروژن و هلیوم، اکسیژن سومین عنصر فراوان در کیهان است. در دما و فشار استاندارد، دو اتم اکسیژن با اتصال به یکدیگر موجب تولید ساختاری موسوم به دیاکسیژن یا اصطلاحاً موجب شکلگیری یک مولکول اکسیژن میشوند. مولکول اکسیژن در حالت گازی، بیرنگ، بیبو و دارای فرمول O۲ است. مولکول اکسیژن ۲۰٫۹۵ درصد از اتمسفر کره زمین را تشکیل میدهد. با درنظر گرفتن اکسیژن موجود در فرمول شیمیایی ترکیبهای دارای اکسیژن موجود در پوسته زمین، اکسیژن تقریباً تشکیل دهنده نیمی از عناصر سازنده پوسته زمین است.
اکسیژن مایع در حال جوشش | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| اکسیژن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| دگرشکلی | O۲, O۳ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | (۱۵٫۹۹۹۰۳، ۱۵٫۹۹۹۷۷) conventional: ۱۵٫۹۹۹ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| اکسیژن در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | ۱۶ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره ۲ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | نافلز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [He] 2s2 2p4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۲,۶ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | گاز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | ۵۴٫۳۶ K (−۲۱۸٫۷۹ °C, −۳۶۱٫۸۲ °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | ۹۰٫۱۸۸ K (−۱۸۲٫۹۶۲ °C, −۲۹۷٫۳۳۲ °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (در STP) | ۱٫۴۲۹ g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (در نقطه جوش) | ۱٫۱۴۱ g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه سهگانه | ۵۴٫۳۶۱ K, ۰٫۱۴۶۳ kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه بحرانی | ۱۵۴٫۵۸۱ K, ۵٫۰۴۳ MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | (O۲) ۰٫۴۴۴ kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | (O۲) ۶٫۸۲ kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | (O۲) ۲۹٫۳۷۸ J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | ۲−, ۱−, ۰, ۱+, ۲+ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: ۳٫۴۴ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm ۶۶±۲ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | ۱۵۲ pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | مکعبی | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت | ۳۳۰ m/s (گاز در ۲۷ سلسیوس) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | ۲۶٫۵۸×۱۰−۳ W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | پارامغناطیس | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| پذیرفتاری مغناطیسی | +۳۴۴۹٫۰·۱۰−۶ cm3/mol (۲۹۳ K)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | ۷۷۸۲-۴۴-۷ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تاریخچه | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کشف | کارل ویلهلم شیله (۱۷۷۱) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نامگذار | آنتوان لاووازیه (۱۷۷۷) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای اکسیژن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
اکسیژن مولکولی موجب تولید انرژی در فرایند سوختن، تنفس یاختهای هوازی است. بسیاری از مولکولهای آلی موجود در موجودات زنده مانند پروتئینها، نوکلئیک اسیدها، کربوهیدراتها، چربیها و همچنین گستره وسیعی از ترکیبات معدنی پوسته بدن جانوران، دندانها و استخوانها دارای اتمهای اکسیژن هستند. اغلب جرم تشکیل دهنده موجودات زنده متشکل از اکسیژن است، چرا که بدن جانوران بهطور عمده از آب تشکیل شدهاست و اکسیژن عنصر اصلی سازنده آب است.
اکسیژن موجود در اتمسفر زمین بهطور پیوسته توسط فرایند فتوسنتز تأمین میشود، فرایندی که طی آن نور خورشید موجب تبدیل آب و کربن دیاکسید به اکسیژن میشود. از لحاظ شیمیایی، اکسیژن خیلی فعال است و درنتیجه نمیتواند در هوای آزاد بهصورت آزاد و اتمی باقی بماند. بهغیر از اکسیژن مولکولی، اکسیژن دارای دگرشکلهای دیگری نیز است که ازون یکی از آنها است. مولکول ازون قادر است نور فرابنفش بی منتشر شده از طرف خورشید را جذب کند و درنتیجه لایه ازون پوشاننده کره زمین، حیات موجود بر روی زمین را از پرتوهای مخرب فرابنفش محافظت میکند. با اینحال ازونی که نزدیک سطح زمین تولید میشود محصول جانبی واکنش مهدودها است و درنتیجه بهعنوان یک عامل آلاینده محسوب میشود.
اکسیژن توسط مایکل سندیووجیس قبل از سال ۱۶۰۴ جداسازی شد با اینحال، باور عمومی رایج این است که اکسیژن توسط کارل ویلهلم شیله در اوپسالا و در سال ۱۷۷۳ یا توسط جوزف پریستلی در ویلتشر در سال ۱۷۷۴ کشف شدهاست. در میان این دو نیز بهطور معمول تقدم کشف اکسیژن به پریستلی نسبت داده میشود، چرا که مقاله او زودتر از شیله چاپ شد. پریستلی اکسیژن را هوای فلوژیستونزدایی شده نامید و آن را بهعنوان یک عنصر شیمیایی بهحساب نیاورد.[توضیح 1] واژه اکسیژن در سال ۱۷۷۷ و توسط آنتوان لاووازیه رواج داده شد. لاوازیه اولین کسی بود که اکسیژن را بهعنوان یک عنصر شیمیایی مستقل بهشمار آورد و بهدرستی به نقش آن در سوختن اشاره کرد.
اکسیژن به صورت متداول در تولید فولاد، پلاستیک، پارچه، برشکاری اکسیژنی فولاد، پیشران راکت، اکسیژندرمانی و سامانه پشتیبان حیات در هواپیما، زیردریاییها، پروازهای فضایی و غواصی استفاده میشود.

یکی از اولین آزمایشهای شناخته شده در مورد رابطه بین سوختن و هوا دو سده پیش از میلاد مسیح، توسط نویسنده یونانی در زمینه مکانیک، فیلو انجام شد. او در کار خود با استفاده از پنوماتیک، به اشتباه تصور میکرد که با برگرداندن یک ظرف بر روی یک شمع در حال سوختن که پیرامون آن آب است وقتی بخشی از مایع از گردنه ظرف بالا میرود مقداری از هوای موجود در ظرف به آتش یکی از عناصر چهارگانه تبدیل شدهاست و قادر به فرار از منافذ موجود در شیشه است.[2] قرنها بعد، لئوناردو دا وینچی براساس کارهای فیلو، مشاهده کرد که بخشی از هوا در هنگام سوختن و تنفس مصرف میشود.[3]
در اواخر سده هفدهم، رابرت بویل شیمیدان، فیزیکدان، فیلسوف و مخترع ایرلندی ثابت کرد که هوا برای سوختن لازم است، سپس شیمیدان انگلیسی جان مایو (۱۶۴۱–۱۶۴۱) نشان داد که آتش فقط به بخشی از هوا احتیاج دارد و نام آن را اسپریتوس نیتروآروس[lower-alpha 1] گذاشت و کار بویل را تصحیح کرد. در یک آزمایش او با قرار دادن یک موش و یک شمع کوچک روشن در یک ظرف وارونه روی آب شاهد بالا آمدن سطح آب به مقدار یک چهاردهم از حجم هوا قبل از خاموش شدن شمع و مرگ موش بود.[4] از این رو او تصور کرد که نیتروآروس هم در تنفس و هم با سوختن مصرف میشود.
مایو همچنین مشاهده کرد که وزن آنتیموان هنگام گرم شدن افزایش یافته و براین اساس استنباط میکند که دلیل آن ترکیب شدن با نیتروآروس میباشد. او همچنین تصور کرد که ریهها نیتروآروس را از هوا جدا کرده و آن را درون خون منتقل میکنند و گرمای بدن حیوانات و حرکت ماهیچهها ناشی از واکنش نیتروآروس با مواد خاصی در بدن است. وی گزارشهایی از این آزمایشها و ایدههای دیگر را در سال ۱۶۶۸ در در اثری بهنام دو مجرا[lower-alpha 2] در دستگاه تنفس[lower-alpha 3] منتشر شد.[4]

رابرت هوک، اوله بورچ،[lower-alpha 4] میخاییل لومونسف و پیر باین[lower-alpha 5] همه در آزمایشهایی که در سده ۱۷ و ۱۸ میلادی انجام میدادند اکسیژن تولید میکردند اما هیچکدام آن را بهعنوان یک عنصر شیمیایی به رسمیت نشناختند.[5] که این ممکن است تا حدودی بهدلیل نشر فلسفه سوختن و خوردگی به نام تئوری فلوژیستون باشد که در آن زمان توضیحی ارجح برای این نوع فرایندها بود.[6]
این نظریه که بعدها بهطور کامل رد گردید، برای اولین بار توسط شیمیدان آلمانی یوهان یوآکیم بکر بیان شد و سپس در سال ۱۷۳۱ توسط جرج ارنست استال اصلاح شد.[7] بر مبنای این تئوری همهٔ مواد قابل سوختن از جزئی به نام فلوژیستون تشکیل شده بودند که با سوختن آن ماده، فلوژیستون از ماده جدا شده و به شکل یک مادهٔ سادهتر کاهش مییافت. در حالی که تصور میشد که قسمت اصلی آن از نظر ظاهری شکل واقعی یا کالکس[توضیح 2] است.[3]
باور بر این بود که مواد دارای قابلیت احتراق بالا مانند چوب یا زغالسنگ که پس از سوختن، باقی مانده اندکی از آنها به جا میماند، غالباً از فلوژیستون ساخته شدهاند و مواد غیرقابل احتراق مانند آهن که دچار خوردگی میشوند، حاوی فلوژیستون بسیار کمی هستند. این تئوری نقش هوا در سوختن را صرفاً محدود به انتقال فلوژیستون آزادشده از جسم میکرد. بهعنوان مثال طبق این نظریه از سوختن چوب، خاکستر به جا میمانَد و فلوژیستون آن توسط هوا جدا میشود که اختلاف جرم بین چوب و خاکستر بر جای مانده، ناشی از خارج شدن فلوژیستون میباشد. هیچ آزمایشی برای این ایده انجام نشد و تمامی نظرات مبتنی بر مشاهده آنچه اتفاق میافتاد بود که اکثر اشیاء با سوختن سبکتر میشوند و به نظر میرسد در روند کار چیزی را از دست میدهند.[3]



کیمیاگر، فیلسوف و پزشک لهستانی مایکل سندیووجیس در سال ۱۶۰۴ ماده موجود در هوا را شرح داد و از آن به عنوان غذای زندگی[lower-alpha 6] یاد کرد،[8] و این ماده با اکسیژن یکسان است.[9] سندیووجیس، در طول آزمایشهای خود که بین سالهای ۱۵۹۸ و ۱۶۰۴ انجام داد، به درستی تشخیص داد که این ماده معادل محصول جانبی گازی است که با تجزیه حرارتی پتاسیم نیترات آزاد میشود. از دیدگاه بوگاج،[lower-alpha 7] جداسازی اکسیژن و ارتباط مناسب ماده با آن قسمت از هوا که برای زندگی لازم است، دلیل کافی برای کشف اکسیژن توسط سندیووجیس فراهم میکند.[9] اما این کشف سندیووجیس اغلب توسط نسل دانشمندان و شیمیدانان جانشین او انکار میشد.[8]
همچنین معمولاً ادعا میشود که اکسیژن اولین بار توسط داروساز سوئدی کارل ویلهلم شیله کشف شد. وی با گرم کردن اکسید جیوه و نیتراتهای مختلف در سال ۱۷۷۱، گاز اکسیژن تولید کرده بود.[3][10] شیله گاز را هوای آتش[lower-alpha 8] نامید زیرا در آن زمان تنها عامل شناخته شده برای پشتیبانی از سوختن بود. وی روایتی از این کشف را در یک نسخه خطی با عنوان رسالهای در باب هوا و آتش[lower-alpha 9] نوشت که در سال ۱۷۷۵ برای ویراستار خود فرستاد. با اینحال این رساله تا سال ۱۷۷۷ منتشر نشد.[5]
در همین حال، در اول اوت سال ۱۷۷۴، آزمایشی که توسط شیمیدان و فیلسوف و مخالف کلیسای انگلستان، جوزف پریستلی انجام شد، نور خورشید را روی اکسید جیوه (HgO) موجود در یک لوله شیشه ای متمرکز کرد، که موجب آزاد شدن گازی از آن شد و آن را با عنوان هوای فلوژیستون زدایی[lower-alpha 10] شده یاد کرد.[3] وی خاطرنشان کرد: شمعها در حضور این گاز روشنتر میسوزند و موش فعال تر بوده و با تنفس آن مدت زمان بیشتری زنده بودهاست. پریستلی پس از تنفس گاز خود نوشت: «احساس آن در ریههایم بهطور قابل ملاحظه ای با هوای معمولی تفاوت چندانی نداشت، اما احساس کردم سینهام به خصوص بعد از مدتی سبک و راحت است»[5] پریستلی یافتههای خود را در سال ۱۷۷۵ در مقاله ای با عنوان «گزارشی از اکتشافات بیشتر در هوا» منتشر کرد که در جلد دوم کتاب وی با عنوان آزمایشها و مشاهدات در انواع مختلف هوا[lower-alpha 11] گنجانده شدهاست.[3][11] از آنجا که او برای اولین بار یافتههای خود را منتشر کرد، معمولاً از او به عنوان کاشف اکسیژن نام برده میشود. شیمیدان فرانسوی آنتوان لورنت لاووازیه بعداً ادعا کرد که این ماده را بهطور مستقل کشف کردهاست. با این حال، پریستلی در اکتبر سال ۱۷۷۴ به دیدار لاووازیه رفت و در مورد آزمایش خود و نحوه انتشار گاز جدید به وی گفت. شیله همچنین در ۳۰ سپتامبر همان سال نامهای را به لاووازیه ارسال کرده بود که شرح کشف ماده ناشناخته را توصیف میکرد، اما لاووازیه هرگز پذیرش آن را تأیید نکرد. پس از مرگ شیله نسخهای از نامه در وسایلش پیدا شد.[5]

لاووازیه اولین آزمایشهای کمی مناسب در مورد اکسیداسیون را انجام داد و اولین توضیح صحیح در مورد چگونگی عملکرد سوختن را ارائه کرد.[3] او از این آزمایش و آزمایشهای مشابه دیگر، که در سال ۱۷۷۴ شروع شده بود، استفاده کرد تا نظریه فلوژیستون را بیاعتبار کند و نشان دهد ماده کشف شده توسط پریستلی و شیله یک عنصر شیمیایی است. در یک آزمایش، لاووازیه مشاهده کرد که هنگام گرم کردن قلع و هوا در یک ظرف بسته، افزایش کلی وزن وجود ندارد.[3]
وی خاطرنشان کرد: هنگام بازکردن ظرف، ناگهان هوا وارد ظرف شد و این نشان میدهد که برخی از هوای به دام افتاده مصرف شدهاست و نشان داد که مقدار وزن افزایش یافته قلع پس از سوختن برابر با مقدار هوایی بودهاست که پس از بازکردن ظرف وارد آن شدهاست. این آزمایش به همراه دیگر آزمایشهای او در کتابی با عنوان در مورد احتراق[lower-alpha 12] در سال ۱۷۷۷ منتشر و ثبت شد. با انجام این کار، او ثابت کرد که هوا ترکیبی از دو گاز است. هوای حیاتی[lower-alpha 13] که برای سوختن و تنفس ضروری است و آزوت[lower-alpha 14] یا هوای بیجان[lower-alpha 15] که پیش تر ازت در انگلیسی نیتروژن نام گرفت، اگرچه این نام در فرانسوی و چند زبان اروپایی دیگر نگه داشته شد.[12][13]
لاووازیه نام هوای حیاتی را در ۱۷۷۷ به اکسیژن تغییر نام داد که از ریشه یونانی اوکسیس[lower-alpha 16] به معنای تیز برای طعم اسیدها و -جنز[lower-alpha 17] به معنای تولیدکننده یا مولد، گرفته شده بود زیرا او به اشتباه فکر میکرد که اکسیژن ماده تشکیل دهنده همه اسیدها است.[14] بعد از او، شیمیدانهایی مانند همفری دیوی، در ۱۸۱۲ سرانجام تشخیص دادند که لاووازیه در ارزیابی خود اشتباه کردهاست و این هیدروژن است که پایه اسیدها را تشکیل میدهد، اما این نام قبلاً رایج شده بود. واژه اکسیژن علیرغم مخالفت دانشمندان انگلیسی و این واقعیت که دانشمند انگلیسی پریستلی ابتدا آن را کشف کرده و دربارهٔ آن نوشته بود، وارد زبان انگلیسی شد که تا حدودی ناشی از شعری است که با عنوان «اکسیژن» در کتاب محبوب باغ گیاهشناسی (۱۷۹۱)[lower-alpha 18] اثر اراسموس داروین، پدر بزرگ چارلز داروین از آن تحسین میکند.[5]


نظریه جان دالتون بر این اساس بود که تمام اتمهای یک عنصر یکسانند و اتم موجود در ترکیبات معمولاً سادهترین نسبتهای اتمی را نسبت به یکدیگر دارند. او به اشتباه تصور میکرد که سادهترین حالت ترکیب بین دو عنصر همواره ترکیب یک اتم از هر کدام است؛ بنابراین مولکول آب را به اشتباه HO فرض میکرد و به این نتیجه رسید که جرم اتمی اکسیژن ۸ برابر بیشتر از هیدروژن است درحالیکه امروزه با در نظر گرفتن فرمول درست آب میدانیم که اتم اکسیژن ۱۶ برابر از هیدروژن سنگین تر است.[15] در سال ۱۸۰۵، ژوزف لویی گیلوساک و الکساندر فون هومبولت نشان دادند که نسبت حجمی هیدروژن نسبت به اکسیژن در آب ۲ به ۱ است و در سال ۱۸۱۱ آمدئو آووگادرو شیمیفیزیکدان ایتالیایی با فرض مولکولهای دو اتمی ابتدایی، تفسیر صحیحی از ترکیب مایعات ارائه داد که امروز به عنوان قانون آووگادرو شناخته میشود.[16][توضیح 3]
در اواخر سده نوزدهم دانشمندان دریافتند که میتوان هوا را به مایع تبدیل کرد و اجزای آن را با فشردهسازی و خنک کردن آن جدا کرد. با استفاده از روش آبشاری، رائول پیکتت شیمیدان و فیزیکدان سوئیسی، گوگرد دیاکسید را بهمنظور مایعسازی کربن دیاکسید، تبخیر کرد. این مایع سازی از طریق جذب گرمای کربن دیاکسید توسط گوگرد دیاکسید در هنگام تبخیر شدن به انجام میرسد. وی در ۲۲ دسامبر سال ۱۸۷۷ تلگرافی را به فرهنگستان علوم فرانسه ارسال کرد و خبر از کشف اکسیژن مایع داد[17] و تنها دو روز بعد، فیزیکدان فرانسوی لوئیس پل کایتت روش خود را برای مایع کردن اکسیژن مولکولی اعلام کرد. در هر دو مورد، فقط چند قطره از اکسیژن مایع تولید میشد، بنابراین امکان یک تجزیه و تحلیل قطعی را نمیداد. اکسیژن برای اولین بار در ۲۹ مارس ۱۸۸۳ توسط دانشمندان لهستانی، زیگمونت وروبلوسکی و کارول اولژوسکی از دانشگاه یاگیلونیا در حالت پایدار مایع شد.[18]

در سال ۱۸۹۱، شیمیدان اسکاتلندی، جیمز دیوئر، قادر به تولید اکسیژن مایع کافی برای مطالعه آن شد.[5] اولین فرایند تجاری مناسب برای تولید اکسیژن مایع بهطور مستقل در سال ۱۸۹۵ توسط مهندس آلمانی کارل فن لینده و مهندس بریتانیایی ویلیام هامسون توسعه یافت. آنها دمای هوا را تا زمان مایع شدن آن کاهش میدادند و سپس مخلوط را به صورت جز به جز تقطیر و آنها را جداگانه استخراج میکردند[19] بعدتر، در سال ۱۹۰۱، جوشکاری اکسیاستیلن برای اولین بار با سوختن مخلوطی از استیلن و اکسیژن فشرده شده استفاده شد که برای برش فلزات متداول گشت. در سال ۱۸۹۸، ویلیام تامسون محاسبه کرد که تنها برای حدود ۴۰۰ یا ۵۰۰ سال اکسیژن روی زمین باقی ماندهاست که مقدار دقیق آن به سرعت سوختن مواد قابل احتراق بستگی دارد.[20][21]
در سال ۱۹۲۳، دانشمند آمریکایی رابرت گدارد اولین شخصی بود که موتور موشکی را ساخت که از بنزین برای سوخت و اکسیژن مایع به عنوان عامل اکسنده استفاده میکرد و اولین موشک سوخت مایع را در تاریخ ۱۶ مارس ۱۹۲۶ در اوبرن پرتاب کرد که ۵۶ متر را با سرعت ۹۷ کیلومتر در ساعت طی نمود.[22] در آزمایشگاههای دانشگاهی، اکسیژن را میتوان با گرم کردن مخلوطی از پتاسیم کلرات و مقدار کمی از منگنز دیاکسید تهیه کرد.[23] سطح اکسیژن موجود در جو در حال کاهش است که دلیل آن استفاده از سوختهای فسیلی است.[24]


در شرایط استاندارد دما و فشار، اکسیژن، گازی بدون بو، رنگ و مزه، با فرمول شیمیایی O۲ است که خود از دو اتم اکسیژن تشکیل شدهاست.[26] پیوند میان دو اتم اکسیژن در یک مولکول اکسیژن، میتواند بر اساس نظریههای مختلفی تفسیر داده شود با اینحال، منطقی است که آن را یک پیوند دوگانه کووالانسی درنظر گرفت که در اثر پر شدن اوربیتالهای مولکولی با الکترونهای مهیا شده از دو اتم مجزای اکسیژن ایجاد میشود. بهصورت دقیقتر، این پیوند دوگانه مطابق اصل آفبا از پر شدن متوالی اوربیتالهای مولکولی در یک مولکول اکسیژن، با ترتیب چینش از انرژی کم به انرژی زیاد، ایجاد میشود. پیوندهای سیگما (σ) و سیگما استار (*σ) ناشی از همپوشانی بهترتیب پیوندی و ضدپیوندی اوربیتالهای 2s دو اتم اکسیژن، یکدیگر را خنثی میکنند. پیوند سیگمای ناشی از همپوشانی اوربیتالهای 2p دو اتم اکسیژن، عامل ایجاد پیوند یگانه اکسیژن-اکسیژن (O-O) هستند و پیوند پای (π) حاصل از همپوشانی جانبی اوربیتالهای 2p این دو اتم است. بهعلت حضور دو الکترون در اوربیتال ضدپیوندی پای استار (*π)، بخشی از همپوشانی اوربیتالی پای پیوندی خنثی میشود که در نتیجه آن پیوند موجود در یک مولکول اکسیژن دار کاهش رتبه پیوند شده و خصلتی دوگانه و دارای واکنشپذیری بالا پیدا میکند.[25] آرایش الکترونی اکسیژن در حالت پایه خود به علت داشتن دو الکترون منفرد و جفت نشده، اصطلاحاً سهتایی[توضیح 4] نامیده میشود.[27] اکسیژن سهتایی مولکولی پارامغناطیس است که این خصلت ناشی از وجود دو الکترون جفت نشده در ساختار آن است. زمانی که اکسیژن سهتایی در مجاورت میدان مغناطیسی قرار میگیرد، گشتاور مغناطیسی اسپینی این الکترونها و همچنین تبادل انرژی بین مولکولهای اکسیژن نزدیک، موجب میشود که اکسیژن خصلتی مغناطیسی پیدا کند. اکسیژن مایع بهقدری مغناطیسی است که در مشاهدات آزمایشگاهی، پلی از اکسیژن مایع، میتواند وزن خود را بین قطبهای یک آهنربای قوی تحمل کند.[28]
اکسیژن سهتایی به علت داشتن دو الکترون جفتنشده به آرامی با اغلب ترکیبات آلی واکنش میکند، چرا که آنها دارای الکترونهای جفتشده هستند و میل ترکیبی کمتری دارند، در نتیجه این موضوع سبب میشود که جلوی احتراق خودبهخودی این ترکیبات گرفته شود.[29] اکسیژن میتواند حالت الکترونی دیگری نیز داشته باشد و آن حالت اکسیژن یکتایی است. اکسیژن یکتایی همانند مورد سهتایی دارای فرمول O۲ است، با این تفاوت که از لحاظ الکترونی، فاقد الکترون جفت نشدهاست و تمامی الکترونهای موجود در اوربیتالهای مولکولی آن به صورت جفتشده بهسر میبرند. اکسیژن یکتایی در مقابل ترکیبات آلی متداول واکنشپذیری بسیار بالاتری از خود نشان میدهد. به صورت طبیعی، اکسیژن یکتایی در طول فتوسنتز با کمک نور خورشید از آب تولید میشود.[30] این گونه همچنین در تروپوسفر و بر اثر نورکافت مولکولهای ازون بهوسیله پرتوهای خورشیدی پرقدرت و دارای طول موج کوتاه نیز تولید میشود.[31] اکسیژن یکتایی همچنین توسط سیستم ایمنی بدن نیز تولید میشود.[32] در جاندارانی که فتوسنتز میکنند، کاروتنوئیدها نقشی اساسی در جذب انرژی از اکسیژن یکتایی و تبدیل آن به حالت پایدارتر برای جلوگیری از آسیب رسانی به بافتها را دارند.[33]

اصلیترین و متداولتر دگرشکل متداول اکسیژن، دیاکسیژن یا همان اکسیژن مولکولی (O۲) است که بخش بزرگی از اتمسفر اکسیژنی کره زمین را تشکیل میدهد. اکسیژن مولکولی دارای پیوندی به طول ۱۲۱ پیکومتر و انرژی پیوندی ۴۹۸ کیلو ژول بر مول است.[34] مولکول اکسیژن توسط شکلهای پیچیده حیات مانند حیوانات مصرف میشود. اکسیژن سهاتمی (O۳) که بهصورت متداول با نام ازون شناخته میشود، یکی از فعالترین دگرشکلهای اکسیژن است که بهخاطر فعالیت بالایش میتواند به بافتهای ریه انسان آسیب بزند.[35]

ازون در لایه بالایی اتمسفر تولید میشود، جایی که اکسیژن مولکولی با اکسیژن اتمی حاصل از تفکیک اکسیژن مولکولی توسط پرتوهای ماورای بنفش خورشیدی، ترکیب میشود. بهعلت اینکه ازون نور ماورای بنفش را بهشدت جذب میکند، لایه ازون در لایه بالایی اتمسفر بهمانند لایهای محافظ عمل میکند و از کره زمین را در مقابل پرتوهای مخرب ماورای بنفش محافظت میکند. در نزدیکی سطح زمین، ازون بهعنوان آلایندهای شناخته میشود که در دود خودروها به عنوان محصول جانبی حضور دارد.[35] در ارتفاع واقع در مدار نزدیک زمین، اکسیژن اتمی لازم برای ایجاد اثر خورندگی بر روی بدنه فضاپیماها وجود دارد.[36]
اکسیژن چهار اتمی که مولکولی شبهپایدار است، در سال ۲۰۰۱ کشف شد.[37][38] فرض بر این بود که این گونه در یکی از شش حالت جامد اکسیژن وجود دارد. درسال ۲۰۰۶ اثبات شد که این گونه که مجموعهای از خوشههای اکسیژن هشت اتمی (O۸) و دارای شبکه بلوری ششگوشه است را میتوان بهوسیله قرار دادن اکسیژن مولکولی در فشاری به میزان ۲۰ گیگاپاسکال، تولید کرد.[39] این خوشه دارای قدرت اکسایشی بالاتری در مقایسه با اکسیژن دواتمی (O۲) یا سهاتمی (O۳) دارد و ممکن است بتواند جایگزین خوبی در سوخت موشک باشد.[37][38]
در سال ۱۹۹۰، زمانی که اکسیژن تحت فشاری به اندازه ۹۶ گیگاپاسکال قرار گرفت، فازی فلزی از اکسیژن مشاهده شد[40] و در سال ۱۹۹۸ مشخص شد که چنانچه این فاز بهدست آمده در دماهای پایین قرار گرفته شود، از خود خصلت ابررسانایی بروز میدهد.[41]

اکسیژن در مقایسه با نیتروژن راحتتر در آب حل میشود و همچنین حلالیت آن در آب شیرین بیشتر از آب شور است. آب در تعادل با هوا، تقریباً شامل یک مولکول حل شده اکسیژن به ازای هر دو مولکول نیتروژن است (نسبت ۴:۱) درحالیکه در اتمسفر، نسبت نیتروژن چهار برابر اکسیژن است. میزان حلالیت اکسیژن در آب به دما وابستهاست، بهطوری که میزان حل شدن آن در آب در دمای صفر درجه سانتیگراد و فشار استاندارد یک اتمسفر (۱۰٫۲ میلیلیتر بر لیتر)، بسیار بیشتر از مقدار مشابه در دمای ۲۰ درجه سانتیگراد (۶٫۸ میلیلیتر بر لیتر) است.[42] در دمای ۲۵ درجه سانتیگراد و فشار استاندارد یک اتمسفر (۱۰۱٫۳ کیلوپاسکال)، آب شیرین حاوی حدود ۶٫۳ میلیلیتر اکسیژن در هر لیتر است، در حالیکه این مقدار برای آب دریا برابر با ۵ میلیلیتر در هر لیتر است.[42] در دمای ۵ درجه سانتیگراد، میزان حلالیت اکسیژن به ۹٫۱ میلیلیتر (تقریباً ۵۰ درصد بیشتر از دمای ۲۵ درجه سانتیگراد) برای هر لیتر از آب شیرین میرسد.[42] میزان حلالیت در دمای مشابه برای آب دریا برابر با ۷ میلیلیتر برای هر لیتر از آب دریا است.[42]
اکسیژن در دمای ۹۰٫۲۰ کلوین (۱۸۲٫۹۵- سلسیوس، ۲۹۷٫۳۱- فارنهایت) متراکم و در دمای ۲۱۸٫۷۹- درجه سانتیگراد منجمد میشود.[43] هم اکسیژن مایع و هم اکسیژن جامد، هردو موادی شفاف با سایهای آبیرنگ هستند که براثر جذب نور قرمز ایجاد میشود.[توضیح 5] اکسیژن مایع دارای خلوص بالا معمولاً توسط تقطیر جزء به جزء هوای مایع شده بهدست میآید.[44] اکسیژن مایع همچنین میتواند توسط متراکم کردن هوا با استفاده نیتروژن مایع نیز تولید شود.[45] اکسیژن مادهای بهشدت واکنشپذیر است و باید از مواد دارای قابلیت احتراق دور نگه داشته شود.[45]
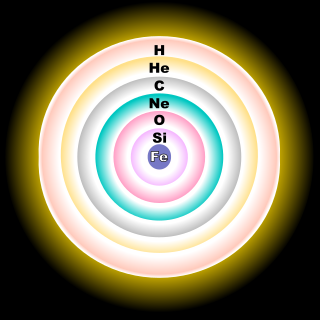
بهطور طبیعی اکسیژن به شکل سه ایزوتوپ اکسیژن-۱۶ (۱۶O)، اکسیژن-۱۷ (۱۷O) و اکسیژن-۱۸ (۱۸O) وجود دارد که از میان آنها اکسیژن-۱۶ دارای بیشترین میزان فراوانی است (فراوانی طبیعی: ۹۹٫۷۶۲ درصد).[46]
اغلب اکسیژن-۱۶، در پایان دوره همجوشی هلیوم در ستارگان کلانجرم و طی فرایند سوختن نئون تولید میشود.[47] اکسیژن-۱۷، بهطور عمده بر اثر سوختن هیدروژن و تبدیل آن به هلیوم طی چرخه CNO تولید میشود.[47] اغلب اکسیژن-۱۸ زمانی تولید میشود که نیتروژن-۱۴ (۱۴N) که خود غالباً در چرخه CNO تولید میشود، هستههای هلیوم-۴ (۴He) را بهدام میاندازد.[47]
در مجموع چهارده نوع اکسیژن رادیواکتیو شناسایی شدهاست. پایدارترین آنها اکسیژن-۱۵ (۱۵O) با نیمهعمری برابر ۱۲۲٫۲۴ ثانیه و اکسیژن-۱۴ با نیمهعمر ۷۰٫۶۰۶ ثانیه است.[46] تمامی ایزوتوپهای دیگر دارای نیمهعمری برابر با ۲۷ ثانیه هستند و اغلب آنها دارای زمان نیمهعمری کمتر از ۸۳ میلیثانیه هستند.[46]
رایجترین حالت واپاشی هستهای ایزوتوپهای سبکتر از ۱۶O نشر پوزیترون[48][49][50] و تبدیل شدن به نیتروژن است و متداولترین حالت برای ایزوتوپهای سنگین تر از ۱۸O واپاشی بتا و تبدیل شدن به فلوئور است.[46]
از لحاظ جرمی، اکسیژن یکی از فراوانترین عناصر بر روی زمین است. این عنصر، بهلحاظ فراوانی، بعد از هیدروژن و هلیوم، سومین عنصر شیمیایی در کیهان محسوب میشود.[5] در حدود ۰٫۹ درصد از خورشید را از اکسیژن تشکیل شدهاست.[3] این عنصر ۴۹٫۲ درصد پوسته زمین را شامل میشود.[52]
با در نظر گرفتن مشارکت اکسیژن در ساختار سیلیسیم دیاکسید، اکسیژن فراوانترین عنصر پوسته زمین و همچنین فراوانترین عنصر موجود در اقیانوسها است بهطوری که ۸۸٫۸ درصد جرمی اقیانوسها را تشکیل میدهد.[3][5][توضیح 6] در مقایسه با سایر سیارههای منظومه شمسی، زمین با داشتن مقدار زیادی اکسیژن، سیارهای متفاوت است. مریخ (با حجم ۰٫۱ درصد O۲) و زهره مقدار بسیار کمتری دارا میباشد. O۲ پیرامون آن سیارات با تابش نور ماوراء بنفش بر روی مولکولهای حاوی اکسیژن مانند دیاکسید کربن تولید میشود.[53]

نقشه جهانی نشان میدهد که اکسیژن سطح دریا در اطراف استوا خارج شده و به سمت قطبها افزایش مییابد. آب سرد در مقایسه با آب گرم، مقدار اکسیژن (O۲) حل شده بیشتری دارد. افزایش غیرمنتظره غلظت بالای گاز اکسیژن در کره زمین نتیجه چرخه اکسیژن است. این چرخه زیست ژئوشیمیایی حرکت اکسیژن در داخل و بین سه منبع اصلی آن روی زمین را توصیف میکند: اتمسفر، بیوسفر و لیتوسفر. عامل اصلی محرک چرخه اکسیژن فتوسنتز است، که مسئول اتمسفر مدرن زمین است. فتوسنتز اکسیژن را وارد اتمسفر میکند، در حالی که تنفس یاختهای، پوسیدگی و احتراق آن را از اتمسفر خارج میکند. در تعادل موجود، تولید و مصرف به همان میزان اتفاق میافتد.[54]
اکسیژن آزاد همچنین در مایعات داخل بدن نیز وجود دارد. افزایش قابلیت انحلال O۲ در در دماهای پایینتر آب پیامدهای مهمی برای زندگی اقیانوسها دارد بهطوری که آبهای نزدیک نواحی قطبی، بهعلت میزان بیشتر اکسیژن، دارای تنوع حیات بیشتری در مقایسه آبهای نواحی گرمتر است.[55] آب آمیختهشده به مواد مغذی گیاهی مانند نیتراتها یا فسفاتها ممکن است رشد جلبکها را با فرایندی به نام اوتریفیکاسیون تحریک کند و پوسیدگی این ارگانیسمها و سایر مواد بیولوژیکی ممکن است باعث کاهش محتوای O۲ در بدن آبهای اوتریفیک شود. افزایش بیش از حد مواد طبیعی یا مصنوعی در یک محیط آبی میتوانند در جایگاه مواد مغذی برای ارگانیسمها مانند هومینها یا مواد شیمیایی مانند نیترات یا فسفات باشند که از طریق کود شیمیایی یا پساب وارد آب شدهاند. دانشمندان این جنبه کیفیت آب را با اندازهگیری میزان اکسیژن بیوشیمیایی آب یا مقدار O۲ مورد نیاز، که شاخصی برای اندازهگیری مواد آلی قابل تجزیه توسط باکتریها در آب است برای بازگرداندن آن به غلظت طبیعی ارزیابی میکنند.[5]

دیرینهاقلیمشناسان نسبت اکسیژن-۱۸ به اکسیژن-۱۶ در پوستهها و اسکلت جانواران دریایی را اندازه میگیرند تا با کمک آن تغییرات آب و هوایی میلیونها سال پیش را تعیین نمایند. مولکولهای آب دریا که حاوی ایزوتوپ سبکتر اکسیژن-۱۶ هستند، سریعتر از مولکولهای آبی که متشکل از ۱۲ درصد اتم اکسیژن-۱۸ هستند، تبخیر میشوند و این تفاوت سرعت تبخیر با کاهش دما، افزایش مییابد.[5] در طول دورههای با دمای کمتر، برف و بارانی که ناشی از آب تبخیر شده از سطح اقیانوسها هستند، دارای اکسیژن-۱۶ بیشتری هستند و درنتیجه این موضوع سبب میشود که میزان غلظت مولکولهای دارای اکسیژن-۱۸ در آب اقیانوسها بیشتر میشود. جانداران دریایی با مصرف مولکولهای آب حاوی اتم اکسیژن-۱۸ که به اثر تبخیر شدن مولکولهای با اکسیژن-۱۶، بیشتر از قبل دردسترس قرار گرفتهاند، آنها را وارد ساختمان شیمیایی استخوانها و پوستههای خود مینمایند.[5] دیرینهاقلیمشناسان همچنین میتوانند نسبت اکسیژن-۱۸ به اکسیژن-۱۶ را بهصورت مستقیم و با اندازهگیری نسبت مولکولهای آب موجود بهدست آمده از مغزه یخی نمونههای چندهزار ساله تهیه شده از اعماق یخها به دست آورند.[56]
زمینشناسان مقدار نسبی ایزوتوپهای اکسیژن در نمونههای زمین، ماه، مریخ و شهابسنگها را تعیین کردهاند اما تاکنون در اندازهگیری نسبت مقادیر این ایزوتوپها در خورشید، ناموفق بودهاند. باور براین است که مقدار این نسبت برای خورشید معادل این نسبت در زمان تشکیل سحابی اولیه است. بررسی نوارهای سیلیسیمی قرار گرفته در معرض پرتوهای خورشیدی در فضا نشان دادهاست که میزان اکسیژن-۱۶ در خورشید بیشتر از زمین است. این اندازهگیری میگوید که فرایند نامعلومی موجب کاهش میزان اکسیژن-۱۶ قرص پیشسیارهای پیش از زمان تشکیل زمین شدهاست.[57]
اکسیژن دو نوار جذبی در طیفسنجی از خود نشان میدهد که در طول موجهای ۶۸۷ و ۷۶۰ نانومتر دیده میشوند. دانشمندان علوم سنجش از دور پیشنهاد کردهاند که با استفاده از پرتوهای دریافتی از طریق یک ماهواره دیدبانی زمین و بررسی شدت این نوارها، میتوان به وضعیت سلامت سیارات دوردست دست یافت. این روش برمبنای این حقیقت است که با کمک این نوارهای جذبی میتوان میان بازتاب ناشی از پوشش گیاهی و بازتاب فلوئورسانسی تمایز قایل شد.[58] از نظر فنی اندازهگیری به دلیل پایین بودن نسبت سیگنال به نویز و ساختار فیزیکی پوشش گیاهی دشوار است. اما به عنوان یک روش برای نظارت بر چرخه کربن از ماهوارهها در مقیاس جهانی ارائه شدهاست.[59]

حالت اکسایش اکسیژن تقریباً در کلیه ترکیبات شناخته شده اکسیژن ۲− است. حالت اکسایش ۱− در چند ترکیب مانند پراکسیدها یافت میشود.[60] ترکیبات حاوی اکسیژن در سایر حالات اکسایش بسیار نادر است: ۱/۲- (سوپر اکسیدها)، ۱/۳ (ازونیدها)، ۰ (عنصری، هیپوفلورو اسید)، ۱/۲+ (دیاکسیژنیل)، ۱ (دیاکسیژن دیفلوئورید)، و ۲+ (دیاکسید اکسید).[61]
آب (H
۲O) اکسید هیدروژن و آشناترین ترکیب اکسیژن است. در یک مولکول آب، هر یک از دو اتم هیدروژن موجود از طریق یک پیوند کووالانسی و مستقل با اتم اکسیژن مرکزی پیوند میدهند اما آنها علاوهبر این اتصال، دارای یک نیروی جاذبه اضافی نسبت به هر اتم اکسیژن موجود در مولکولهای مجاور هستند که مقدار آن حدود ۲۳٫۳ کیلوژول برمول برای هر اتم هیدروژن است.[62] این پیوندهای هیدروژن بین مولکولهای آب آنها را تقریباً ۱۵درصد نزدیکتر از آنچه انتظار میرود در یک مایع ساده که فقط دارای نیروی واندروالسی باشد، قرار دادهاست.[63][توضیح 7]
با توجه به الکترونگاتیوی بالا، اکسیژن تقریباً با تمام عناصر دیگر در دماهای بالا پیوندهای شیمیایی تشکیل میدهد تا اکسید آن را تولید کند. با این حال، برخی از عناصر بهطور مستقیم تحت شرایط عادی فشار و دما مانند آهن، آهن اکسید تشکیل میدهند. سطح فلزاتی مانند آلومینیوم و تیتانیم در حضور هوا اکسید میشود و با یک لایه نازک اکسید پوشیده شده که فلز را غیرفعال میکند و موجب کند شدن خوردگی میگردد. برخی از اکسیدهای فلزی در طبیعت به عنوان ترکیبات غیر استوکیومتری یافت میشوند و مقدار فلز کمتری از حالت استوکیومتری نشان میدهند برای نمونه، ماده معدنی وستیت با فرمول مولکولی FeO به صورت Fe۱-xO نوشته میشود جایی که x معمولاً در حدود ۰٫۰۵ است.[64]

ترکیب یک یا چند اتم اکسیژن و یک یا چند اتم از عناصر دیگر تشکیل اکسید میدهد. اگر ترکیب اکسیژن با فلز باشد اکسید بازی و اگر اکسیژن با نافلز باشد اکسید اسیدی تشکیل میشود. زنگ زدن عبارتی است که به اکسایش آهن گفته میشود.[65] اکسایش آهن معمولاً از طریق واکنش با اکسیژن صورت میگیرد. اما نوعهای دیگری از زنگ زدن وجود دارد که حاصل واکنش آهن و کلر است که به آن زنگ سبز میگویند.[66]
اکسیژن به عنوان یک ترکیب در مقادیر کمی به شکل کربن دیاکسید (CO۲) در جو موجود است. سنگ پوسته زمین از قسمتهای بزرگی از اکسیدهای سیلیسیم به صورت سیلیسیم دیاکسید (SiO۲) که در گرانیت و کوارتز یافت میشود، آلومینیوم (آلومینیوم اکسید (Al۲O۳)، در بوکسیت و کرندوم)، آهن اکسید (Fe۲O۳)، (در هماتیت و زنگ زدگی) و کلسیم (کلسیم کربنات (CaCO۲)، در سنگ آهک). بقیه پوسته زمین نیز از ترکیبات اکسیژن، به ویژه سیلیکاتهای پیچیده مختلف (در کانیهای سیلیکات) ساخته شدهاست.[67][68] گوشته زمین، که جرم بسیار بیشتری از پوسته دارد، تا حد زیادی از سیلیکاتهای منیزیم و آهن تشکیل شدهاست.[69] سیلیکات محلول در آب به شکل Na۲SiO۳ ،Na۴SiO۴ و Na۲Si۲O۵ بهعنوان مواد شوینده و چسب استفاده میشود.[3] اکسیژن همچنین به عنوان یک لیگاند برای فلزات انتقالی عمل میکند و موجب تشکیل کمپلکسهای فلزات واسطه–دیاکسیژن[lower-alpha 19] میشود که مشخصه آنها، پیوند O۲– فلز است. این دسته از ترکیبات شامل هم پروتئینهای هموگلوبین و میوگلوبین است.[70] یکی از واکنشهای غیرمعمول اکسیژن، واکنش با پلاتین هگزافلوئورید (PtF۶) است که منجر به تولید گونه −O۲+PTF۶ میشود.[lower-alpha 20][3]

پیوند کربن-اکسیژن یک پیوند کووالانسی میان کربن و اکسیژن است که در شیمی آلی و زیستشیمی به فراوانی یافت میشود.[71] اکسیژن ۶ الکترون در لایهٔ ظرفیت دارد که بیشتر، دوتای آنها را در پیوند با کربن درگیر میکند و چهار الکترون دیگر به صورت الکترونهای غیر پیوندی باقی میماند. کربن و اکسیژن در گروههای عاملی پیوند دوگانه میسازند که در این صورت با نام ترکیبهای کربونیل شناخته میشوند؛ کتون، استر، کربوکسیلیک اسید و بسیاری مواد دیگر همگی از این دست اند.[71]
مهمترین ترکیبات آلی حاوی اکسیژن عبارتاند از: (در این ترکیبات "R" یک گروه آلی است): الکلها (R-OH)، اترها (ROR)، کتون (R-CO-R)، آلدهیدها (R-CO-H)، کربوکسیلیک اسیدها (R-COOH)، استرها (R-COO-R)، انیدرید اسیدها (R-CO-O-CO-R)، و آمیدها (R-CO-NR۲).[71] بسیاری از حلالهای مهم آلی که حاوی اکسیژن هستند عبارتاند از: استون، متانول، اتانول، ایزوپروپانول، فوران، تتراهیدروفوران، دیاتیل اتر، دیوکسان، اتیل استات، دیمتیل فرمآمید، دیمتیل سولفوکسید و استیک اسید.[72]
استون (CH۳-CO-CH۳) بهعنوان یکی از حلالهای مهم مورد استفاده در صنعت[73] و فنول (C۶H۵OH) بهعنوان یک پیشماده مهم در سنتز بسیاری از مواد مختلف[74] محسوب میشوند. سایر ترکیبات مهم آلی که حاوی اکسیژن هستند، عبارتاند از: گلیسیرین، فرمالدهید، گلوتار آلدئید، سیتریک اسید، استیک انیدرید و استامید. اپوکسایدها اترهایی هستند که در آنها اتم اکسیژن بخشی از یک ترکیب حلقوی سه عضوی است. این ساختارها که بسیار سمی هستند[75] دارای کاربردهای متنوعی هستند[76] و در فرمول ترکیبات شیمیایی و طبیعی متعددی دیده میشوند.[77][78]
اکسیژن به صورت خود به خودی زیر دمای اتاق در یک فرایند به نام خوداکسایش با بسیاری از ترکیبات آلی واکنش نشان میدهد.[3] بیشتر ترکیبات آلی که حاوی اکسیژن هستند با واکنش مستقیم اکسیژن ساخته نمیشوند. ترکیبات آلی مهم در صنعت و تجارت که با اکسایش مستقیم یک پیش ساز ساخته میشوند شامل اتیلن اکسید و پراستیک اسید است.[3]
| گروه | فرمول | فرمول ساختاری | پیشوند | پسوند | مثال |
|---|---|---|---|---|---|
| هیدروکسیل | ROH | هیدروکسی- | -اُل | متانول | |
| آلدهید | RCHO |  |
فرمیل- | -ال |  استالدهید (اتانال) |
| کربونیل | R'COR |  |
اُکسو- | -اُن | بوتانون (اتیل متیل کتون) |
| کربوکسیل | RCOOH | کربوکسی- | -اوییک اسید | استیک اسید (استیک اسید) | |
| استر | R'COOR | آلکوکسی کربونیل- | آلکیل آلکانوات | اتیل بوتیرات (اتیل بوتیرات) | |
| انیدرید اسید | R'COOCOR | انیدرید | بوتیریک انیدرید | ||
| پراکسید | R'OOR | پراکسی- | پراکسید | دی-ترشری-بوتیلپراکسید | |
| اتر | R'OR | آلکوکسی- | اتر | دیاتیل اتر |


در طبیعت، اکسیژن آزاد، بهوسیله تفکیک نوری در طول فرایند فتوسنتز تشکیل میشود. مطابق برخی تخمینها، جلبک سبز و سیانوباکتریهای موجود در محیطهای آبی، عامل تولید بیش از ۷۰ درصد از اکسیژن تولید شده بر روی زمین هستند و ۳۰ درصد دیگر توسط گیاهان روی سطح زمین تولید میشود.[79] اگرچه برخی تخمینهای دیگر از مشارکت بالاتر اقیانوسها در تولید اکسیژن موجود در اتمسفر حکایت دارند، بعضی دیگر مقادیر کمتری پیشنهاد میدهند بهصورتی که پیشنهاد میکنند، ۴۵ درصد اکسیژن اتمسفری در هر سال توسط اقیانوسها تأمین میشود.[80]
واکنش کلی و ساده شده برای فتوسنتز بهصورت زیر است:[81]
۶CO۲ + ۶H۲O + فوتونها → C۶H۱۲O۶ + ۶O۲
که میتوان واکنش را به زبان نوشتاری نوشت:
گلوکز + دیاکسیژن → کربن دیاکسید + آب + نور خورشید
تکامل اکسیژن نورکافتی در غشای تیلاکوئید موجودات فتوسنتزی رخ میدهد و به انرژی چهار فوتون نیاز دارد.[توضیح 8] مراحل زیادی انجام میشود، اما نتیجه آن تشکیل یک گرادیان پروتون در سراسر غشای تیلاکوئید است که برای سنتز آدنوزین تریفسفات (ATP) از طریق فسفردار شدن نوری[lower-alpha 21] استفاده میشود.[82] O۲ باقیمانده پس از تولید مولکول آب، در جو آزاد میشود.[توضیح 9]
انرژی شیمیایی اکسیژن در میتوکندری آزاد میشود تا در طول فسفرگیری اکسایشی آدنوزین تریفسفات تولید شود.[83] واکنش تنفس هوازی در واقع معکوس فتوسنتز است و به شرح زیر ساده میشود:
C۶H۱۲O۶ + ۶O۲ → ۶CO۲+ ۶H۲O+ 2880 kJ/mol
در مهرهداران، O۲ از طریق غشاهای موجود در ریهها و گلبولهای قرمز خون واپخش میشود. هموگلوبین به O۲ متصل میشود و رنگ خون را از قرمز مایل به آبی به قرمز روشن تغییر میدهد.[35] همچنین CO۲ از طریق اثر بور از قسمت دیگری از هموگلوبین آزاد میشود. حیوانات دیگر از هموسیانین (صدف و برخی از بندپایان) یا هومیرترینین[lower-alpha 22] (عنکبوت و شاهمیگو) استفاده میکنند.[5] یک لیتر خون میتواند ۲۰۰ cm۳ O۲ را در خود حل کند.[5] تا زمان کشف اندامگان بیهوازی، تصور میشد اکسیژن نیاز اولیه برای تمام زندگی موجودات پیچیدهاست.[84]
گونههای فعال اکسیژن مانند سوپرکسید (-O۲) و هیدروژن پراکسید (H۲O۲) محصولات جانبی واکنشپذیری هستند که براثر مصرف اکسیژن توسط جانداران تولید میشود.[5] بخشهایی از سیستم ایمنی موجودات پیچیده برای تخریب میکروبهای مهاجم، پراکسید، سوپراکسید، و اکسیژن یکتایی تولید میکنند. گونههای اکسیژن فعال نقش مهمی در فرایندی موسوم به پاسخ فوقحساس[lower-alpha 23] در گیاهان در زمان حمله عوامل بیماریزا دارند.[82][توضیح 10]
اکسیژن که در ابتدای دوران شکلگیری حیات بر روی زمین با مقدار بسیار زیادتری در مقایسه با شرایط فعلی وجود داشتهاست، موجب آسیب به موجودات بیهوازی اجباری میشود. در حدود ۲٫۵ میلیارد سال قبل و طی رخدادی بهنام رویداد بزرگ اکسیژنی میزان اکسیژن موجود روی زمین شروع به افزایش کرد و این اتفاق در حدود یک میلیارد سال پس از نمایان شدن اولین موجودات زنده بر روی زمین رخ داد.[85][86] یک انسان بالغ، با سرعت ۱٫۸ تا ۲٫۴ گرم اکسیژن در دقیقه تنفس میکند.[87] با این احتساب، در هر سال بیش از ۶ میلیارد تن اکسیژن توسط مجموع انسانها مصرف میشود.
| واحد | فشار گاز ریوی | گاز خون شریانی | گاز خون سیاهرگ | منبع |
|---|---|---|---|---|
| kPa | ۱۴٫۲ | ۱۱–۱۳ | ۴٫۰–۵٫۳ | [88] |
| mmHg | ۱۰۷ | ۷۵-۱۰۰ | ۳۰ -۴۰ | [89][90] |
فشار نسبی اکسیژن آزاد در بدن موجود مهرهدار در دستگاه تنفسی دارای بالاترین میزان خود است و در سایر بخشها مانند سرخرگها، بافتهای محیطی و سیاهرگها کاهش مییابد. منظور از فشار نسبی، فشاری است که اکسیژن خالص در زمان اشغال حجم مشخصی، از خود نشان میدهد.[91]

اکسیژن آزاد و به شکل گازی در حدود ۳٫۵ میلیارد سال قبل و پیش از اینکه آغازیان و باکتریها فرگشت پیدا کنند، در اتمسفر زمین وجود نداشتهاست. اولین نشانههای تولید مقادیر قابل ملاحظهای از اکسیژن آزاد به دوره پیشینزیستی دیرینه (بین ۳ تا ۲٫۳ میلیارد سال قبل) بازمیگردد.[92] فرایند خروج اکسیژن آزاد از اقیانوسها به ۳ تا ۲٫۷ میلیارد سال قبل بازمیگردد که این فرایند موجب شد تا ۱٫۷ میلیارد سال قبل، سطح اکسیژن اتمسفر به ۱۰ درصد افزایش یابد.[92][93]
مقدار زیاد اکسیژن حل شده در آب و اکسیژن آزاد موجود در اتمسفر، ممکن است عامل اصلی انقراض اندامگان بیهوازی در طول رویداد بزرگ اکسیژنی در حدود ۲٫۴ میلیارد سال قبل باشد.تنفس سلولی اکسیژن در تمامی موجودات یوکاریوتی از جمله موجودات پرسلولی پیچیده مانند گیاهان و جانوران انجام میشود. تنفس سلولی با استفاده از اکسیژن مولکولی، جانداران هوازی را قادر ساخت تا بتوانند آدنوزین تریفسفات بیشتری در مقایسه با جانداران بیهوازی تولید کنند.[94]
از آغاز دوران کامبرین در حدود ۵۴۰ میلیون سال قبل، سطح اکسیژن موجود در اتمسفر دارای نوسان بودهاست بهطوری که بین مقادیر ۱۵ تا ۳۰ درصد حجمی در حال تغییر بودهاست.[95] با نزدیک شدن به پایان دوران کربنیفر، سطح اکسیژن اتمسفر به ۳۵ درصد رسید[95] که این موضوع احتمالاً عاملی بودهاست که منجر به افزایش اندازه حشرات و دوزیستهای آن دوره شدهاست.[96] تغییرات در میزان اکسیژن در اتمسفر، بر روی آب و هوای گذشته نیز تأثیر داشتهاست. زمانی که سطح اکسیژن کاهش مییابد، چگالی اتمسفر افت میکند و درنتیجه تبخیر سطحی افزایش و در نتیجه بارندگی افزایش و دمای هوا افزایش مییابد.[97]
با سرعت فتوسنتز در شرایط فعلی، حدود دوهزار سال طول میکشد تا بهاندازه تمام اکسیژن فعلی موجود در اتمسفر، اکسیژن تولید شود.[98]
روشهای تولید برای اکسیژن به مقدار عنصر مورد نظر بستگی دارد. برخی از روشهای آزمایشگاهی شامل موارد زیر است.[99]
منگنز دیاکسید واکنشهای بسیاری را شامل میشود که منجر به تولید اکسیژن میگردد. رایجترین روش آزمایشگاهی برای تولید اکسیژن، گرم کردن مخلوط پتاسیم کلرات و منگنز دیاکسید است. پتاسیم کلرات به وسیله اکسیدهای فلزات واسطه کاتالیز میشود. دمای لازم برای تأثیر تکامل اکسیژن توسط کاتالیزور از ۴۰۰ درجه سانتیگراد به ۲۵۰ درجه سانتیگراد کاهش مییابد. در تهیه اکسیژن از کلرید پتاسیم فقط پتاسیم کلرات تجزیه میشود و هیچ پرکلراتی ایجاد نمیشود.
اکسیژن در اثر تجزیه سدیم کلرات در دمای بالا تولید میشود[100]
پتاسیم پرمنگنات همچنین با گرم شدن اکسیژن آزاد میکند.
ویلهلم شیله و جوزف پریستلی از جیوه (II) اکسید در تهیه اکسیژن استفاده کردند.[99]
در آزمایشگاه داخل دانشگاه، اکسیژن از تجزیه پتاسیم کلرات تهیه میشود. با این حال، پتاسیم کلرات میتواند خطرناک باشد و تهیه آن سخت است. واکنش پتاسیم کلرات به علت گرمازا بودن و انبساط گازها میتواند باعث انفجار شود. روش ایمنتر تهیه اکسیژن از محلول هیدروژن پراکسید رقیق است. در این روش پتاسیم کلرات به یک لوله آزمایش با مقدار کمی دیاکسید منگنز به عنوان کاتالیزور اضافه میشود. از لولههای شیشهای برای هدایت اکسیژن به یک شیشه وارونه که در یک وان آب قرار گرفته استفاده میشود.[102]

گازهای خالص را میتوان ابتدا با خنک کردن هوا تا مایع شدن آن جدا کرد، سپس بهطور انتخابی اجزا آن را در دماهای مختلف جوش تقطیر کرد. این فرایند میتواند گازهای با خلوص بالا تولید کند اما انرژی بر است. این فرایند در اوایل قرن ۲۰ توسط کارل فن لینده اختراع شد و امروزه نیز برای تولید گازهای با خلوص بالا استفاده میشود. او این روش را در سال ۱۸۹۵ توسعه داد.[103] فرایند جداسازی سرمایشی برای دستیابی به بازدهی خوب به یکپارچه سازی مبدلهای حرارتی و ستونهای جداسازی احتیاج دارد و تمام انرژی سردخانه از طریق فشرده سازی هوا در ورودی واحد تأمین میشود.[104][105][106] سالانه صد میلیون تن اکسیژن از هوا با استفاده از دو روش اصلی برای مصارف صنعتی استخراج میشود.[5] متداولترین آن، شامل تقسیم هوای مایع با روش تقطیر جزء به جزء به اجزای مختلف آن است که طی آن نیتروژن بهصورت بخار از نمونه خارج میشود و اکسیژن بهشکل مایع باقی میماند. در این روش ابتدا مخلوط هوا تا دمای میعان سرد میشود تا هوای مایع ایجاد شود. در مرحله بعد به وسیله یک برج تقطیر و افزایش تدریجی دما، اجزا سازنده هوا بر اساس دمای جوش از یکدیگر جدا میشود. این روش یکی از روشهای متداول برای تولید نیتروژن و اکسیژن به صورت انبوه است.[107]
روش اصلی دیگر برای بهدست آوردن اکسیژن، عبور جریانی از هوای تمیز و خشک از طریق بستر غربالهای مولکولی زئولیت است که نیتروژن را جذب میکند و اجازه میدهد جریانی از گاز شامل ۹۰ تا ۹۳ درصد اکسیژن از آن عبور کند.[5] بهطور همزمان، با کاهش فشار محفظه و وارد کردن بخشی از اکسیژن جدا شده در بستر تولیدکننده در خلاف جهت بستر دیگر زئولیت اشباع شده با نیتروژن این گاز را آزاد میکند. پس از هر چرخه کامل، بسترها جابهجا میشوند، بنابراین امکان تأمین مداوم اکسیژن گازی از طریق خط لوله فراهم میشود.. این امر به عنوان جذب نوسان فشار[lower-alpha 24] شناخته شدهاست و برای تولید اکسیژن در مقیاس کوچک استفاده میشود. گاز اکسیژن بهطور فزاینده ای توسط این فناوریهای غیر کریوژن حاصل میشود.[108]

همچنین گاز اکسیژن از طریق الکترولیز آب به اکسیژن مولکولی و هیدروژن تولید میشود، برای این کار باید جریان مستقیم (DC) استفاده شود. در صورت استفاده از جریان متناوب (AC)، گازهای موجود در هر شاخه شامل هیدروژن و اکسیژن به نسبت ۲ به ۱ انفجاری تشکیل میشوند. برای امکان هدایت جریان الکتریکی از نسبت کمی نمک یا اسید استفاده میشود. در این روش اغلب از اسیدهای قوی مانند سولفوریک اسید (H۲SO۴)، و بازهای قوی مانند پتاسیم هیدروکسید (KOH) و سدیم هیدروکسید (NaOH) به دلیل توانایی هدایت قوی به عنوان الکترولیت استفاده میشوند. در انتخاب الکترولیت باید دقت شود زیرا یک آنیون از الکترولیت با یونهای هیدروکسید برای ترک یک الکترون رقابت میکند. یک آنیون الکترولیت با پتانسیل الکترود استاندارد کمتر از هیدروکسید به جای هیدروکسید، اکسید میشود و هیچ گاز اکسیژنی تولید نمیشود. یک روش مشابه تکامل الکتروکاتالیستی اکسیژن از اکسیدها به اکسیاسیدها است. از کاتالیزورهای شیمیایی نیز میتوان استفاده کرد، مانند ژنراتورهای شیمیایی اکسیژن یا شمعهای اکسیژن که به عنوان بخشی از تجهیزات پشتیبانی از زندگی در زیر دریاییها مورد استفاده قرار میگیرند و در صورت بروز مواقع اضطراری کاهش فشار، بخشی از تجهیزات استاندارد در هواپیماهای تجاری هستند. یکی دیگر از فناوری جداسازی هوا، وارد کردن نیرو برای انحلال هوا از طریق غشاهای سرامیکی مبتنی بر دیاکسید زیرکونیوم است که با فشار زیاد یا با جریان الکتریکی صورت میگیرد تا اکسیژن خالص تولید گردد، برای تولید گازهای خنثی اکسیژن خالص است.[5]
روشهای ذخیرهسازی اکسیژن شامل کپسول اکسیژن با فشار بالا، فوق سردسازی و ترکیبات شیمیایی است. به دلایل اقتصادی اکسیژن اغلب به شکل عمده به صورت مایع در تانکرهای عایق مخصوص حمل میشود، زیرا یک لیتر اکسیژن مایع معادل ۸۴۰ لیتر اکسیژن گازی در فشار اتمسفر و ۲۰ درجه سلسیوس (۶۸ درجه فارنهایت) است.[5] چنین تانکرهایی برای پر کردن مجدد مخازن انبوه اکسیژن مایع، که در خارج از بیمارستانها و سایر موسساتی که نیاز به حجم زیادی از گاز اکسیژن خالص دارند، استفاده میشود. اکسیژن مایع از طریق مبدلهای گرمایی منتقل میشود، که مایع فوق سرد را قبل از ورود به ساختمان به گاز تبدیل میکنند. اکسیژن نیز در سیلندرهای کوچکتر که حاوی گاز فشردهاست ذخیره میشود و حمل میشود. شکلی که در کاربردهای پزشکی قابل حمل و برشکاری اکسیژنی مفید است.[5]

۵۵ درصد از تولید اکسیژن جهان در تولید فولاد مصرف میشود. ۲۵٪ دیگر آن به صنایع شیمیایی اختصاص یافتهاست. ۲۰٪ باقیمانده، بیشتر برای کاربردهای دارویی، برش به وسیله شعله، به عنوان اکسیدکننده موجود در سوخت موشک و تصفیه آب استفاده میشود.[5]

جذب اکسیژن از هوا هدف اساسی تنفس است، بنابراین از مکملهای اکسیژن در پزشکی استفاده میشود. این روش درمانی نه تنها سطح اکسیژن خون را افزایش میدهد، بلکه اثر جانبی مقاومت در برابر جریان خون در بسیاری از انواع ریههای بیمار را کاهش میدهد و باعث میشود که پمپاژ قلب راحت تر شود. از اکسیژندرمانی برای درمان آمفیزم، سینهپهلو، برخی از اختلالات قلبی (نارسایی قلب)، برخی از اختلالات ناشی از افزایش فشار سرخرگ ریوی و هر بیماری که بر توانایی بدن در مصرف و استفاده از اکسیژن تأثیر بگذارد استفاده میشود.[3]
به دلیل انعطافپذیری روشهای درمانی وسایل قابل حمل در بیمارستانها و همچنین خانه بیماران مورد استفاده قرار میگیرند. از چادرهای اکسیژن نیز به عنوان مکملهای اکسیژن مورد استفاده قرار میگرفتند اما امروزه ماسکهای اکسیژن و کانولای بینی جایگزین آنها شدهاند.[109]
پزشکی پرفشار یک درمان پزشکی است که از اتاقهای اکسیژن مخصوص برای افزایش فشار نسبی اکسیژن در اطراف بیمار و در صورت نیاز کادر پزشکی استفاده میشود. این درمان شامل اکسیژن درمانی با فشار بیش از حد (HBOT)، استفاده از اکسیژن در فشار بالاتر از فشار اتمسفر، و تسریع درمانی برای بیماری کاهش فشار با هدف کاهش اثرات مضر حبابهای گاز با کاهش اندازه آنها و فراهم کردن شرایط بهبودی بیمار است.[110] مسمومیت با مونوکسید کربن، گانگرن گازی و بیماری ناشی از کاهش ناگهانی فشار با این روش درمان میشوند.[111] افزایش غلظت اکسیژن در ریهها به جابجایی کربن مونوکسید از گروه هموگلوبین کمک میکند.[112][113] گاز اکسیژن برای باکتریهای بی هوازی گازی سمی است، بنابراین افزایش فشار جزئی آن باعث از بین رفتن آنها میشود.[114][115]
بیماری رفع فشار یا فشارکاهی (DCS) در غواصی رخ میدهد که موجب ورود حبابهای گاز بیاثر، اکثر نیتروژن و هلیوم در خون میشود که افزایش فشار اکسیژن در اسرع وقت به حل مجدد حبابها در خون کمک میکند تا این گازهای اضافی از طریق ریهها خارج گردند.[3][116][117]
تجویز اکسیژن نورموباریک[lower-alpha 25] با بالاترین غلظت موجود اغلب به عنوان اولین کمک برای هرگونه صدمه غواصی که ممکن است باعث ایجاد حباب گاز بیاثر در بافتها شود، استفاده میشود.[118][119][120]

کاربرد قابل توجه اکسیژن بهعنوان گاز تنفس کم فشار در لباسهای فضانوردی مدرن وجود دارد که بدن سرنشینان را با گاز تنفسی احاطه میکند. این دستگاهها تقریباً از یک اکسیژن خالص با فشار تقریبی یک سوم فشار معمولی استفاده میکنند که منجر به فشار جزئی طبیعی اکسیژن خون میشود. این تبادل اکسیژن با غلظت بالا در فشار کم برای حفظ انعطافپذیری لباسهای فضایی لازم است.[121][122]
غواصان و خدمه زیردریاییها نیز از اکسیژن مصنوعی متناسب با فشار استفاده میکنند، اما بیشتر آنها از فشار طبیعی یا مخلوطی از اکسیژن و هوا استفاده میکنند. استفاده از اکسیژن خالص یا تقریباً خالص در غواصی در فشارهای بالاتر از سطح دریا عموماً محدود به زمان استراحت، رفع فشار و معالجه اضطراری در عمق نسبتاً کم (عمق ۶ متر یا کمتر) در فشارهای حداکثر ۲٫۸ بار میباشد، جایی که میتوان مسمومیت حاد اکسیژن را بدون خطر غرق شدن کنترل کرد. غواصی عمیقتر نیاز به مخلوط شدن مقدار قابل توجهی از اکسیژن با سایر گازها، از جمله نیتروژن یا هلیوم دارد تا از اثر مسمومیت با اکسیژن جلوگیری شود.[123][124]
ارتفاعزدگی تأثیر منفی ارتفاع زیاد به دلیل رقیق شدن سریع اکسیژن روی انسان است. علائم این بیماری شامل سردرد، استفراغ، خستگی، مشکل در خواب و سرگیجه است. بیماری حاد کوه میتواند به ادم ریه در ارتفاعات بالا (HAPE) همراه با تنگی نفس و ادم مغزی همراه باشد. با کاهش ارتفاع و مصرف مایعات کافی بیماری رو به بهبودی میرود و مصرف ایبوپروفن، استازولامید یا دگزامتازون برای موارد خفیفتر توصیه شدهاست و در موارد شدید نیاز به اکسیژندرمانی دارد.[125][126] این بیماری در ارتفاعهای بالاتر از ۲۵۰۰ متر و افزایش سریع ارتفاع رخ میدهد.[127]
با افزایش ارتفاع هوا رقیقتر میشود و در ارتفاعات بیش از ۵٫۵۰۰ متر هوای موجود نسبت به هوای سطح دریا ۵۰ درصد رقیقتر شدهاست. تولید گلبولهای قرمز پس از چند هفته زندگی در ارتفاعات افزایش مییابد و در نتیجه موجب افزایش غلظت هموگلوبین برای انتقال اکسیژن به بدن میشود همه این مکانیسمها علیرغم سطح اکسیژن پایین، بدن را قادر میسازد تا اکسیژن کافی به هر سلول برسد. در سطح دریا خون ما ۹۸–۹۹٪ اشباع شده از اکسیژن است و در ارتفاع ۳۰۰۰ متری این مقدار به ۸۹–۹۰٪ کاهش می یابد و در قله اورست به ۴۰٪ میرسد.[128] کوهنوردان و هواپیماهای بدون فشار گاهی دارای مکمل اکسیژن هستند. هواپیماهای تجاری تحت فشار دارای اکسیژن اورژانسی هستند و در صورت کمبود فشار کابین بهطور خودکار در اختیار مسافران قرار میگیرد. افت فشار ناگهانی کابین، ژنراتورهای شیمیایی اکسیژن را در بالای هر صندلی فعال میکند و باعث رها شدن ماسکهای اکسیژن میشود. برای شروع جریان اکسیژن، ابتدا باید آنها را به سمت خود بکشید، این کار باعث آن میشود که پین ایمنی سیلندر تولید اکسیژن که توسط یک نخ به ماسکها وصل شدهاست جدا شود که باعث میشود واکنش شیمیایی مورد نیاز برای تولید اکسیژن انجام شود، درون سیلندر سدیم کلرات و پودر آهن وجود دارد[5] که از واکنش گرمازای آنها یک جریان پایدار از گاز اکسیژن تولید میشود.
اکسیژن بهعنوان یک سرخوشی ملایم، سابقه استفاده تفریحی در بارهای اکسیژن و ورزش را دارد. بارهای اکسیژن مؤسساتی هستند که از اواخر دهه ۱۹۹۰ در ژاپن، کالیفرنیا و لاس وگاس ظاهر شدند که افراد، در معرض غلظتی بالاتر از حد طبیعی اکسیژن با هزینه مشخص قرار میگرفتند.[129]
در جنگ جهانی اول، خلبانان همواره مجبور به پرواز در ارتفاعات بالاتر میشدند. از این رو، همیشه با مشکل کمبود اکسیژن هوا دست و پنجه نرم میکردند. از همین رو ماسک اکسیژن همراه کلاه محافظ به یکی از ملزومات خلبانان نظامی تبدیل شد. ورزشکاران حرفهای، به ویژه در فوتبال آمریکایی، گاهی بین بازیها و در زمان استراحت از ماسکهای اکسیژن برای تقویت عملکردشان استفاده میکنند. اثر دارویی استفاده از ماسکهای اکسیژن در این روش مشکوک است و احتمالاً تنها اثری دارونما دارد. مطالعات موجود افزایش عملکرد ناشی تنفس هوای غنی شده با اکسیژن را فقط در صورت تنفس حین ورزش هوازی پشتیبانی میکند.[130]
در کوههای مرتفع فشار جو کمتر است و این بدان معنی است که اکسیژن کمتری برای تنفس در دسترس است.[131][132] و دلیل اصلی بیماری در ارتفاع است. همه کوهنوردان باید با این شرایط سازگار شوند، حتی کوهنوردان حرفهای که قبلاً در ارتفاعات بودهاند.[133] بهطور کلی، کوهنوردان با رسیدن به ارتفاع ۷۰۰۰ متر برای ادامه از کپسول اکسیژن استفاده میکنند. کوهنوردی و صعود در شرایط ویژه تقریباً همیشه با یک برنامهریزی دقیق و سازگاری کوهنوردان با شرایط از قلههای ۸۰۰۰ متری صورت گرفتهاست.[128]

ذوب سنگ آهن برای تولید فولاد، ۵۵٪ از اکسیژن تولید شده تجاری را در دنیا مصرف میکند.[5] در این فرایند، اکسیژن با کمک فشار زیاد به آهن مذاب تزریق میشود که موجب میشود ناخالصیهای گوگرد و کربن اضافی را بهصورت گوگرد دیاکسید و کربن دیاکسید خارج میکند. این واکنشها گرماده هستند، بنابراین درجه حرارت آن به ۱۷۰۰ درجه سانتیگراد افزایش مییابد.[134]
۲۵ درصد دیگر از اکسیژن تولید شده تجاری، توسط صنایع شیمیایی استفاده میشود.[5] از واکنش اتیلن با اکسیژن برای ایجاد اتیلن اکساید استفاده میشود، که آن نیز به نوبه خود، به اتیلن گلیکول تبدیل میشود که مواد اولیه مورد استفاده برای تولید انبوهی از محصولات، از جمله پلیمرهای ضدیخ و پلی استر (پیشسازهای بسیاری از پلاستیکها و پارچهها) میباشد.[135]
بیشتر از ۲۰٪ باقیمانده اکسیژن تولید شده تجاری در کاربردهای پزشکی، برش و جوش فلز، بهعنوان اکسید کننده در پیشران راکت و در تصفیه آب مورد استفاده قرار میگیرد.[5] در برشکاری اکسیژنی شعله بسیار داغ حاصل سوختن استیلن به همراه اکسیژن است. در این فرایند، فلزی تا ضخامت ۶۰ سانتیمتر ابتدا با یک شعله کوچک اکسیاستیلن گرم میشود و سپس به سرعت توسط یک جریان بزرگ از اکسیژن بریده میشود.[5]
براساس استاندارد لوزی آتش، گاز اکسیژن فشرده از نظر سلامتی مضر نیست، غیرقابل اشتعال و غیر واکنش پذیر است، اما یک اکسید کننده است. اکسیژن مایع سردشده[lower-alpha 26] دارای درجه خطر سلامتی ۳ (بهعلت افزایش خطر هیپوکسی ناشی از بخارات متراکم شده و همچنین برای خطرات متداول در مایعات فوق سرد مانند سرمازدگی) است و رتبه سایر خطرات آن نیز مانند اکسیژن گازی فشرده شدهاست.[136]


اکسیژن گازی در فشارهای نسبی میتواند سمی باشد و منجر به تشنج و سایر مشکلات سلامتی شود.[3][123] مسمومیت با اکسیژن معمولاً در فشارهای جزئی بیش از ۵۰ کیلو پاسکال یا ۲٫۵ برابر فشار جزئی اکسیژن در سطح دریا (۲۱ کیلو پاسکال؛ برابر با حدود ۵۰٪ از ترکیب اکسیژن در فشار عادی) رخ میدهد که میتواند برای بیمارانی که از دستگاه تنفس مصنوعی استفاده میکنند مشکل ایجاد کند. در ماسک اکسیژن معمولاً فقط شامل ۳۰٪ تا ۵۰٪ حجمشان را اکسیژن تشکیل میدهد که حدود ۳۰ کیلوپاسکال در فشار عادی یا استاندارد است.[5]
زمانی، نوزادان نارس در انکوباتورهای حاوی هوای سرشار و مملو از اکسیژن قرار میگرفتند، اما این عمل بعد از اینکه برخی از نوزادان با توجه به میزان اکسیژن زیاد، نابینا شدند، متوقف شد.[5]
تنفس اکسیژن خالص در برنامههای کاربردهای فضایی، از جمله در بعضی از لباسهای مدرن هوافضا یا در فضاپیماهای پیشگام مانند آپولو، به دلیل فشارهای کم در کل استفاده شده باعث ایجاد خسارت نمیشود.[121][138] در لباسها فضایی، فشار نسبی اکسیژن در گازهای تنفسی عموماً بالاتر از ۳۰ کیلو پاسکال (۱٫۴ برابر نرمال) است و فشار جزئی حاصل از آن در خون شریانی فضانورد فقط در سطح دریا از حد طبیعی بالاتر است.[139]
مسمویت با اکسیژن در ریهها و دستگاه عصبی مرکزی نیز میتواند در غواصی اسکوبا و غواصیهای حرفه ای رخ دهد.[5][123] تنفس طولانی مدت یک مخلوط هوا با فشار جزئی اکسیژن بیشتر از ۶۰ کیلو پاسکال میتواند منجر به فیبروز دائمی ریوی شود.[140] قرار گرفتن در معرض فشارهای جزئی بیشتر از ۱۶۰ کیلو پاسکال (اتمسفر ۱٫۶ ~) میتواند باعث تشنج شود و معمولاً برای غواصان کشنده است. مسمومیت حاد اکسیژن (ایجاد تشنج، ترسناکترین اثر آن برای غواصان) با تنفس مخلوط هوای دارای ۲۱ درصد اکسیژن، میتواند در عمق ۶۶ متری یا بیشتر رخ دهد. این نوع مسمویت میتواند با تنفس هوایی که بهطور ۱۰۰ درصد از اکسیژن تشکیل شدهاست، تنها در عمق شش متری رخ بدهد.[141][142][143]

منابع بسیار غلیظ اکسیژن موجب آتشسوزی سریع میشوند. خطر آتشسوزی و انفجار هنگامی وجود دارد که اکسید کنندهها و سوختهای غلیظ در نزدیکی یکدیگر قرار بگیرند. در هر صورت، برای شروع آتشسوزی یک اتفاق، مانند گرما یا جرقه، مورد نیاز است.[29] اکسیژن یک سوخت نیست و اکسیدکننده محسوب میشود اما با این وجود، منبع اکثر انرژی شیمیایی آزاد شده در آتشسوزی است.[144] ترکیبات حاوی اکسیژن و دارای پتانسیل اکسیدکنندگی زیاد مانند پراکسیدها، کلراتها، نیتراتها، پرکلراتها و دیکروماتها بهعنوان ترکیبات دارای خطر ایجاد آتشسوزی در نظر گرفته میشود، زیرا این ترکیبات میتوانند منبعی مناسب برای تأمین اکسیژن مورد نیاز برای آتش باشند.[145]
اکسیژن با غلظت و تراکم بالا اجازه میدهد تا احتراق به سرعت و پرانرژی انجام شود. لولههای فولادی و مخازن ذخیرهسازی مورد استفاده برای ذخیره و انتقال اکسیژن گازی و مایع بهعنوان یک سوخت رفتار میکنند؛ بنابراین، طراحی و ساخت سیستمهای اکسیژن نیاز به توجه و آموزش ویژه دارد تا از حداقل احتراق منابع قابل اشتعال اطمینان حاصل شود. آتشسوزی که باعث کشته شدن خدمه آپولو ۱ در آزمایش سکوی پرتاب شد، خیلی سریع گسترش یافت، زیرا کپسول حاوی اکسیژن تحت فشاری در حدود ۱ اتمسفر بود، در حالی باید فشار آن حدود ۱⁄۳ فشار محیط باشد، فشاری که در چنین ماموریتهایی استفاده میشود.[146]
اگر اکسیژن مایع نشت شده در تماس با مواد آلی مانند چوب، فراوردههای پتروشیمی و آسفالت قرار بگیرد، میتواند با بروز اولین تنش مکانیکی موجب انفجار ناگهانی این مواد شود.[147] همچنین اکسیژن مانند سایر مایعات فوق سرد، در صورت تماس با بدن انسان، میتواند باعث سرمازدگی در پوست و چشم شود.[148]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.