Epoksiidid
From Wikipedia, the free encyclopedia
Epoksiid, tuntud ka kui oksiraan, on kolmeaatomilise ringiga tsükliline eeter. Ring moodustab umbes võrdkülgse kolmnurga, mistõttu on selles leiduvad sidemed suure pinge all. Kahe sideme vaheline nurk on 60 kraadi tavalise tetraeedrilise 109 kraadi asemel. Kui viimasest arvust esimene lahutada, võib öelda, et iga aatomi juures on 49 kraadi pinget, mis teeb kogu molekuli pingeks kokku umbes 150 kraadi, mida on üsna palju. Pinge tsüklis muudab epoksiidid reaktiivsemaks kui teised eetrid.


Polümeeri, mis moodustub epoksiidrühmade reageerimisel nimetatakse polüepoksiidiks. Epoksüvaike kasutatakse liimidena ja ehitusmaterjalidena. Epoksiidi polümeriseerumisel moodustub polüeeter; näiteks etüleenoksiid polümeriseerub polüetüleenglükooliks, mis on tuntud ka kui polüetüleenoksiid.
Süntees
Tööstuses enimkasutatud epoksiidid on eteenoksiid ja propeenoksiid, mida toodetakse vastavalt umbes 15 ja 3 miljonit tonni aastas. [1] Eteeni epoksüdeerimisreaktsioon käib üle katalüütilise reageerimise hapnikuga järgneva stöhhiomeetria kohaselt:
- 7 H2C=CH2 + 6 O2 → 6 C2H4O + 2 CO2 + 2 H2O
See reaktsioon nõuab kõrgeid temperatuure ja hõbekatalüüsi, mistõttu pole see laboratooriumis hästi kasutatav. Hapniku otsest reageerimist alkeenidega saab kasutada ainult selle epoksiidi puhul. Teised alkeenid, kaasa arvatud propeen, niimoodi ei reageeri.
Eteenoksiidi toodetakse põhiliselt vahesaadusena 1,2-etaandiooli ja polüestrite tootmisel.
Alkeeni peroksüdeerimine
Enamik epoksiide saadakse laboratoorselt alkeenide reaktsioonil peroksiide sisaldavate reagentidega, mis annavad ühe hapnikuaatomi. Tüüpilised peroksiidreagendid on vesinikperoksiid, peroksükarboksüülhapped (vahel luuakse reaktsioonisegus) ja alküülhüdroksüperoksiidid. Spetsiifilistel puhkudel kasutatakse ka teisi peroksiide sisaldavaid reagente, näiteks dimetüüldioksüraan.
Kõige suuremas skaalas kasutatakse seda lähenemist propeenoksiidi sünteesiks propeenist, kasutades kas tert-butüülhüdroperoksiidi või etüülbenseeni hüdroperoksiidi. [2] Laboratoorses reaktsioonides kasutatakse pigem Prilešajev'i reaktsiooni. [3] [4] See meetod kasutab alkeeni oksüdeerimist peroksühappega, naiteks meta-kloroperoksübensoehappega. Kujukaks näiteks on vinüülbenseeni epoksüdeerimine peroksübensoehappega stüreenoksiidiks: [5]
Reaktsioon läheb üle mehhanismi, mis on üldiselt tuntud kui "liblikmehhanism". [6] Peroksiidi vaadeldakse siin kui elektrofiili ja alkeeni kui nukleofiili. Reaktsiooni loetakse kontsertmehhanismiliseks, st kõik elektronide üleminekud toimuvad samaaegselt (numbrid alloleval joonisel on mõeldud lihtsustamiseks).
Peroksiid kannab hapnikuaatomi alkeenile sün-stereokeemiaga, mis tähendab, et mõlemad hapnik-süsiniksidemed jäävad samale poole kaksiksidet. Üle kantakse karbonüülsest süsinikust kaugeimal paiknev hapnik. Hüdroperoksiide kasutatakse ka katalüütilistes enantioselektiivsetes epoksüdeerimistes, näiteks nagu Sharpless'i epoksüdeerimises ja Jacobsen'i epoksüdeerimises. Taolistel juhtudel on hapniku doonoriks metallioksiid või peroksiid. Need reaktsioonid ja ka Shi epoksüdeerimine on kasulikud kiraalsete epoksiidide enantioselektiivseks sünteesiks.
Veel üks meetod alkeenidest epoksiidide saamiseks on reaktsioon üle halohüdriinide, mille saab halogeeni ja hüdroksüülrühma elektrofiilsel liitmisel alkeenile.
Kui saadud ainet leelisega töödelda, eemalduvad vesinik ja halogeen ning moodustub epoksiid.
Molekulisisene SN2 asendus
Selle meetodi puhul on tegemist Williamson'i eetrisünteesi molekulisisese variandiga. Nimelt paiknevad nukleofiilne alkoksiidioon ja elektrofiilne halogenoalkaan samas molekulis. Lähteainet nimetatakse haloalkoholiks. Näiteks reaktsioon 2-kloropropanooliga: [7]

Umbes pool maailma propeenoksiidist luuakse selle meetodiga.[2] Molekulisisene epoksiidi moodustamise reaktsioon on Drazens'i reaktsiooni üks tähtsamaid etappe.
Johnson-Corey-Tšaikovski reaktsioonis tehakse epoksiidid karbonüülrühmadest ja sulfooniumüliidist. Selles reaktsioonis on kloriidi asemel lahkuvaks rühmaks sulfooniumioon.
Nukleofiilne epoksüdeerimine
Elektronpuudulikke alkeene, näiteks enoone ja akrüülhappe derivaate saab epoksüdeerida nukleofiilsete hapnikuühendite, näiteks peroksiididega. Reaktsioonil on kaheastmeline mehhanism. Kõigepealt hapnik liitub nukleofiilse konjugeeritud mehhanismi kaudu, tekitades stabiliseeritud karbaniooni. See karbanioon ründab siis sedasama hapniku aatomit, eemaldades sealt lahkuva rühma ja sulgedes epoksiidiringi.
Asümmeetriline epoksüdeerimine
Epoksiidi süsinikuaatomid on umbes sp3-hübridiseeritud ja võivad seega olla stereogeensed tsentrid. Olenevalt reaktsioonimehhanismist ja lähteaineks võetud alkeeni geomeetriast võivad moodustuda cis ja/või trans epoksiidi diastereomeerid. Lisaks, kui lähteaines leidub teisi stereotsentreid, siis võivad nad mõjutada epoksüdeerimise stereokeemiat. Samuti võivad saadud epoksiidi stereokeemiat mõjutada stereogeenseid struktuure omavad epoksüdeerimisreagendid (nt Sharpless'i epoksüdeerimine, Jacobsen'i epoksideerimine, Waits-Sheffer'i epoksudeerimine ja Juliá-Colonna epoksüdeerimine).
Reaktsioonid
All on loetletud tüüpilised reaktsioonid epoksiididega.
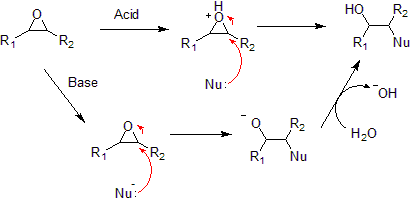
- Nukleofiilne liitumisreaktsioon epoksiidile võib olla alus- või happekatalüütiline. Happekatalüütilisel epoksiidi avamisel liidetakse kõigepealt epoksiidi hapnikule prooton, mis teeb selle reaktiivsemaks, ja seejärel liidetakse nukleofiil.
- Erinevalt teistest tsüklilistest eetritest saab epoksiidi avada ka üle aluselise katalüüsi nukleofiilidega. Kuigi eetri hapnik on tavaliselt halvasti lahkuv rühm, muudab sidemete pinge epoksiidis aine piisavalt reaktiivseks, et see kuumutamisel hüdroksiidioonidega reageeriks.
- Epoksiide saab hapetega avada täpselt nagu teisigi eetreid, aga sidemete pingest tuleneva suurema reaktiivsuse tõttu võib kasutada palju pehmemaid tingimusi. Happelistes tingimustes mõjutavad nukleofiili rünnatavat asukohta nii steerilised efektid (nagu tavaliselt SN2 reaktsioonide puhul) kui ka karbokatioonne stabiilsus (nagu tavaliselt SN1 reaktsioonide puhul). Aluselistel tingimustel ründab nukleofiil steeriliselt vähem takistatud süsinikku, täpselt nagu tüüpilise SN2 nukleofiilse liitumise puhul. Antud nukleofiilsed liitumised on ainsad näited eetri osalemisest SN2 reaktsioonis.
- Epoksiidi hüdrolüüsil happelise katalüüsi juuresolekul tekib vitsinaalne glükool (st diool, mille hüdroksüülrühmad paiknevad kõrvutiasetsevatel süsinikel). Epoksiidide hüdrolüüsi võib lugeda vee nukleofiilseks liitumiseks üle happekatalüüsi. Järelikult on alkeeni epoksüdeerimine ja sellele järgnev epoksiidi hüdrolüüs kokkuvõttes alkeeni dihüdroksüleerimine – mõlemale kaksiksideme süsinikule hüdroksüülrühma liitmine:
Selle näitereaktsiooni saadust, 1,2-etaandiooli, toodetakse just sellisel meetodil igal aastal umbes 18 miljonit tonni, enamik sellest külmumisvastaseks aineks autodele.
- Epoksiidide avamisel võib kasutada ka teisi happeid peale hüdrooniumiooni. Näiteks veevaba halogeenhappe kasutamisel tekib epoksiidist trans-halohüdriin.
- Epoksiidi redutseerimine liitiumalumiiniumhüdriidi ja veega annab alkoholi. Seda redutseerimisprotsessi võib lugeda hüdriidiooni (H-) nukleofiilseks liitumiseks epoksiidile aluselistes tingimustes.
- Redutseerimine volframheksakloriidi ja n-butüülliitiumiga annab tagasi alkeeni. See reaktsioon on sisuliselt de-epoksüdeerimine.
[8].
- Reaktsioon amiini NH-rühmaga annab üle SN2 mehhanismi aminoalkoholi. Sellist kovalentse sideme moodustumist kasutatakse epoksüliimis, näiteks trietüültetraamiinis (TETA) kõvendamiseks.
- Epoksiidid reageerivad ka Grignardi reaktiividega, andes kaks alkoholi. Reaktsiooni üldvalem:
Reaktsiooni saagiste vahekorda mõjuvatad põhiliselt:
- Steeriline takistus – kui Z ja/või X asendusrühmad on oluliselt suuremad kui teise süsiniku E ja D asendusrühmad, siis tekib rohkem esimest saadust. Saaduste tekkimise suhet mõjutab ka Grignardi reaktiivi alküülrühma (R) füüsiline suurus – mida suurem on R, seda ühest erinevam on saaduste moolide suhe.
- Konjugatsiooniefektid – kui näiteks Z asendusrühmaks on vinüül- või fenüülrühm, siis tekib konjugatsiooni stabiliseeriva efekti tõttu oluliselt rohkem teist saadust.
Viited
Wikiwand - on
Seamless Wikipedia browsing. On steroids.