Epigenética
estudio de todos aquellos factores no genéticos que intervienen en la determinación de la ontogenia o desarrollo de un organismo De Wikipedia, la enciclopedia libre
La epigenética (del griego epi, 'en' o 'sobre', -genética) o epigenómica[1] es el estudio de los mecanismos que regulan la expresión de los genes sin una modificación en la secuencia del ADN que los compone. Es decir, se centra en los procesos que inciden en la trascripción sin alterar el orden o estructura de los nucleótidos, activando o inactivando los genes, y que pueden estar causados por la edad y la exposición a factores ambientales (alimentación, ejercicio, medicamentos y sustancias químicas). Estos cambios pueden mantenerse en el tiempo y trasmitirse de padres a hijos por herencia.[2] Establece la relación entre las influencias genéticas y ambientales que determinan un fenotipo.
El término epigenética fue acuñado por C.H. Waddington en 1942 para referirse al estudio de las interacciones entre los genes y el ambiente que se producen en los organismos.[3][4] El biólogo escocés la definió como:
«el estudio de todos los eventos que llevan al desenvolvimiento del programa genético del desarrollo» o «el complejo proceso de desarrollo que media entre genotipo y fenotipo».[3]
Se refiere al estudio de los factores que, sin corresponderse a elementos de los genes (genética clásica), juegan un papel muy importante en la genética moderna interactuando con estos.
Los factores genéticos que son determinados por el ambiente celular —en lugar de por la herencia—, intervienen en la determinación de las etapas de desarrollo (ontogenia), desde la formación del cigoto (fecundación) y que igualmente interviene en la regulación heredable de la expresión génica sin corresponder a un cambio en la secuencia de nucleótidos.
Se puede decir que la epigenética es el conjunto de reacciones químicas y demás procesos que modifican la actividad del ADN, pero sin alterar su secuencia de nucleótidos. Los
cambios epigenéticos también pueden ocurrir en los humanos en respuesta a un cambio en la dieta.[5]
Las «marcas epigenéticas» se consideran como factores no genéticos. Las marcas epigenéticas no son genes, pero la genética moderna nos enseña que no solo los genes influyen en la genética de los organismos.[6] Del mismo modo que definimos genoma como el conjunto completo de los genes (secuencias de ADN codificante) de un organismo, se define epigenoma[1] como la colección completa de todas las marcas epigenéticas en el ADN de ese organismo [el conjunto de compuestos químicos que acompañan al ADN actuando sobre (epi-) el genoma, para regular la expresión de sus genes, «etiquetándolos» o marcándolos de alguna manera.]
Finalizado el Proyecto Genoma Humano en el 2003, los científicos se han dado cuenta de que hay mucho más en las bases moleculares del funcionamiento celular, el desarrollo, el envejecimiento y muchas enfermedades.[7] La idea que se tenía hace pocos años de que los seres humanos y los demás organismos son solo predominantemente lo que está escrito en nuestros genes desde la concepción, está cambiando rápidamente, y la ciencia avanza para lograr descifrar el lenguaje que codifica las pequeñas modificaciones químicas capaces de regular la expresión de la multitud de genes.[8]
La epigenética reinterpreta los conceptos clásicos y reconoce nuevos mecanismos a través de los cuales la información contenida en el ADN de cada individuo es traducida.[9]
Se está descifrando un nuevo lenguaje del genoma, al tiempo que debe introducirse la noción de que nuestras propias experiencias pueden marcar nuestro material genético de una forma hasta ahora desconocida, y que estas «marcas» pueden ser transmitidas a generaciones futuras.[10]
Se han distinguido mecanismos epigenéticos en una gran variedad de procesos fisiológicos y patológicos, que incluyen por ejemplo varios tipos de cáncer, patologías cardiovasculares, neurológicas, reproductivas e inmunes.
Aplicaciones del término
Resumir
Contexto
Dependiendo de la disciplina biológica, el vocablo «epigenética» tiene diversos significados:[11]
- En genética del desarrollo, la epigenética hace referencia a los mecanismos de regulación genética que no implican cambios en las secuencias de ADN.
- En biología del desarrollo, hace referencia a la dependencia contextual de los procesos embriológicos. El contexto incluye factores epigenéticos tanto internos (materiales maternos, propiedades genéricas físicas y autoorganizativas de las células y los tejidos, procesos de regulación genética, dinámica celular y tisular) como externos (temperatura, humedad, luz, radiación, etc.).
- En biología evolutiva, la denominación herencia epigenética engloba a los mecanismos de herencia no genéticos.
- En genética de poblaciones se emplea la expresión variación epigenética para denominar a la variación fenotípica que resulta de diferentes condiciones ambientales (norma de reacción). Los cambios epigenéticos son cambios reversibles de ADN que hacen que unos genes se expresen o no, dependiendo de condiciones exteriores (polifenismo).
- En la prevención del cáncer, en los últimos años se han desarrollado tecnologías que permiten prever el comportamiento de los genes, y la industria farmacéutica ha mostrado un enorme interés en el desarrollo de fármacos que controlen dichos cambios epigenéticos. Los ensayos clínicos en marcha se centran fundamentalmente en el cáncer, pues está comprobado que los factores epigenéticos juegan un papel clave en el desarrollo de los tumores.[12]
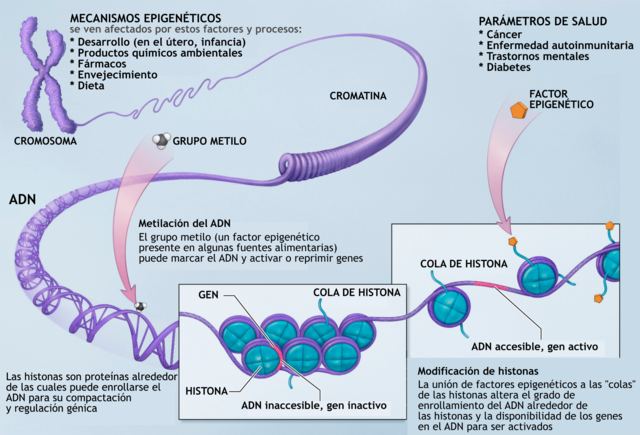
La epigenética es el estudio de modificaciones en la expresión de genes, las cuales no obedecen a una modificación de la secuencia de ADN y que además son heredables. Fuentes de modificaciones de los genes son los factores ambientales, que pueden afectar a uno o varios genes con múltiples funciones. Por medio de la «regulación epigenética» se puede observar cómo es la adaptación al medio ambiente dada por la plasticidad del genoma, la cual tiene como resultado la formación de distintos fenotipos según el medio ambiente al que sea expuesto el organismo. Estas modificaciones presentan un alto grado de estabilidad y, al ser heredables, se puedan mantener en un linaje celular por muchas generaciones. Esto es importante cuando hay errores en las modificaciones, porque se pueden generar enfermedades que perduren en una familia por mucho tiempo.
La «regulación epigenética» se puede dar por cambios en la conformación de la cromatina según la interacción de esta con las histonas. Este es un nivel clave de regulación, ya que el estado en el que se encuentre la cromatina determina el momento, el lugar y la forma en que un gen puede ser expresado o no. Si la cromatina se encuentra en un alto grado de condensación, los elementos de transcripción no pueden acceder a dicha región del ADN y, por lo tanto, el gen no se transcribe; es decir el gen es silenciado. En contraste, si la cromatina no se encuentra condensada, los activadores de transcripción se pueden unir a las regiones promotoras para que ocurra la transcripción del gen. Esta es una de las formas en que se da la regulación del genoma.
Se ha determinado que hay tres procesos epigenéticos de regulación:
- metilación del ADN,
- modificación de las histonas y
- efecto de los ARN pequeños no codificantes.
Genética del desarrollo
Resumir
Contexto
La estructura molecular interna de los cromosomas se ha dividido en 3 capas:
- Genes codificadores de proteínas: Los que se conocen como los únicos depósitos de la herencia;
- Genes no codificadores: Cumplen una función destacada, pues a la par que las histonas, las señales químicas unidas al ADN forman la cromatina; resultan importantes para la herencia y para el desarrollo de las enfermedades y dan lugar a cadenas activas de ARN, las mismas que alteran el comportamiento de los genes codificadores;
- Capa epigenética de la información: Resulta crucial para el desarrollo, el crecimiento, el envejecimiento y el cáncer. No altera la secuencia de ADN aunque influye en su expresión. Los mecanismos epigenéticos pueden integrar señales genómicas y ambientales para controlar el desarrollo de un fenotipo particular, por lo que están íntimamente ligados con la plasticidad fenotípica y la salud.[13]
Son las «epimutaciones» las que, según algunas teorías, darían origen a enfermedades como la esquizofrenia, mientras que las variaciones epigenéticas explican, por ejemplo, las discordancias entre gemelos idénticos, quienes muestran idénticas secuencias de ADN.
Las variaciones epigenéticas controlan la actividad de los genes; si es alta la concentración de sustancia "X", la actividad será alta. El código epigenético está constituido por un sistema de moléculas unidas al ADN o a las histonas, un código de las histonas es el que gobierna la expresión de los genes, pues sus colas proteicas (las de las histonas) catalizan una gran variedad de adiciones químicas, como los acetilos que amplifican genes vecinos.
Mecanismos epigenéticos de regulación génica
Resumir
Contexto
Los mecanismos epigenéticos que actúan en el nivel molecular son: la metilación del ADN y la modificación de histonas.

Metilación del ADN
Se ha descubierto que en organismos superiores, a la base citosina se le añade un grupo metilo el cual permite la conformación cerrada de la cromatina. Por lo tanto un alto grado de metilación se asocia con el silenciamiento de genes. Una forma de controlar el grado de metilación es por medio de acción de efectos ambientales. En los mamíferos se ha visto que la metionina, la colina, el ácido fólico y las piridoxinas (que son sustancias provenientes de la dieta) tienen como función la adición de grupos metilos. Por lo general la metilación se da en mayor grado en las islas CpG (regiones con alta concentración de citosina y guanina) las cuales forman parte de la región promotora de los genes. Para que la metilación se produzca de forma adecuada necesita de la ADN metiltransferasa, la cual se encarga de establecer y mantener los patrones de metilación y necesita de las proteínas de unión metil-CpG las cuales están involucradas en hacer las marcas de metilación.[14]
Un ejemplo de la importancia del silenciamiento de un gen o grupo de genes es la inactivación del cromosoma X y la impronta de genes. La impronta de genes hace referencia a que una de las copias de genes que se hereda de los padres(puede ser tanto la copia materna o paterna), puede encontrarse completamente silenciada con el fin de tener una expresión monoalélica de ciertos genes. Por lo tanto, se observará un patrón de metilación correspondiente al sexo. Si existen anomalías en el silenciamiento de ciertas copias se pueden dar cambios en el fenotipo que pueden ser resultado de enfermedades como el caso del síndrome de Beckwith Wiedemann. Este síndrome se da cuando las dos copias del gen IGF2 están activas, es decir el proceso de impronta génica no se dio de forma adecuada al no silenciar la copia materna, y por lo tanto el individuo se caracteriza por la presencia de un alto número de tumores de gran tamaño. Se ha determinado que un alto índice de metilación de genes reguladores del ciclo celular y reparadores de ADN lleva a una mayor frecuencia de la formación de tumores. De igual forma si hay un bajo nivel de metilación (hipometilación) también se presentan enfermedades. Estudios recientes han demostrado que la metilación es un mecanismo de defensa contra virus y parásitos para evitar que éstos logren dañar el ADN.[15]

Metilación del ADN en el cáncer
La metilación del ADN es un regulador muy importante en la transcripción de los genes. Un cuerpo muy grande de evidencias ha demostrado que la metilación aberrante del ADN está asociada con el silenciamiento no programado de los genes y los genes que tienen niveles muy altos de 5-metilcitosina en su región promotora son transcripcionalmente silenciados. La metilación del ADN es esencial en el desarrollo embrionario, y en las células somáticas, los patrones de metilación del ADN son, en general, transmitidos a las células hijas con gran fidelidad. Los patrones aberrantes de metilación del ADN han sido asociados con un gran número de enfermedades del ser humano y se han encontrado de dos maneras distintas: hipermetilación e hipometilación, comparado con los estándares normales. La hipermetilación es una de las mayores modificaciones epigenéticas responsable de reprimir la transcripción vía región promotora de los genes supresores de tumores. La hipermetilación ocurre en las islas CpG de la región promotora y está asociada con la inactivación del gen. La hipometilación también ha sido implicada en el desarrollo y progresión del cáncer a través de diferentes mecanismos. Generalmente, en procesos tumorales, se observa una hipometilacion del ADN, exceptuando regiones promotoras específicas que se encuentran hipermetiladas que normalmente corresponden a promotores de genes supresores de tumores. Esto conduce a una expresión génica aberrante.[17]
Modificación de histonas
La cromatina está conformada por una unidad básica, el nucleosoma, conformado por histonas (H2A, H2B, H3 y H4) unidas a proteínas no histónicas. En el nucleosoma se enrolla el ADN. Por modificaciones post-traduccionales se puede modificar la configuración de las histonas. Las histonas sufren modificaciones por medio de procesos de acetilación, fosforilación, metilación, deaminación, isomerización de prolinas y ubiquitinización. Combinaciones específicas en la modificación de las histonas sirven como una especie de código que determina si el gen ha de ser silenciado o expresado y esta es otra forma de cómo se puede dar la regulación génica.[17]
Acetilación de histonas
Las histonas en la cromatina pueden ser modificadas por acetilación. Esta constituye la modificación más frecuente y quizás la más importante. En presencia de acetil Co-A se produce la acetilación a través de la enzima acetiltransferasa de la histona (HAT). La enzima histona desacetilasa (HDAC) es la encargada de eliminar la marca epigenética.
La acetilación es reconocida por un grupo de proteínas con bromodominio capaces de detectar la lisina acetilada. Es frecuente que las proteínas contengan dos bromodominios y, por tanto, puedan reconocer en la misma interacción dos lisinas acetiladas. La acetil lisina tiene peor facilidad para interaccionar con el ADN, y por tanto, la cromatina está menos plegada. La lisina con carga positiva tiene mayor capacidad para interactuar con los grupos fosfatos del ADN.
La acetilación de histonas tiene lugar durante la replicación de ADN, cuando se activa o reprime la transcripción génica.
Los complejos enzimáticos son distintos en un paso y otro, distinguiéndose así los complejos represores que llevan a cabo la desacetilación y los complejos activadores que lleva a cabo la acetilación. El balance de la acetilación de histonas es un factor clave en la regulación transcripcional en células normales: En el caso de histonas desacetiladas la cromatina presenta una conformación cerrada y, por tanto, los factores de transcripción no pueden acceder al ADN, lo que inhibe la expresión génica.
Por el contrario, en el caso de las histonas acetiladas, la cromatina presenta una conformación abierta y, por tanto, los factores de transcripción pueden acceder al ADN, lo que favorece la expresión génica.
De modo que alteraciones en los niveles de acetilación de histonas en cáncer altera la expresión génica. En general, en procesos tumorales, el cambio más frecuente no afecta ni al lector ni a la proteína, sino a la histona desacetilasa, que se sobreexpresa y, a la histona acetiltransferasa cuya expresión disminuye, lo cual produce un incremento de la forma cerrada de la cromatina y, en consecuencia, una expresión génica aberrante.
Metilación de histonas
Las histonas pueden ser modificadas por metilación. Se produce en residuos de arginina y lisina de las histonas, siendo más frecuente en residuos de lisina. La introducción de un grupo metilo en dichos residuos es catalizado por la enzima lisina metil transferasa, formándose así S-adenosilhomocisteína.
A diferencia de la acetilación, el efecto que produce la metilación no es general, sino que, en función de la lisina que se metile, se produce transcripción o inhibición (incluso una misma lisina se puede metilar varias veces).
La lisina metilada es reconocida por proteínas con dominios distintos como cromodominios, dominios PHD o dominios de la familia real (Tudor, PWWP, MBT). Puede ocurrir que una misma proteína tenga más de un dominio para reconocer varias lisinas a la vez.
El sistema enzimático encargado de borrar la señal consiste en una lisina desmetilasa que elimina específicamente la metilación de las histonas a través de mecanismos catalíticos diferentes (mecanismo amino oxidasa dependiente de FAD o mecanismo dioxigenasa dependiente de Fe2+).
La metilación de histonas puede alterar la estructura de la cromatina, puesto que la metilación llevada a cabo por histona metiltransferasas (HMTs) puede reclutar a HDACs, conduciendo a estructura de la cromatina cerrada y silenciación génica. Desde el punto de vista tumoral, en determinados casos la presencia de metilación recluta la histona desacetilasa, favoreciendo la supresión de genes supresores de tumores. La metilación de histonas está alterada en distintos procesos tumorales.
ARN no codificante
Una forma de regulación génica es por medio de los ARN de interferencia (iARN) los cuales no codifican para una proteína en específico, pero sus secuencias son complementarias a ADN o ARN codificante e impiden su traducción, esta es una forma de regulación negativa de la expresión a nivel post-transcripcional. Uno de estos tipos de ARN son los micro ARN de interferencia (miARN), los cuales se unen a secuencias complementarias y degradan dicho transcrito impidiendo así que se dé la traducción hacia proteínas. Se ha visto la importancia de este tipo de regulación génica en varios escenarios como: regulación en producción de tumores, efectos del envejecimiento por cambios en la metilación, asociado al estrés por metilación en genes neurales, involucrado en imperfección del desarrollo del feto entre otros.
Todos estos mecanismos epigenéticos juegan un papel fundamental en el correcto desarrollo y funcionamiento del organismo, como es el caso del desarrollo embrionario, el comportamiento o la diferenciación celular, que si se descontrola puede conducir a cáncer. La epigenética es la encargada de posibilitar una buena organización de la cromatina en el núcleo celular, regulando la expresión génica en los distintos tejidos y tipos celulares, y manteniendo el patrón correcto de expresión en el momento y lugar adecuados.
Técnicas de metilación del ADN
Resumir
Contexto
RIMS-seq2
RIMS-seq2 (Reduced Integration of Methylation and Sequencing 2) es una técnica relativamente nueva, la cual se considera de alto rendimiento, cuyo objetivo principal es secuenciar genomas, además de superponer información de metilación. Esta técnica se realiza solo con una pequeña modificación del protocolo experimental para la secuenciación de ADN de alto rendimiento, se modificación se basa en la inclusión de un paso de desaminación controlada para identificar sitios metilados.[18]
RIMS-seq2 cobra importancia en la actualidad y se cataloga como una herramienta revolucionaria para estudios multiómicos, esto gracias a su capacidad para capturar información genética y epigenética simultáneamente. Siendo importante su aplicación en campos como biología del cáncer, del desarrollo e investigación de enfermedades neurodegenerativas.[18][19][20]
RIMS-seq2 y su papel en la metilación del ADN
La metilación del ADN implica la transferencia de un grupo metilo a la posición C5 de la citosina para formar 5-metilcitosina, se considera un mecanismo epigenético, su regulación es esencial para la función cognitiva normal.[18][19][21]
La metilación de citosina en dinucleótidos CpG es un proceso biológico fundamental que RIMS-seq2 hace uso para obtener información tanto de la secuencia genómica como del estado de metilación del ADN.[18][21][20]
La técnica de RIMS-seq2 tiene como principal parte de su protocolo introducir una desaminación controlada de la 5-metilcitosina (m5C), la misma que re realiza mediante un tratamiento alcalino térmico que convierte una fracción de las m5C en timina. Además, esta técnica toma en cuenta la diferencia de comportamiento entre las citosinas metiladas y no metiladas.[18][19][21][20]
Metodología
RIMS-seq2 integra un protocolo de desaminación modificado con tecnologías de secuenciación de alto rendimiento, enfocado en la detección de metilación específica de secuencia.[18] Se basa en dos pasos importantes, los cuales son:
- Se inicia con la extracción de ADN genómico de alta calidad del organismo o tejido objetivo. El ADN debe pasar por procesos de purificación, para poder garantizar que se encuentre libre de contaminantes tales como proteínas, lípidos y ARN que podrían degradar la muestra.[18]
- El ADN genómico se expone a un tratamiento alcalino térmico limitado, donde se va a producir una desaminación de una fracción de la m5C. Sin embargo, esta desaminación será insignificante y no afectará la secuenciación del ADN ni con el procesamiento de datos estándar.[18]
Impronta genómica y herencia epigenética
Resumir
Contexto
Impronta genómica
Los procesos de metilación juegan un papel importante en la acción de la impronta genómica. En los vertebrados solo se ha descubierto este mecanismo en los mamíferos. Según el origen parental los genes pueden ser activados o silenciados. La impronta afecta el crecimiento prenatal y se ha establecido su importancia en la generación de enfermedades. Durante la gametogénesis se inicia la impronta genómica y por lo tanto esta es heredada durante la fusión de los gametos. Durante la formación del cigoto la impronta es reprogramada en el nuevo individuo. El ejemplo más claro de este mecanismo se da en la regulación de la dosis compensatoria del cromosoma X. Esta reprogramación juega un papel importante en la expresión de los genes de tejidos específicos que si llegan a ser modificados pueden tener consecuencias en el desarrollo adecuado del organismo. Por lo tanto, con un mejor entendimiento de cómo ocurren estos procesos y como son regulados, se puede llegar a entender enfermedades como la preeclampsia, las pérdidas durante la gestación, los fallos que se dan en la reproducción asistida, los problemas asociados con la infertilidad y el cáncer entre otros.
Herencia epigenética
La herencia epigenética resulta de la transmisión de información que no depende de secuencias de las bases nitrogenadas del ADN a través de la meiosis o mitosis. La información epigenética modula, por tanto, la expresión de los genes sin alterar la secuencia de ADN. Los patrones de metilación de ADN son los mejor estudiados y entendidos como marcadores de fenómenos epigenéticos.
Los tres principales tipos de información epigenética son:
- Metilación de la citosina del ADN: es un cambio en el ADN, en la que un grupo metilo es transferido desde S-adenosilmetionina a una posición C-5 de citosina por una ADN-5 metiltrasferasa. La metilación del ADN ocurre, casi exclusivamente, en dinucleótidos CpG, teniendo un importante papel en la regulación de la expresión del gen.
- Impronta genética: la «impronta» (imprinting en inglés) se manifiesta solamente en organismos superiores (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). Cuando hablamos de impronta, nos referimos a genes que pueden modificar su funcionamiento sin necesidad de un cambio en la secuencia del ADN. Este cambio en su forma de manifestarse que tienen los genes «improntados» está generalmente ligado a su origen parental. Un gen «improntado» se manifiesta de una manera cuando su origen es paterno y de otra cuando proviene del gameto materno. Parece ser que existe un mecanismo celular que de algún modo «marca» o deja una impronta sobre todos los genes «improntables» de acuerdo al sexo del individuo.
- Modificación de histonas: incluye acetilación, metilación y fosforilación.
También hay que indicar que la célula no puede sintetizar los orgánulos de novo; por ello, además de la información que contiene el ADN, una célula necesita información epigenética en forma de al menos una proteína característica en la membrana del orgánulo que se quiera sintetizar. Esta información se transmite desde la membrana del padre o madre a la de la progenie en forma del propio orgánulo.
Sin embargo, al nombrar estos mecanismos, hay que recordar que «indirectamente», al analizar el origen de cada proceso en sí mismo, aún están involucrados los genes (como por ejemplo los genes de la enzima ADN-metiltransferasa, histonas, etcétera) y, por ende, también indirectamente están involucrados los cambios genéticos (como mutaciones) que puedan sufrir estos genes, o sobre los genes en que actúan. Del mismo modo, aunque las modificaciones epigenéticas no implican en el proceso un cambio en la secuencia de nucleótidos del ADN, sino que consisten en un cambio en la expresión de los genes, la selección natural igualmente, a partir del resultado biológico de dicha expresión de genes, actuará sobre el proceso epigenético y sobre el organismo que lo manifiesta.
Programación fetal y enfermedades
En 1944 las mujeres embarazadas en la Holanda ocupada, sólo alcanzaban a consumir 700 calorías al día cuando deberían ser 2400 calorías.
Los niños y niñas concebidos o nacidos en 1944-1945 tuvieron un peso bajo al nacer. Aunque pudieron alimentarse con normalidad después de la guerra, sus cuerpos no se repusieron de la desnutrición temprana. Al llegar a la adultez fueron más sensibles a: el estrés, la obesidad, la resistencia a la insulina, la hipertensión y la enfermedad arterial coronaria.
Aunque habían estado perfectamente sanos al nacer, algo había sucedido dentro del útero materno durante a vida fetal, que podía afectarlos el resto de su vida y la de su descendencia.
Se presume que la malnutrición materna llevaría a malnutrición del feto y esta última generaría una «programación fetal», o sea que el feto se prepara para adaptarse a un medio donde hay carencias nutricionales, conduciendo a un «fenotipo ahorrador».[17][22][23]
- Se define el genoma “ahorrador” como aquel altamente eficiente en la ingesta de alimentos o en la utilización de alimentos. Este fenotipo, que tiene más de 10 000 años, necesariamente estuvo relacionado con los ciclos de actividad/inactividad física y por tanto la selección de genes fue sustentada por una actividad física obligatoria. Los efectos del hambre son cortos y aunque las condiciones de vida pueden cambiar rápidamente, no lo hace igual la metilación del ADN.[24]
- Se define el genoma “ahorrador” como aquel altamente eficiente en la ingesta de alimentos o en la utilización de alimentos. Este fenotipo, que tiene más de 10 000 años, necesariamente estuvo relacionado con los ciclos de actividad/inactividad física y por tanto la selección de genes fue sustentada por una actividad física obligatoria. Los efectos del hambre son cortos y aunque las condiciones de vida pueden cambiar rápidamente, no lo hace igual la metilación del ADN.[24]
En aquella Holanda de 1944-1945, después del hambre llegó la abundancia, sin embargo esos niños al tener un metabolismo ralentizado, vieron su masa corporal crecer con rapidez, acumulando grasa en abundancia. Podría decirse que los nietos y nietas de aquellas mujeres, quedaron aún con la «marca epigenética» sin haber conocido las privaciones de la guerra, lo que confirma que óvulos y espermatozoides arrastran la genética de sus padres y abuelos desde el mismo momento de la concepción.[22][23]
Epigenética en el desarrollo y plasticidad fenotípica
Resumir
Contexto
Efectos dependientes de temperatura
La actividad enzimática depende de la temperatura, pues cambios en la temperatura pueden afectar a la manera en que las proteínas se pliegan, y por lo tanto afectar a su interacción con otros compuestos.[13] Como el fenotipo depende de la actividad de muchas enzimas y de sus interacciones con proteínas en general, cambios en la temperatura pueden resultar en cambios en el fenotipo.
Mariposas: cambios en la coloración de las alas de acuerdo con la estación
Diversas especies de mariposas cambian su coloración de acuerdo con las estaciones. Los cambios en coloración tienen ventajas funcionales, y por esta razón han evolucionado.[13] Usualmente, el fenotipo de los meses cálidos de verano tiene colores claros en las alas, mientras que el fenotipo de invierno muestra colores oscuros. Como los colores negros absorben la luz del sol de manera más eficiente, ayudan a aumentar la temperatura corporal durante el invierno; lo contrario ocurre durante el verano.[25]
Los cambios en coloración parecen estar controlados por la transducción de señales del ambiente al genoma a través del sistema neuroendocrino.[26] Señales del ambiente, como temperatura y longitud del día, son percibidas por los sistemas neurosensoriales del organismo. Estos luego pueden activar o desactivar la secreción de hormonas por el sistema endocrino. Las hormonas, a su vez, pueden regular la expresión génica, ya que pueden activar factores de transcripción.[13]
Las diferencias en la coloración de las alas de las mariposas en verano e invierno se dan por cambios en los niveles de la hormona ecdisona durante la etapa larval; las larvas que se desarrollan durante meses fríos están expuestas a niveles más bajos de ecdisona que las que se desarrollan en meses cálidos.[27]
Reptiles y peces: determinación del sexo
En muchos grupos de reptiles, tales como las tortugas y los cocodrilos, e igualmente en algunos peces, el sexo de un organismo depende de la temperatura de desarrollo del embrión. Este mecanismo puede haber evolucionado en algunas especies para modificar la proporción 1:1 entre sexos.[13] Por ejemplo, en cocodrilos, temperaturas altas producen más hembras, de manera que puede haber hasta 10 hembras por macho. Esto representa una ventaja para las especies en que el tamaño poblacional está limitado por el número de hembras.[28]
En los peces, el sexo parece ser determinado por la relación entre dos hormonas: el estrógeno y la testosterona, relación que a su vez es controlada por la enzima aromatasa, que convierte la testosterona en estrógeno.[13] La temperatura puede regular la aromatasa, y de esta manera determinar el sexo del organismo.[29]
Efectos dependientes de la nutrición
La comida contiene señales químicas que pueden inducir cambios fenotípicos.[13]
Abejas: la jalea real y la abeja reina
En las abejas, la producción de abejas reinas depende casi exclusivamente de la alimentación de las larvas. Las larvas que se alimentan de jalea real (que contiene altas concentraciones de proteínas y secreciones de las glándulas salivales de las abejas obreras) durante todo su desarrollo, serán abejas reinas con ovarios funcionales. Por el contrario, las larvas que son alimentadas con jalea real por cortos períodos de tiempo se convertirán en obreras sin ovarios funcionales.[13]
El consumo de jalea real causa altas tasas de síntesis de hormona juvenil (JH) en la larva. Esta hormona retrasa la metamorfosis, permitiendo que la larva se desarrolle durante más tiempo, adquiera un mayor tamaño, y desarrolle ovarios funcionales.[30] Se ha demostrado que el cambio en los niveles de producción de JH está correlacionado con el silenciamiento del gen Dnmt3, que induce una reprogramación del transcriptoma larval. El silenciamiento de este gen se produce por alteración en los niveles de metilación, por lo que es claro que la regulación epigenética es un componente clave para controlar la división social de labores en la colonia.[31]
Véase también: Abeja reina
Escarabajos: longitud de los cuernos
La calidad y cantidad de estiércol que reciben los escarabajos durante el desarrollo determina el fenotipo morfológico y comportamental de los escarabajos macho de algunas especies.[32] Esto ocurre en especies como Onthophagus taurus y Onthophagus acuminatus, en las que los machos tienen cuernos y las hembras no. Como en las abejas, la hormona juvenil afecta el fenotipo, esta vez determinando la longitud de los cuernos de los machos. A mayores concentraciones de hormona juvenil, mayor longitud de los cuernos.[33]
Como los cuernos son un factor de selección sexual para la hembra, el comportamiento de los machos con cuernos cortos cambia para asegurar su reproducción. Mientras los machos con cuernos largos, que han sido escogidos por las hembras, cuidan la puerta de la guarida, los machos de cuernos cortos cavan túneles hasta llegar a donde se encuentra la hembra, para aparearse con ella evitando confrontación con el macho de cuernos largos. De esta manera, la alimentación deficiente causa bajos niveles de hormona juvenil, que a su vez resultan en machos de cuernos cortos con comportamiento «tramposo».[34]
Humanos y sistema inmunológico
Si durante el desarrollo temprano del embrión, una mujer tiene una dieta rica en vegetales de hoja verde, esto cambiará cuán activos van a ser los genes del niño. Los investigadores en Gambia, han mostrado que los bebés, concebidos durante la época de lluvias, tienen unos niveles de actividad muy diferentes en un gen particular, que es importante para la regulación del sistema inmunológico.[5][35]
Efectos de la presencia de predadores
Algunos organismos pueden detectar la presencia de moléculas secretadas por sus predadores y usarlas para activar el desarrollo de estructuras que los hagan menos susceptibles a la depredación. Existen muchos ejemplos de esta habilidad:[13]
- El cladócero Daphnia produce una cabeza «en forma de casco puntiagudo».
- El rotífero Keratella produce espinas adicionales.
- El balano Chthamalus cambia la posición de su apertura.
- El caracol Thais produce una concha más gruesa.
- Los renacuajos de la especie Agalychnis callidryas empiezan a salir de los huevos de manera temprana en respuesta a las vibraciones causadas por las serpientes.
Efectos de la presencia de miembros de la misma especie
Señales para cambiar el fenotipo también pueden venir de conespecíficos, o miembros de la misma especie, pues los individuos deben comportarse de maneras diferentes cuando están solos y cuando están rodeados de competidores. Usualmente las señales de depredadores y conespecíficos actúan de manera sinergística para producir el fenotipo más favorable.[13] Algunos ejemplos se muestran a continuación:
- Las langostas Schistocerca gregaria muestran fenotipos muy distintos con bajas y altas densidades poblacionales. Cuando la densidad poblacional es alta y los recursos son poco abundantes, es beneficioso migrar. El fenotipo migratorio muestra colores más oscuros, alas más largas y comportamiento agresivo. Estos cambios son causadas por olores y contacto directo entre individuos.[13]
- Peces de muchas especies cambian de sexo dependiendo de la interacción con conespecíficos. Por ejemplo, en los peces goby (Lythrypnus dalli), si el macho del grupo muere, una hembra puede tomar su lugar. Pero si se inserta otro macho de mayor tamaño en el grupo, el macho que se convirtió puede revertir su fenotipo a hembra.[36]
Biomarcadores epigenéticos
Resumir
Contexto
La palabra biomarcador hace referencia a cualquier tipo de variación que ocurra en el material genético y por lo tanto es posible su detección en el organismo que porte dicho cambio. Los primeros marcadores utilizados se basan en los conceptos de la genética tradicional de tal forma que utilizaban sistemas polimórficos para detectar las variantes alélicas que llevaban a un cambio en el fenotipo.
Para la detección de modificaciones epigenéticas se desarrollaron marcadores que se encargan de detectar moléculas que se relacionen con un estado particular de activación o inactivación de un gen. Por ejemplo, la detección de una alta cantidad de moléculas de metilo, indica un estado de inactivación del gen (bloqueo de genes). Con la incorporación de técnicas moleculares, se crearon biomarcadores por medio de los SNP, Indel, RFLP y SSR o STR entre otros.
Para que un marcador sea considerado un buen marcador, éste debe requerir de una mínima cantidad de la muestra y debe permitir la identificación de diferencias significativas entre un estado normal y en un estado de cambios epigenéticos que pueden desarrollarse en una enfermedad. Basándose en esto, existe un tipo de marcadores que usan como muestra fluidos corporales y miden la concentración de ciertos metabolitos presentes, que se relacionan con cambios epigenéticos y más adelante en la formación de cáncer. Para la detección del cáncer, uno de los marcadores que se usa con mayor frecuencia son las modificaciones epigenéticas del promotor de los genes involucrados en la inhibición de kinasas, dependientes de ciclinas p15, p16 y RASSF1A. Estos sirven como marcadores de la detección de temprana de carcinomas hepatocelulares. Se toman muestras de sangre del paciente en el que se pueden detectar secuencias metiladas de los genes mencionados.
Generación de enfermedades
Resumir
Contexto
El conocimiento de estos fenómenos ha permitido que se den avances en terapias génicas. Se ha estado trabajando en revertir el silenciamiento de genes. Este trabajo se hizo en ratones con el síndrome de Rett que al ser tratados recuperaron su capacidad de producir niveles normales de la proteína MeCP2, disminuyendo así los signos de autismo que presentaban antes del tratamiento.
Un factor clave en este campo es la heredabilidad de la «marcación epigenética» de una generación a otra, lo que permite aumentar el éxito de las terapias génicas. Si los cambios estructurales de la cromatina pueden ser determinados en gran medida por los factores ambientales y esto puede ser heredable, serían importantes en la expresión adaptativa según el ambiente. Estos últimos descubrimientos han llevado a considerar no solo la expresión de los genes, sino también la manera en que dicha expresión puede ser modificada por factores ambientales.
La «regulación epigenética» se hace por medio de cambios estructurales, como es la adición de metilos, que pueden llevar a que se den alteraciones en los lugares de acción de enzimas, y como resultado, se pueden tener pérdidas en la estabilidad de dichas regiones. Por lo tanto, estas regiones se vuelven más sensibles para que en ellas se den variaciones cromosómicas o que se llegue a transformar la célula por pérdidas en el mecanismo de control de crecimiento o por activación de la apoptosis. Todo esto puede resultar en cambios en el fenotipo y una alta posibilidad del desarrollo de enfermedades.[17]
Epigenética, cáncer y la señalización NOTCH
La epigenética del cáncer está proporcionando nuevas perspectivas acerca del cáncer. Hay dos claros ejemplos de modificaciones epigenéticas en células cancerígenas:
- Se cree que la metilación del ADN es responsable del silenciamiento génico asociado con la impronta paterna, represión génica heterocromática y con la inactivación del cromosoma X. Las células cancerosas contienen patrones de metilación de ADN modificados, es decir, están mucho menos metiladas que las células normales. Además los promotores de genes en células cancerosas están hipermetilados. Por lo tanto, se cree que estas modificaciones hacen disminuir la represión de la transcripción sobre la mayoría de genes que estarían silenciados en las células normales. Estos perfiles de metilación se usan hoy en día para el diagnóstico de tumores.
- Por otro lado, las modificaciones en las histonas, las cuales también se ven afectadas en células cancerosas.
Como se conoce que la ruta de señalización Notch está involucrada tanto en el desarrollo como en la renovación de tejidos, se ha planteado el papel ideal que juega la vía de transducción de NOTCH en la proliferación del cáncer. Recientemente se han desarrollado estudios en Drosophila que han permitido comprender mejor la relación de NOTCH y la formación de tumores. NOTCH es importante, ya que tiene un papel en la determinación de destinos celulares, proliferación, apoptosis, diferenciación, migración y desarrollo celular. Con el estudio de Drosophila se determinó que los receptores de Notch en los mamíferos y los ligandos de Delta están involucrados en la formación de tumores. Una activación aberrante del receptor NOTCH1 está relacionada con el 50 % de los tipos de leucemia linfoblástica aguda de células T. Si se inactiva la vía de transducción de NOTCH se incrementa la formación de tumores, ya que se ha visto que en ciertos contextos Notch puede ser un supresor de tumores. Sin embargo, aún no se tiene un entendimiento claro de cómo in vivo Notch actúa en la formación del cáncer. Por esta razón los estudios se están enfocando en la identificación de los oncogenes y los supresores tumorales que interactúan con las vías de Notch. Con un mejor entendimiento de este tema y si se comprueba que los silenciamientos epigenéticos aumentan la formación de tumores, se pueden plantear terapias epigenéticas para combatir el cáncer.
La epigenética del cáncer es un área de investigación en curso que continúa facilitando la comprensión de la patogénesis molecular del cáncer y la identificación de nuevas alternativas terapéuticas.[37] Estas investigaciones se han basado en el descubrimiento de biomarcadores que faciliten el diagnóstico y el conocimiento del cáncer; se ha encontrado que las enzimas ADN-metiltransferasa y histona-deacetilasa son muy efectivas en el diagnóstico del cáncer, y un conocimiento aún más específico acerca de ellas ayudaría a la supresión de tumores cancerígenos.[38]
Posibles problemas con la reproducción asistida
Ya se ha mencionado que muchos de estos cambios son producto de la exposición al ambiente. En el caso de la reproducción asistida se ha generado la duda de si el tiempo de exposición al medio de cultivo puede implicar un efecto en los procesos de regulación epigenética. Dado que la etapa de desarrollo del embrión es un momento crítico en el cual se dan muchos cambios epigenéticos (como lo es una alta tasa de desmetilación para borrar las marcas epigenéticas de los parentales), el ambiente juega un papel importante hasta el punto que puede cambiar estos patrones. Durante la embriogénesis, después de borrarse la impronta de los padres, se forma un patrón de metilación de novo, el cual permite que se dé la diferenciación de tejidos. Si este proceso no se da de forma adecuada se pueden presentar enfermedades en el individuo o posibles problemas durante el embarazo que pueden llevar a la pérdida del embrión. Es por esto que se debe considerar que la exposición a un medio artificial puede llegar a tener un potencial toxicológico, impidiendo que se den los patrones de regulación adecuados. Aunque un gran porcentaje de niños nacidos por esta técnica presentan un desarrollo y crecimiento normal, se ha observado que hay una tendencia a que presenten un bajo peso al nacer y que existe un aumento de tres a seis veces en la ocurrencia de los síndromes Beckwith-Wiedemann y Angelman. Aún no hay un conocimiento claro en los humanos de cómo los distintos factores de la fecundación in vitro donde se forman los embriones, puedan tener o tengan un efecto importante en el desarrollo de los mismos. En embriones de ratón sí se han observado cambios en la impronta epigenética.
En la actualidad, se cree que la mayor incidencia de este tipo de alteraciones en niños nacidos por técnicas de reproducción asistida puede deberse a la manipulación existente en muchas de las etapas de la fecundación, como son el uso de hormonas para la estimulación ovárica, la maduración in vitro de ovocitos, el uso de espermatozoides inmaduros, la microinyección de espermatozoides, el cultivo in vitro de embriones y la criopreservación de gametos y embriones. Es decir, todos estos procesos pueden alterar la impronta genética, si bien es cierto que los datos de los que disponemos proceden, en su mayoría, de modelos animales, debido a los problemas éticos de trabajar con embriones.[39]
A pesar de ello, hay evidencias de la relación que existe entre los desórdenes de la impronta y las técnicas de reproducción asistida:
- Esterilidad masculina: en la actualidad, ya existen algunas evidencias en la bibliografía que relacionan los marcadores epigenéticos y la fertilidad masculina. En estudios realizados con ratones, la administración de agentes desmetilantes ha demostrado disminuir la producción de esperma, el tamaño del teste y el epidídimo y aumentar la mortalidad neonatal.[40] Asimismo, se ha visto que los niveles altos de metilación en el ADN espermático están relacionados con altas tasas de embarazo y, los defectos de metilación, con infertilidad.[41] Por tanto, se ha postulado que un grado de metilación elevado se debe al borrado incompleto de las marcas de metilación y no a errores en la metilación de novo. Es decir, los defectos de metilación espermáticas están relacionados con la fertilidad.[42]
- Placenta: diversos estudios han informado que se puede encontrar regiones diferenciales de hipermetilación en la placenta y de hipometilación en las muestras de sangre del cordón umbilical de los niños concebidos in vitro. Además, también pudimos demostrar diferencias de expresión génica en un subconjunto de los genes diferencialmente metilados. Observaron diferencias significativas en el 2,7% de los sitios ensayados con hipometilación en el grupo de TRA (Tecnología de la Reproducción Asistida). El grupo TRA también tenía una mayor varianza en la metilación en los sitios CpG interrogados. De todo el genoma, observamos una hipermetilación global en los sitios CCGG (~2,3 millones de sitios de este tipo en el genoma humano) y una hipometilación en los elementos de repetición LINE1 en la placenta de los embarazos concebidos mediante TRA en comparación con la placenta de control.[43]
- Embriogénesis: para que la embriogénesis se produzca de forma adecuada deben intervenir mecanismos de regulación epigenética. En concreto, se han realizado experimentos con ratones en los que se ha visto que se producen abortos cuando se bloquea la expresión de la metiltransferasa o se modifican las histonas. Asimismo, en este mismo modelo, se ha observado que son necesarias las contribuciones cromosómicas materna y paterna para conseguir un desarrollo normal.[44]
- Cultivo embrionario: recientemente, se han publicado estudios que demuestran que los embriones de ratón en dos células tienen un grado de metilación superior a los desarrollados in vivo. Asimismo, el grado de desmetilación es mayor en los pronúcleos masculinos de los embriones cultivados in vitro, comparados con aquellos in vivo, mientras que en los pronúcleos femeninos no se encontraron diferencias. Este hallazgo nos hace pensar que el cultivo embrionario puede ser el responsable del estado de hipermetilación de los embriones, es decir, que el medio de cultivo afecta a la impronta.
- Inyección intracitoplasmática (ICSI): Los informes de casos han sugerido que las parejas infértiles tratadas con ICSI tienen un mayor riesgo de defecto de impronta que causa Síndrome de Angelman (SA), Síndrome de Beckwith-Wiedeman (SBW) o Síndrome de Silver-Russel. Se realizaron un estudio de cohortes e indicaron que el riesgo de concebir un niño con un defecto de impronta causante de SA aumentaba significativamente en las parejas que se habían sometido a estimulación hormonal o ICSI. Por otra parte, se hicieron diversos estudios sobre el SBW, que es un raro trastorno de impronta, y se informó de un patrón de metilación diferente en el gen DMR1 en los tejidos embrionarios y extraembrionarios de embriones. En este caso, el procedimiento de ICSI se realizó en una pareja sin características del fenotipo del SBW. El resultado de un estudio indicó que la pérdida de metilación del alelo materno en las regiones metiladas diferencialmente (DMR) se produjo en el 37,5% de los casos de SBW con TRA y en el 6,4% de los casos sin TRA, lo que sugirió que la TRA podría estar asociada a una alteración de la impresión genómica normal en la descendencia.[43]
- Estimulación ovárica: también en modelo de ratón, se ha observado que los embriones obtenidos de ovocitos tras estimulación hormonal presentan más alteraciones de la metilación que los obtenidos sin estimulación. Es por ello que ya algunos autos han propuesto la maduración in vitro de ovocitos.
- Abortos: algunos estudios han observado las mismas alteraciones de metilación en los abortos espontáneos y en los espermatozoides tras la utilización de técnicas de reproducción asistida.
- Criopreservación de ovocitos: se encontraron que los niveles observados para H3K4me3 (triple metilación de la lisina k4) eran aproximadamente un 20% más bajos que la media, para los blastocitos bovinos congelados. Mientras que los niveles para H3K27me3 eran más altos en los blastocitos bovinos congelados y descongelados. La hipótesis que se planteó fue que el fenómeno estaba causado por el estrés celular, especialmente por el estrés oxidativo.[43]
Véase también
Referencias
Bibliografía
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
