Τα αλκένια είναι, σύμφωνα με IUPAC, ακόρεστοι αλειφατικοί (δηλαδή άκυκλοι) υδρογονάνθρακες με ακριβώς έναν διπλό δεσμό (C=C)[1]. Έχουν βαθμό ακορεστότητας 1. Τα αλκένια αποτελούν ιδιαίτερη χημική ομόλογη σειρά. Ο γενικός χημικός τύπος των αλκενίων είναι CnH2n (n=2,3..)[2]. Βάσει του τύπου αυτού, τα αλκένια είναι ισομερή θέσης με τα κυκλοαλκάνια από τα οποία, όμως, διαφέρουν πολύ στις ιδιότητες. Τα αλκένια έχουν δύο άτομα υδρογόνου (Η) λιγότερα από τα αλκάνια αφού θεωρητικά προκύπτουν από τους κορεσμένους υδρογονάνθρακες αν αφαιρεθούν δύο άτομα Η από γειτονικά άτομα άνθρακα οπότε και οι μονάδες συγγένειας που περισσεύουν δημιουργούν τον διπλό δεσμό. Το απλούστερο αλκένιο είναι το αιθένιο (CH2=CH2).
Πολλά εγχειρίδια Χημείας ταυτίζουν τα αλκένια με τις ολεφίνες, όμως οι τελευταίες αποτελούν παλαιότερη κατηγορία που χρησιμοποιεί κυρίως η Χημική Βιομηχανία και είναι ευρύτερη περιλαμβάνοντας όλους τους ακόρεστους υδρογονάνθρακες. Δηλαδή οι ολεφίνες περιλαμβάνουν όχι μόνο τα αλκένια, αλλά και τα αλκίνια, τα αλκαδιένια και κάθε άλλη ομόλογη σειρά υδρογονανθράκων που περιέχουν έναν τουλάχιστον πολλαπλό (διπλό ή τριπλό) δεσμό. Ο γενικός τύπος των αλκενίων δεν ισχύει για όσες ολεφίνες έχουν βαθμό ακορεστότητας > 1. Κάποια άλλα συγγράμματα χρησιμοποιούν τους όρους αλκένια και ολεφίνες ως ταυτόσημους και επιπλέον περιλαμβάνουν στην κατηγορία και τα μόρια με δακτυλίους δηλαδή και τα κυκλοαλκένια.
Σχηματίζουμε τη ρίζα του κατά IUPAC ονόματος των αλκενίων, όπως στα αντίστοιχα αλκάνια, αλλάζοντας το ενδιάμεσο «-αν-» σε «-εν-».[3]. Επιπλέον, όμως:
1. Η θέση του διπλού δεσμού επισημαίνεται με χρήση του αύξοντα αριθμού του πρώτου άνθρακα του διπλού δεσμού, μετά το του ονόματος, εκτός κι αν εννοείται, όπως π.χ. στο αιθένιο.
2. Ως κύρια ανθρακική αλυσίδα (κανονικά) θεωρείται κατά προτεραιότητα
- 1. Αυτή που περιέχει τον διπλό δεσμό.
- 2. Αυτή που περιέχει τις πιο πολύπλοκες διακλαδώσεις (π.χ. διακλαδώσεις με υποδιακλαδώσεις).
- 3. Αυτή που περιέχει τις περισσότερες διακλαδώσεις του πιο (ή ιεραρχικά και λιγότερο) πολύπλοκου τύπου.
- 4. Αυτή που είναι μακρύτερη.
3. Η αρίθμηση γίνεται με τέτοιο τρόπο ώστε να προκύπτει ο μικρότερος δυνατός αριθμός θέσης του διπλού δεσμού.
4. Η αρίθμηση γίνεται με τέτοιο τρόπο ώστε να προκύπτει το μικρότερο δυνατό άθροισμα αριθμών θέσης διακλαδώσεων.
Παραδείγματα:


Η διαφορά δομής των αλκενίων από τα αλκάνια είναι η ύπαρξη στα αλκένια ενός διπλού δεσμού (C=C). Όπως και οι απλοί ομοιοπολικοί δεσμοί, οι διπλοί μπορούν να περιγραφούν με όρους επικάλυψης ατομικών τροχιακών. Η διαφορά μεταξύ απλού και διπλού δεσμού είναι ότι στο πρώτο είδος έχουμε δεσμό τύπου σ και στη δεύτερη έναν τύπου σ και έναν τύπου π. Οι δεσμοί τύπου π προκύπτουν από την πλάγια επικάλυψη τροχιακών, με αποτέλεσμα να απαιτούν περισσότερο πλησίασμα των αρχικών ατόμων. Έτσι τελικά οι διπλοί δεσμοί είναι βραχύτεροι και ισχυρότεροι από τους απλούς, αλλά όχι ακριβώς στο διπλάσιο, όπως θα περίμενε ίσως κανείς από το όνομα «διπλός». Συγκεκριμένα η ενέργεια διάσπασης των δυο ειδών δεσμών είναι 611 kJ/mol για τους διπλούς έναντι 347 kJ/mol για τους απλούς. Τα μέσα μήκη τους είναι 134 pm για τους διπλούς και 154 pm για τους απλούς[4].
Κάθε άτομο άνθρακα του διπλού δεσμού χρησιμοποιεί τρία (3) sp2 υβριδικά τροχιακά για να σχηματίσει τρεις (3) σ δεσμούς με τρία (3) άτομα. Το 2p μη υβριδικό τροχιακό που απομένει σε κάθε άτομο άνθρακα του διπλού δεσμού χρησιμοποιείται για τη δημιουργία του π δεσμού. Αυτός ο δεσμός βρίσκεται έξω από τον κύριο C-C άξονα, με το κάθε ήμισυ του δεσμού σε κάθε πλευρά του.
Η περιστροφή των διπλών δεσμών εμποδίζεται από την ύπαρξη του π δεσμού, η ενέργεια διάσπασης του οποίου ανέρχεται σε 264 kJ/mol (για το αιθένιο). Το γεγονός αυτό οδηγεί στην ύπαρξη των αποκαλούμενων γεωμετρικών ισομερών σε ορισμένα αλκένια. Αυτά είναι δυνατό να διαφέρουν αρκετά σε φυσικές και σε ορισμένες (στερεοειδικές) χημικές ιδιότητες. Σε αυτές τις περιπτώσεις, τα διαφορετικά ισομερή που προκύπτουν επισημαίνονται στην ονοματολογία με τα προθέματα cis- - trans- ή Ε- - Ζ- πριν από το υπόλοιπο όνομα της ένωσης. Συνήθως τα trans- ή Ζ- ισομερή είναι σταθερότερα σε χαμηλές θερμοκρασίες. Το φυσικό μέγεθος που διαφέρει συνήθως σημαντικά ανάμεσα στα δυο ισομερή είναι η διπολική ροπή.
Ωστόσο, η περιστροφή των διπλών δεσμών και επομένως η αμοιβαία μετατροπή των γεωμετρικών ισομερών από το ένα στο άλλο, είναι δυνατή, αλλά κοστίζει ενέργεια που ισοδυναμεί ακριβώς με το ήμισυ της ενέργειας διάσπασης του π δεσμού.
Όπως προβλέπεται από το μοντέλο VSEPR αμοιβαίας άπωσης μεταξύ ζευγών ηλεκτρονίων, η μοριακή γεωμετρία των ατόμων γύρω από τον διπλό δεσμό είναι 120° (3 δεσμοί, άρα 3 ζεύγη ηλεκτρονίων 360°/3 = 120°). Στην πράξη όμως μετρούνται μικρές διαφορές, λόγω των μη δεσμικών αλληλεπιδράσεων που δημιουργούνται μεταξύ των ατόμων ή ομάδων που στερεοχημικά περιβάλλουν τον διπλό δεσμό. Π.χ. η γωνία στο προπένιο μετρήθηκε και βρέθηκε 123,9°.
Με πυρόλυση αλκανίων
Με πυρόλυση αλκανίων (βιομηχανική μέθοδος) παράγονται μίγματα που περιέχουν και αλκένια. Π.χ.:
Με αφυδάτωση αλκοολών
Με ενδομοριακή αφυδάτωση αλκοολών παράγονται αλκένια. Η αντίδραση ευνοείται σε σχετικά υψηλές θερμοκρασίες, >150 °C[5]:
Με απόσπαση υδραλογόνου
Με απόσπαση υδραλογόνου από αλκυλαλογονίδια που περιέχουν υδρογόνο σε α-θέση από το αλογόνο παράγονται αλκένια[6]:
Με απόσπαση αλογόνου
Με απόσπαση αλογόνου από 1,2-διαλογοναλκάνια παράγονται αλκένια[7]:
Με μερική καταλυτική υδρογόνωση
Με μερική καταλυτική υδρογόνωση άκυκλων περισσότερο ακόρεστων υδρογονανθράκων, όπως π.χ. αλκίνια και αλκαδιένια, παράγονται αλκένια[8]:
- α. Πσραγωγή cis- ή E-:
- β. Πσραγωγή trans- ή Z-:
Με καταλυτική αφυδρογόνωση αλκανίων
Με καταλυτική αφυδρογόνωση αλκανίων, παράγονται αλκένια :
Με θέρμανση τεταρτοταγών αμμωνιοβάσεων
Με θέρμανση τεταρτοταγών αμμωνιοβάσεων (μέθοδος Hoffmann) παράγονται αλκένια. Π.χ.[5]:
Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις
Με επίδραση φωσφοροϋλιδίων σε καρβονυλικές ενώσεις, δηλαδή (αλδεΰδες ή κετόνες) (μέθοδος Wittig) παράγονται αλκένια. Π.χ.[9]:
Οι φυσικές ιδιότητες των αλκενίων είναι συγκρίσιμες μ' εκείνες των αλκανίων. Η φυσική κατάσταση εξαρτάται κυρίως από τη μοριακή μάζα τους. Τα πρώτα μέλη της ομόλογης σειράς, μέχρι και τα βουτένια είναι αέρια. Από τα πεντένια ως και τα δεκαεξένια είναι υγρά και τα υπόλοιπα κηρώδη στερεά[10].
| Γραμμικός τύπος | Όνομα IUPAC (ελληνική μορφή) Όνομα | Μοριακή μάζα | Σημείο τήξης (°C, 1 atm) | Σημείο ζέσεως (°C, 1 atm) |
| αιθένιο αιθυλένιο | 28,05 amu | −169,2 °C | −103.7 °C | |
| προπένιο προπυλένιο | 42,08 amu | −185,2 °C | − 47.6 °C | |
| 1-βουτένιο βουτυλένιο | 56,11 amu | -185 °C | -6.3 °C | |
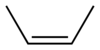 | cis-2-βουτένιο | 56,11 amu | -139 °C | 4 °C |
 | trans-2-βουτένιο | 56,11 amu | -105 °C | 1 °C |
 | μεθυλοπροπένιο ισοβουτένιο | 56,11 amu | -140.3 °C | -6,9 °C |
 | 1-πεντένιο αμυλένιο | 70,13545 amu | -138 °C | 30-31 °C |
Τέλεια καύση
- Όπου v ο αριθμός ατόμων άνθρακα του αλκενίου.
Ενυδάτωση
1. «Κατά Markownikow». Επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση). Παράγεται αλκάνόλη[11]:
2. «Αντί Markownikow». Υδροβορίωση και στη συνέχεια επίδραση με υπεροξείδιο του υδρογόνου. Παράγεται αλκυλοβοράνιο και στη συνέχεια αλκανόλη[12]:
- Προσθήκη διβορανίου έχει το ίδιο αποτέλεσμα.
3. «Κατά Markownikow». Αντίδραση με οξικό υδράργυρο και έπειτα αναγωγή:
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση αλδευδών ή κετονών σε αλκένια απουσία νερού. Π.χ.:
Προσθήκη υποαλογονώδους οξέως
Με Επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε αλκένιο παράγεται αλαλκάνόλη[13]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
Καταλυτική υδρογόνωση
Με καταλυτική υδρογόνωση αλκενίου σχηματίζεται αλκάνιο. Π.χ.[14]:<
Αλογόνωση
Με επίδραση αλογόνου (X2) (αλογόνωση) σε αλκένια έχουμε[15]:
1. Προσθήκη στον διπλό δεσμό. Παράγεται διαλογονοαλκάνιο. Π.χ.:
2. Υποκατάσταση σε αλλυλική θέση, δηλαδή σε α θέση ως προς τον διπλό δεσμό. Παράγεται αλκυλαλογονίδιο: Π.χ.:
- Η αλλυλική υποκατάσταση ευνοείται με ορισμένα ειδικά αντιδραστήρια αλογόνωσης ή σε υψηλές θερμοκρασίες.
Υδραλογόνωση
Με προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε αλκένια παράγεται αλκυλαλογονίδιο[16]: 1. Με τον πολικό μηχανισμό. Η προσθήκη γίνεται με τον κανόνα Markownikow, δηλαδή το αλογόνο (Χ) συνδέεται με το άτομο άνθρακα του πρώην αλκένιου που έχει τους περισσότερους υποκαταστάτες. Π.χ.:
2. Με τον μηχανισμό ελευθέρων ριζών. Η προσθήκη γίνεται με τον κανόνα αντι-Markownikow, δηλαδή το αλογόνο (Χ) συνδέεται με το άτομο άνθρακα του πρώην αλκένιου που έχει τους λιγότερους υποκαταστάτες. Π.χ.:
Καταλυτική αμμωνίωση
1. Προσθήκη αμμωνίας (NH3). Παράγεται πρωτοταγής αμίνη. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
2. Προσθήκη πρωτοταγούς αμίνης. Παράγεται δευτεροταγής αμίνη. Π.χ.:
3. Προσθήκη δευτεροταγούς αμίνης. Παράγεται τριτοταγής αμίνη. Π.χ.:
Καταλυτική φορμυλίωση
Με προσθήκη μεθανάλης (CO + H2) σε αλκένιο παράγεται αλδεΰδη. Π.χ.:
Προσθήκη αλδεϋδών ή κετονών κατά Prins
Με επίδραση περίσσειας αλδεϋδών ή κετονών σε αλκένια απουσία νερού, σε χαμηλή θερμοκρασία παράγονται παράγωγα διοξανίου. Π.χ.:
Διυδροξυλίωση
Η διυδροξυλίωση αλκενίων, αντιστοιχεί σε προσθήκη H2O2 και παράγει αλκανοδιόλες[17]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου. Π.χ.:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου. Αντιστοιχεί σε προσθήκη H2O2 και παράγει αλκανοδιόλη. Π.χ.:
3. Μέθοδος Sharpless:
4. Μέθοδος Woodward:
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδευδών ή κετονών σε αλκένια, παρουσία νερού. Αντίδραση Prins. Π.χ.:
Οζονόλυση
Με επίδραση όζοντος (οζονόλυση) σε αλκένια, παράγονται ασταθή οζονίδια και τελικά διασπάται το μόριο στο σημείο του διπλού δεσμού και σχηματίζονται αλδεΰδες ή και κετόνες. Π.χ.[18]:
Μετάθεση αλκενίων
Οι αλκυλικοί υποκαταστάτες μπορούν να ανταλλάξουν θέση μεταξύ δυο διαφορετικών αλκενίων. Π.χ.:
- Φυσικά το R3 έχει παρόμοιες πιθανότητες να μεταθετεί με το R2.
Αντίδραση Diels–Adler
Κατά την επίδραση αλκαδιενίου (διένιου) σε αλκένια (διενόφιλα) έχουμε την ονομαζόμενη (αντίδραση Diels–Adler) που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοεξενίου. Π.χ.[19]:
Αντίδραση Pauson-Khand
Κατά την επίδραση αλκίνια και μονοξειδίου του άνθρακα σε αλκένια έχουμε την ονομαζόμενη αντίδραση Pauson-Khand που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοπεντόνης. Π.χ.:
Προσθήκη καρβενίων
Κατά την προσθήκη καρβενίων σε αλκένιο σχηματίζεται αλκυλοκυκλοπροπάνιο. Π.χ.[20]:
- Ταυτόχρονα όμως γίνονται και αντιδράσεις παρεμβολής στους δεσμούς C-Η και C-C. Το αποτέλεσμα είναι ένα μίγμα όλων αυτών των παραγώγων.
Καταλυτική προσθήκη οξυγόνου
Κατά την καταλυτική προσθήκη οξυγόνου σε αλκένιο σχηματίζεται αλκυλοξιράνιο. Π.χ.:
Πολυμερισμός
Διακρίνονται τα ακόλουθα είδη πολυμερισμού αλκενίων[21]:
1. Κατιονικός. Π.χ.:
2.. Ελευθέρων ριζών. Π.χ.:
Φωτοχημικός διμερισμός
Κατά τον φωτοχημικό διμερισμό αλκενίων σχηματίζεται 1,3-διαλκυλοκυκλοβουτάνιο. Π.χ.[22]:
Φωτοχημική προσθήκη αλδεϋδών ή κετονών
Με επίδραση αλδευδών ή κετονών σε αλκένια απουσία νερού σχηματίζονται και φωτοχημικά παράγωγα οξενανίου (Αντίδραση Paterno–Büchi). Π.χ.::
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.

![{\displaystyle CH_{3}(CH_{2})_{6}CH_{3}{\xrightarrow[{\kappa \alpha \tau \alpha \lambda {\acute {\upsilon }}\tau \eta \varsigma }]{\triangle }}CH_{3}(CH_{2})_{3}CH_{3}+CH_{3}CH=CH_{2}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b23ca394a15dffdf71b54c63b24a61d501ae886a)
![{\displaystyle >CH-C(OH)<{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}>C=C<+H_{2}O}](http://wikimedia.org/api/rest_v1/media/math/render/svg/493c206bf0922e99618fe3e52f5841871ac354f7)
![{\displaystyle >CH-CX<+NaOH{\xrightarrow[{\triangle }]{ROH}}>C=C<+NaX}](http://wikimedia.org/api/rest_v1/media/math/render/svg/f28c03ed3eaa16807413f09c7a4871b0fddd560d)



![{\displaystyle -CH_{2}CH_{2}-{\xrightarrow[{\triangle }]{Pt}}-CH=CH-+H_{2}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/e85e14b310dd7e35667d33ec44fd0aafeacccd29)
![{\displaystyle [RCH_{2}CH_{2}N^{+}(CH_{3})_{2}CH_{2}CH_{3}]OH^{-}\xrightarrow {\triangle } CH_{2}=CH_{2}+RCH_{2}CH_{2}N(CH_{3})_{2}+H_{2}O}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3f852af78d79653babf0b34b30401c3e31405385)




![{\displaystyle RCH=CH_{2}+(CH_{3}COO)_{2}Hg+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{Et_{2}O}}RCH(OH)CH_{2}HgOOCCH_{3}{\xrightarrow {+NaBH_{4}+NaOH}}RCH(OH)CH_{3}+Hg+CH_{3}COONa+Na[BH_{3}OH]}](http://wikimedia.org/api/rest_v1/media/math/render/svg/7055918db158bde6f619978d24f602de44f143e2)











![{\displaystyle RCH=CH_{2}+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}xRCH(CH_{3})CHO+(1-x)RCH_{2}CHO}](http://wikimedia.org/api/rest_v1/media/math/render/svg/0f0e5a82faa925b76f7a6cd43ba769dd5fed8deb)
![{\displaystyle x\in [0,1]}](http://wikimedia.org/api/rest_v1/media/math/render/svg/64a15936df283add394ab909aa7a5e24e7fb6bb2)
![{\displaystyle RCH=CH_{2}+2R_{1}CHO{\xrightarrow[{\chi \alpha \mu \eta \lambda {\acute {\eta }}\;\theta \epsilon \rho \mu o\kappa \rho \alpha \sigma {\acute {\iota }}\alpha }]{H_{2}SO_{4}}}{\frac {1}{2}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3f2e4cc9b4b151c9c798a4b0d84c6527ff1303ec)





![{\displaystyle RCH=CH_{2}+OsO_{4}+2H_{2}O+2KOH{\xrightarrow {}}RCH(OH)CH_{2}OH+K_{2}[OsO_{2}(OH)_{4}]}](http://wikimedia.org/api/rest_v1/media/math/render/svg/fcedadce00ff13790fa56430d0b64787c3c6ef0d)


![{\displaystyle RCH=CH_{2}+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}RCHO+HCHO}](http://wikimedia.org/api/rest_v1/media/math/render/svg/7771ded56604dff7101389aa35db94795e30810f)








![{\displaystyle RCH=CH_{2}+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/35ffc4d07052ac4bf7f2d4b436d87dfa4f7e8ca5)







