Strontiumnitrat
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Strontiumnitrat, Sr(NO3)2, ist das Strontiumsalz der Salpetersäure. Es wird als Oxidationsmittel in der Pyrotechnik verwendet und gibt dort die strontiumtypische tiefrote Flammenfarbe.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
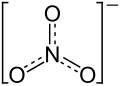 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Strontiumnitrat | |||||||||||||||
| Andere Namen |
Salpetersaures Strontium | |||||||||||||||
| Summenformel | Sr(NO3)2 | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle, die sich in der Hitze zersetzen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 211,63 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,986 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung[2] | |||||||||||||||
| Löslichkeit |
gut in Wasser (660 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−978,2 kJ/mol[4] | |||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Herstellung
Strontiumnitrat wird hergestellt, indem Strontiumcarbonat in Salpetersäure aufgelöst wird.[5]
Eigenschaften
Das wasserfreie Strontiumnitrat kristallisiert oberhalb von 31,3 °C, das Tetrahydrat unterhalb dieser Temperatur aus wässriger Lösung aus.[6] Wasserfreies Strontiumnitrat kristallisiert dabei im kubischen Kristallsystem in der Raumgruppe Pa3 (Raumgruppen-Nr. 205) mit dem Gitterparameter a = 778,13 pm. In der Elementarzelle befinden sich vier Formeleinheiten.[7] Die Kristalle sind isotyp zu Bariumnitrat. Das Tetrahydrat bildet monokline Kristalle mit der Raumgruppe C2/c (Nr. 15), den Gitterparametern a = 1112 pm, b = 1417 pm, c = 634 pm, β = 123,75° und vier Formeleinheiten in der Elementarzelle.[8]
Verwendung
Strontiumnitrat wird u. a. in der Pyrotechnik verwendet. Zusammen mit Magnesiumpulver wird bei hoher Temperatur, begünstigt durch z. B. 5-Amino-1H-tetrazol oder Hexamethylentetramin, kurzzeitig Strontium(I)-hydroxid (SrOH) erzeugt. Dieser ist ein starker Emitter im roten Spektralbereich und fungiert als alleiniger Farbgeber in lichtstarken und tiefgesättigten roten pyrotechnischen Leuchtsätzen.[9]
In Kombination mit Glycidylazid-Polymer (GAP) wird es unter dem Namen REACH-solid für den Gasgenerator des Unterwasser-Rettungssystems auf deutschen U-Booten der Klasse 212 A eingesetzt.[10][11]
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



