Ranavirus
Gattung der Familie Iridoviridae Aus Wikipedia, der freien Enzyklopädie
Ranavirus ist eine Gattung von Riesenviren (Nucleocytoviricota, NCLDVs) aus der Familie der Iridoviridae, Unterfamilie Alphairidovirinae.[2] Ranavirus ist die einzige Gattung in dieser Familie, deren Viren sowohl für Amphibien als auch Reptilien ansteckend sind. Wie auch die beiden anderen Gattungen Lymphocystivirus und Megalocytivirus der Unterfamilie Alphairidovirinae können Viren der Gattung Ranavirus auch Echte Knochenfische (Teleostei) infizieren.[3]
| Ranavirus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

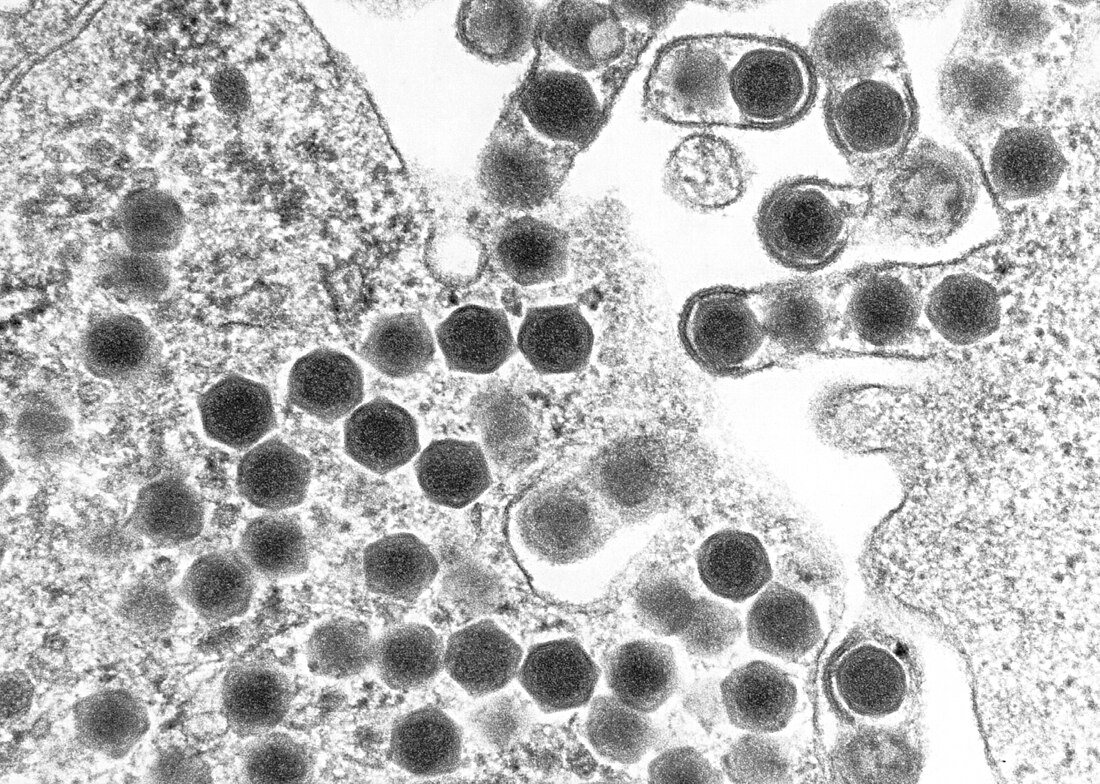
TEM-Aufnahme von Ranaviren | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Ranavirus | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Auswirkungen auf die Ökologie
Die Ranaviren sind wie die Megalocytiviren eine Gruppe eng verwandter dsDNA-Viren, deren Bedeutung immer mehr zunimmt. Sie verursachen systemische Erkrankungen bei einer Vielzahl von wilden und kultivierten Süß- und Salzwasserfischen. Wie bei Megalocytiviren sind Ranavirus-Ausbrüche in Aquakulturen von erheblicher wirtschaftlicher Bedeutung, da Tierseuchen zu beträchtlichem Verlust oder gar Massensterben von Zuchtfischen führen können. Im Gegensatz zu den Megalocytiviren wurden Ranavirus-Infektionen bei Amphibien als ein Faktor für den weltweiten Rückgang der Amphibienpopulationen in Betracht gezogen.[4][5] Der Einfluss von Ranaviren auf Amphibienpopulationen wurde mit dem des Chytridenpilz Batrachochytrium dendrobatidis, dem Erreger der Chytridiomykose, verglichen.[6][7][8] Im Vereinigten Königreich wird angenommen, dass die Schwere der Krankheitsausbrüche aufgrund des Klimawandels (soll heißen: der globalen Erwärmung) zugenommen hat.[9]
Die Vorsilbe von lateinisch Rana ‚Frosch‘ abgeleitet[10] und erinnert an die erste Isolierung eines Ranavirus aus dem Nördlichen Leopardfrosch (Rana pipiens alias Lithobates pipiens) in den 1960er Jahren.[11][12][13]
Wirte
Von den folgenden Reptilienarten ist bekannt, dass sie Ranavirus infiziert werden können:
- Grüner Baumpython (Morelia viridis alias Chondropython viridis)[14]
- Burma-Landschildkröte (Geochelone platynota)
- Pantherschildkröte (Stigmochelys pardalis alias Geochelone pardalis)[15]
- Georgia-Gopherschildkröte (Gopherus polyphemus)
- Iberische Gebirgseidechse (Lacerta monticola)[16]
- Carolina-Dosenschildkröte (Terrapene carolina carolina)[17]
- Florida-Dosenschildkröte (Terrapene carolina bauri)
- (Westliche) Schmuck-Dosenschildkröte (Terrapene ornata)[18]
- Maurische Landschildkröte (Testudo graeca)[19]
- Griechische Landschildkröte (Testudo hermanni)
- Ägyptische Landschildkröte (Testudo kleinmanni)
- Vierzehenschildkröte alias Russische Landschildkröte (Testudo horsfieldii)
- Breitrandschildkröte (Testudo marginata)
- Rotwangen-Schmuckschildkröte (Trachemys scripta elegans)[18]
- Chinesische Weichschildkröte (Pelodiscus sinensis alias Trionyx sinensis)[20]
- Blattschwanzgeckos der Spezies Uroplatus fimbriatus[21]
Aufbau
Morphologie

Ranaviren sind große ikosaedrische DNA-Viren mit einem Durchmesser von etwa 150 nm und einem unsegmentierten linearen dsDNA-Genom von etwa 105 kbp,[22] Es gibt etwa 100 Proteine kodierende Gene.[23]
Genom
Das Genom von Frog virus 3 hat eine Länge von 105.903 bp und kodiert voraussichtlich 99 Proteine.[24]
Reproduktionszyklus
Zusammenfassung
Kontext

Die Replikation der Ranaviren ist bei Frog virus 3 (FV3) gut untersucht. Die Replikation von FV3 erfolgt bei 12 bis 32 °C.[23] Ranaviren gelangen durch Rezeptor-vermittelte Endozytose in die Wirtszelle.[25] Die Viruspartikel (Virionen) sind unbeschichtet und wandern nach dem Eindringen durch die Endocytose in den Zellkern, wo die virale DNA-Replikation über eine viruskodierte DNA-Polymerase beginnt.[26] Die Virus-DNA verlässt dann den Zellkern und es beginnt die zweite Stufe der DNA-Replikation im Zytoplasma, wobei letztendlich DNA-Concatemere gebildet werden.[26] Die virale DNA wird dann in infektiöse Virionen verpackt.[27]
- Replikation am Beispiel von Frog virus 3 (FV3)
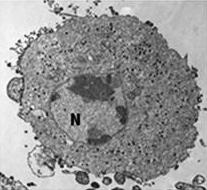
- Transmissionselektronenmikroskop-Aufnahme einer mit ECV infizierten Zelle und (kleines Bild) knospenden FV3-Virionen
- FV3-infizierte Zelle, die Virionen sind über das Zytoplasma verteilt
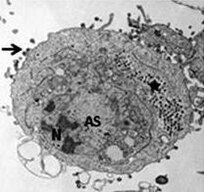
- FV3-infizierte Zelle mit Kern (N), Chromatinkondensation, viraler Assemblierungsstelle (AS), parakristallinen Anordnungen (*) und knospenden Virionen (→).
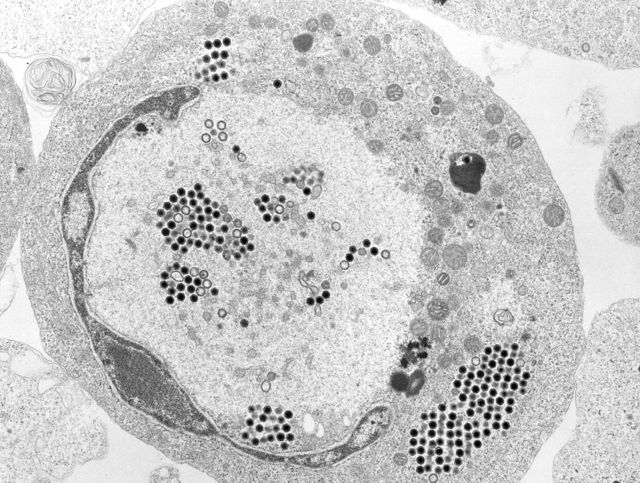
- FV3-infizierte Zelle mit verstreuten Virionen
- viralen Assemblierungsstelle mit FV3-Virionen in verschiedenen Stadien der Assemblierung. Inset: Membranen (↗), evtl. aus dem ER.
Auch das Singapore Grouper Iridovirus (SGIV), Erreger der Krankheit Singapore Grouper Iridovirus Disease (SGIVD)[28] beim Rostflecken-Zackenbarsch (Epinephelus tauvina, en. Greasy grouper)[29] ist inzwischen gut untersucht. Deren Viruspartikel werden in sog. viral assembly sites (VAS) zusammengebaut (assembliert).[30]
- Replikation am Beispiel von Singapore grouper iridovirus (SGIV)
- Kapsid-Morphogenese von Singapore Grouper Iridovirus (SGIV) in einer viral assembly site (VAS)
- Kryo-EM-Aufnahme von reifen SGI-Virionen mit asymmetrischem haarnadelförmigen Komplex auf der einen Seite (schwarzer Pfeil). Für die Sichtbarkeit ist eine in geeignete Orientierung nötig.
- Virale Akkumulation von SGIV-Partikeln zu einer parakristallinen Anordnung.
- SGIV: Proteine verformen die Membran und bilden eine spezifische spiralförmige Struktur. Die Vakuolenmembran wird so zu einem Membrantubulus, der das Virion im Inneren der Vakuole enthält (Pfeile links).
Das Genom von Ranavirus weist wie bei anderen Iridoviridae terminal redundante DNA auf.[26]
Es wird angenommen, dass die Übertragung von Ranaviren auf mehreren Wegen erfolgt, unter anderem über kontaminiertem Boden, direkten Kontakt, Exposition durch Wasser und Verschlucken von infiziertem Gewebe während der Jagd, Nekrophagie oder Kannibalismus. Ranaviren sind in Gewässern relativ stabil und können außerhalb eines Wirtsorganismus mehrere Wochen oder länger überdauern.[12]
Evolution
Die Ranaviren scheinen sich aus einem Fischvirus entwickelt zu haben, das anschließend Amphibien und Reptilien infizierte.[31]
Systematik
Zusammenfassung
Kontext


Die innere Systematik der Gattung Iridovirus ist mit Stand 30. April 2024 nach ICTV, ergänzt um einige Vorschläge in doppelten Anführungszeichen (nach NCBI, wo nicht anders angegeben):[32][33]
Familie Iridoviridae
- Unterfamilie Alphairidovirinae
- Gattung Ranavirus
- Spezies Ranavirus alytes1 (früher Common midwife toad virus, Common midwife toad ranavirus, CMTV)[34]
- Spezies Ranavirus ambystoma1
- Ambystoma tigrinum virus (ATV)
- Spezies Ranavirus gadus1
- European North Atlantic ranavirus
- Spezies Ranavirus micropterus1
- Santee-Cooper ranavirus (SCRV)
- Spezies Ranavirus perca1
- Epizootic haematopoietic necrosis virus alias Epizootic hematopoietic necrosis virus (EHNV)[30]
- Spezies Ranavirus rana1 (früher Frog virus 3, Fv3, FV3, ehem. Typusspezies)
- Bohle iridovirus (BIV)[41]
- German gecko ranavirus (GGRV)[36]
- Giant salamander iridovirus (GSIV)[30]
- Pike perch iridovirus (PPIV)[36]
- Rana grylio iridovirus (RGV)[36]
- Soft-shelled turtle iridovirus (STIV)[36]
- Tiger frog virus alias Rana tigrina ranavirus, Tiger frog ranavirus (TFV)[37][36]
- Spezies Cod iridovirus (CoIV)[36]
- Ranavirus maximus (Rmax)
Es gibt etliche weiterenach ICTV mit Stand Mai 2024 noch nicht bestätigte Kandidaten, siehe etwa Halaly et al. (2019).[36]
Einzelnachweise
Weblinks
Wikiwand - on
Seamless Wikipedia browsing. On steroids.