Top-Fragen
Zeitleiste
Chat
Kontext
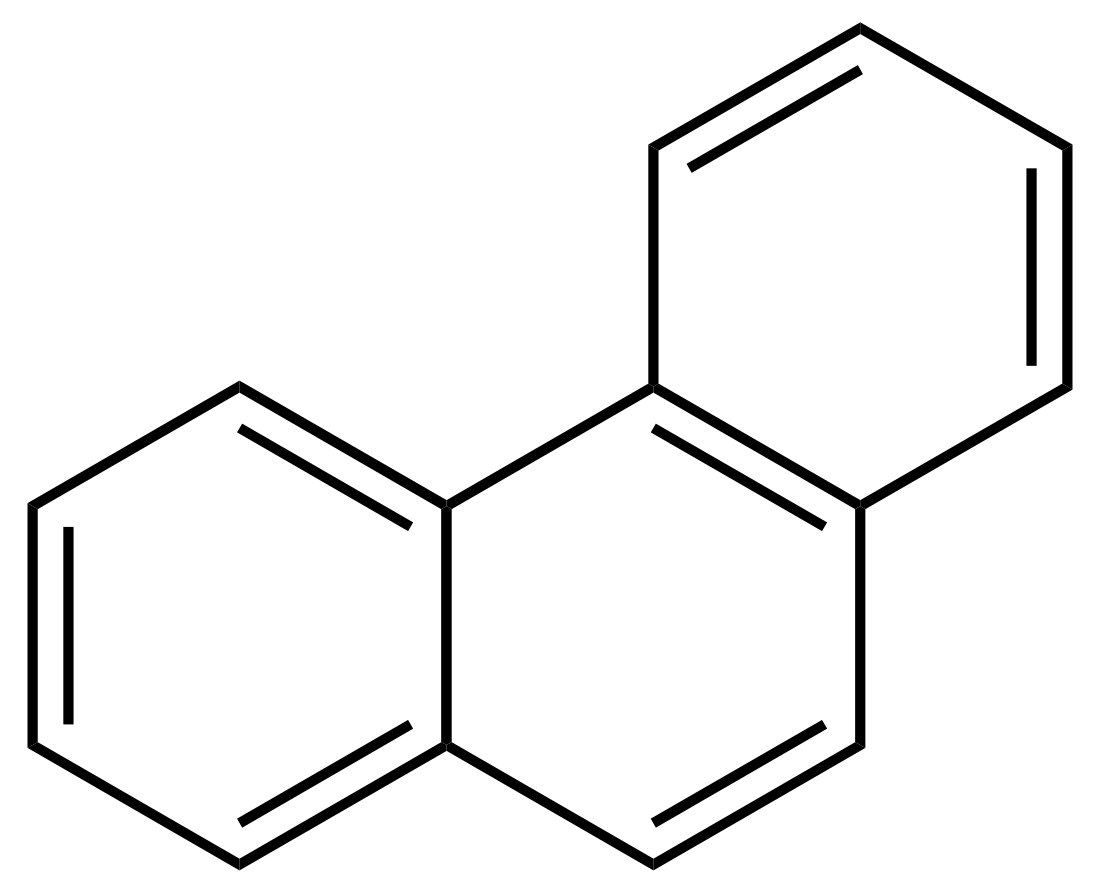
Phenanthren
organische Verbindung Aus Wikipedia, der freien Enzyklopädie
Remove ads
Phenanthren (zusammengesetzt aus Phenyl und Anthracen) ist ein farbloser bis gelblicher, kristalliner Feststoff. Es ist ein polycyclischer aromatischer Kohlenwasserstoff, enthält drei anellierte Benzolringe und gehört zur Stoffgruppe der Phene. Der aromatische Charakter ist im Vergleich zum isomeren Anthracen etwas stärker ausgeprägt, was sich an einer höheren Delokalisierungsenergie von 387 kJ/mol im Vergleich zu 351,5 kJ/mol für Anthracen zeigt.[6] Phenanthren findet sich in der Fraktion des Anthracens im Steinkohlenteer, woraus es im Wesentlichen gewonnen wird. Ein Derivat des Phenanthren, das Steran, ist Grundgerüst für die Steroide. Phenanthren wird für die Synthese von Farbstoffen verwendet.
Remove ads
Vorkommen
Natürlich kommt Phenanthren in Form des sehr seltenen Minerals Ravatit vor.[7]
Geschichte
Die Verbindung wurde erstmals 1873 unabhängig voneinander durch die deutschen Chemiker Rudolph Fittig und Eugen Ostermeyer sowie von Carl Graebe aus dem Steinkohlenteer gewonnen.[8][9] Eine erste Synthese wurde 1896 durch den deutschen Chemiker Robert Pschorr beschrieben. Bei der Pschorrschen Phenanthrensynthese werden Nitrobenzaldehyd und Phenylessigsäure umgesetzt.[10][11]
Synthese
Eine Synthese von Phenanthren wurde 1932 vom englischen Chemiker Robert Downs Haworth (1898–1990) vorgestellt und ist demnach auch als Haworth-Synthese bekannt.[12]
Die nachfolgenden Syntheseschritte werden in der Literatur[13][14] beschrieben:

Im ersten Schritt wird Naphthalin 1 mittels Friedel-Crafts-Acylierung durch Bernsteinsäureanhydrid 2 acyliert. Die dabei entstehende Ketosäure 3 wird anschließend durch eine Clemmensen-Reduktion mit Zinkamalgam und Salzsäure reduziert, sodass das Naphthalin-Derivat 4 gebildet wird. Durch Zugabe von Schwefelsäure kommt es dann zur Abspaltung von Wasser. Durch darauffolgende interne Elektronenumlagerungen, die zur Abspaltung eines Protons führen, entsteht das Keton 5. Dann folgt eine weitere Clemmensen-Reduktion, wobei der Kohlenwasserstoff 6 gebildet wird. Die Dehydrierung mit Selen im letzten Schritt liefert Phenanthren 7.
Eigenschaften
Zusammenfassung
Kontext
Mesomerie und Aromatizität
Phenanthren besitzt aufgrund des relativ großen delokalisierten Elektronensystems einen ausgeprägten aromatischen Charakter. Folglich lassen sich fünf gleichwertige mesomere Grenzstrukturen formulieren:

Physikalische Eigenschaften
Die farblosen bis gelblichen Kristalle sind geruchlos und fluoreszieren, wenn sie in Benzol gelöst werden. Hochreines Phenanthren schmilzt bei 98,5 °C.[2] Die Schmelzenthalpie beträgt 18,13 kJ/mol.[2] Bei 72,8 °C wird ein Phasenübergang höherer Ordnung beobachtet, wobei eine polymorphe Umwandlung einer Tieftemperatur- in eine Hochtemperaturkristallform stattfindet.[2][15] Der Siedepunkt liegt bei 340 °C.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,51922, B = 2428,448 und C = −70.96 im Temperaturbereich von 373 K bis 423 K[16] bzw. mit A = 4,68940, B = 2673,320 und C = −40.7 im Temperaturbereich von 477 K bis 620 K.[17] In Wasser ist Phenanthren nahezu unlöslich (0,0011 g/l), in Tetrachlorkohlenstoff, Ether, Benzol, Toluol sowie weiteren unpolaren organischen Lösungsmitteln ist es gut löslich.
Der Flammpunkt der Schmelze beträgt 171 °C.[1] Die Zündtemperatur liegt oberhalb von 450 °C.[1]
Chemische Eigenschaften
Das chemische Verhalten ist durch die besondere Reaktivität in der 9- und 10-Stellung geprägt. So führt die Bromierung zum 9,10-Dibrom-9,10-dihydrophenanthren. Beim Erhitzen dieser Verbindung wird unter HBr-Abspaltung mit 9-Bromphenanthren wieder ein aromatisches System gebildet.[6]

Eine Reduktion mit Lithium führt zum 9,10-Dihydrophenanthren.[18] Die Oxidation mit Chrom-VI-oxid ergibt 9,10-Phenanthrenchinon.[6] Eine Nitrierung[19] oder Sulfonierung[20] erfolgt ebenfalls in der 9-Position.
Kommerziell erhältliches Phenanthren enthält Anthracen-Verunreinigungen. Durch eine photochemische Reaktion von Anthracen mit N,N-Dimethylanilin gelingt es, hochreines (99,8 %) Phenanthren zu erhalten. Bei dieser Reaktion bildet sich 9-(4-Dimethylaminophenyl)-9,10-dihydroanthracen, das durch Salzsäure entfernt wird.[21]
Remove ads
Nomenklatur
Nach der IUPAC-Nomenklatur gibt es für Phenanthren, wie auch für das isomere Anthracen, einen speziellen Lokantensatz, der von der systematischen Bezifferung abweicht.[22] Dieser Lokantensatz wird teilweise auch auf heterocyclische Verbindungen mit derselben Grundstruktur (bei denen lediglich Kohlenstoffatome durch andere Atome ersetzt sind) übertragen.
- Lokanten von Phenanthren gemäß IUPAC
- Lokanten von Tricyclo[8.4.0.02,7]tetradeca-1,3,5,7,9,11,13-heptaen
gemäß der Von-Baeyer-Nomenklatur
Nach der Von-Baeyer-Nomenklatur für polycyclische Verbindungen, die allerdings für aromatische Verbindungen nicht empfohlen wird,[23] wird Phenanthren als Tricyclo[8.4.0.02,7]tetradeca-1,3,5,7,9,11,13-heptaen bezeichnet.
Remove ads
Gefahren und Metabolismus
Phenanthren reizt die Augen und Haut, es ist wassergefährdend (WGK 3).[1] Im Körper wird Phenanthren zu Naphthalin-1,2-diol oxidiert.
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads