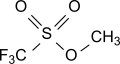
Methyltrifluormethylsulfonat (Methyltriflat, MeOTf) ist der Methylester der Supersäure Trifluormethansulfonsäure und wird als hochaktives Methylierungsagens in der präparativen organischen Chemie und als Initiator für die kationische Kettenpolymerisation, insbesondere für die ringöffnende Polymerisation cyclischer Monomerer, eingesetzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methyltrifluormethylsulfonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H3F3O3S | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 164,10 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
löslich in Dichlormethan, Schwefeldioxid, Sulfolan, Nitromethan, Dimethylsulfat[4] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Die Synthese von Methyltrifluormethylsulfonat aus dem Silbersalz der Trifluormethansulfonsäure und Methyliodid wurde erstmals 1956 berichtet.[5][6]

Die Ausbeute der Reaktion betrug lediglich 69 %.
Höhere Ausbeuten (70–80 %) werden bei der Umsetzung von Trifluormethansulfonsäureanhydrid mit Methanol erzielt.[7]

Bei dieser Reaktion geht die Hälfte des eingesetzten teuren Trifluormethansulfonsäureanhydrids (engl. triflic anhydride) verloren.
Bei der Umsetzung von Trifluormethansulfonsäure (HOTf) mit Dimethylsulfat entsteht MeOTf in 81%iger Ausbeute, allerdings zusammen mit dem Nebenprodukt Schwefelsäure, die mit HOTf verunreinigt ist.[8]

Fast quantitative Ausbeute (98 %) von Methyltriflat liefert die Reaktion von Trifluormethansulfonsäureanhydrid mit Dimethylcarbonat in Gegenwart katalytischer Mengen von HOTf.[9][10]
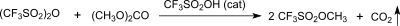
Nachteilig ist auch hier die Verwendung des teuren Trifluormethansulfonsäureanhydrids, das durch eine Kombination von Trifluormethansulfonsäure mit einem Säurechlorid – bevorzugt Benzoylchlorid – ersetzt werden kann.[11]

Diese auf einfach zugänglichen und kostengünstigen Edukten basierende Synthese liefert MeOTf in reproduzierbarer Ausbeute von 93 % bei hoher Reinheit neben Methylbenzoat als verwertbares Nebenprodukt und scheint die im industriellen Maßstab ökonomischste Route zu Methyltrifluormethansulfonat darzustellen.
Eigenschaften
Methyltriflat ist eine klare, farblose, ätzende und entzündliche Flüssigkeit, die bei Exposition bzw. Inhalation schwere Haut- und Schleimhautschäden verursacht. MeOTf mischt sich mit allen organischen Lösungsmitteln[4], reagiert aber mit vielen z. T. sehr heftig, wie z. B. Wasser zu Trifluormethansulfonsäure. Wegen der hohen Aktivität von MeOTf als Alkylierungsmittel muss von einem signifikanten karzinogenen[12] und mutagenen Potential ausgegangen werden.
Anwendungen
Methylierungen mit Methyltrifluomethylsulfonat
Methyltrifluormethylsulfonat mit der ausgezeichneten Abgangsgruppe Trifluormethansulfonat ist ein sehr reaktionsfreudiges Methylierungsmittel, das in seiner Reaktivität – gemessen durch Alkoholyse von Modellestern[13] – nur durch Meerwein-Salze, wie z. B. Trimethyloxoniumtetrafluoroborat[14] übertroffen wird.
Die Abstufung der Reaktivität von Methylierungsmitteln[13][14][15] entspricht in etwa: (CH3)3O+ BF4− (Trimethyloxonium-tetrafluoroborat) > CF3SO2OCH3 (Methyltriflat) > FSO2OCH3 (Methylfluorsulfonat) >> H3C-Phenyl-SO2OCH3 (Methyltosylat) > CH3SO2OCH3 (Methylmethansulfonat) >> (CH3O)2SO2 (Dimethylsulfat) > CH3I (Methyliodid) > CH3Br (Methylbromid)
Gegenüber dem festen und extrem hygroskopischen Meerwein-Salz und den außerordentlich toxischen Methylfluorsulfonat und Dimethylsulfat ist Methyltriflat leichter handhabbar, weniger gefährlich und erfordert weniger drastische Reaktionsbedingungen, die bei der Methylierung chiraler Moleküle zu geringerer oder keiner Racemisierung führen.[16]
Methyltriflat hat für die Einführung von Methylgruppen breite Anwendung in der organischen Chemie gefunden.[13]
So werden Hydroxygruppen von Kohlenhydraten effektiv und selektiv mit MeOTf methyliert.[17][18]
Aliphatische, alicyclische und aromatische Stickstoffverbindungen sowie aliphatische Phosphorverbindungen werden ebenfalls in praktisch quantitativer Ausbeute durch Reaktion mit Methyltrifluormethylsulfonat in die entsprechenden quartären Ammonium- bzw. Phosphoniumsalze überführt.[10][9][11]
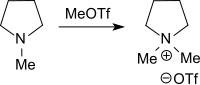
Einige dieser Verbindungen finden als Phasentransferkatalysatoren oder Ionische Flüssigkeiten Verwendung.
Auch sterisch gehinderte Stickstoffaromaten, wie z. B. 2,4,6-Trimethylpyridin werden mit Methyltriflat glatt methyliert, nur extrem gehinderte Pyridine, wie z. B. 2,4,6-Tris(t-butyl)pyridin reagieren kaum.
Analog werden S-Verbindungen durch Methyltriflat zu S-Methylsulfoniumsalzen methyliert.[19]

Kationische Polymerisation mit Methyltriflat
Methyltriflat initiiert die lebende kationische Polymerisation von Lactid[20] und von Lactonen[21] wie z. B. β-Propiolacton, ε-Caprolacton oder auch Glycolid zu den entsprechenden Polylactonen

bzw. von cyclischen Carbonaten[22], wie z. B. Trimethylencarbonat und Neopentylencarbonat (5,5-Dimethyl-1,3-dioxan-2-on) zu den entsprechenden Polycarbonaten.
2-Alkyl-2-oxazoline[23] wie z. B. 2-Ethyl-2-oxazolin werden durch Methyltrifluormethylsulfonat ebenfalls in einer lebenden kationischen Polymerisation zu Poly(2-alkyloxazoline)n polymerisiert.
Einzelnachweise
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.



