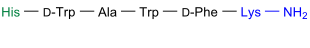Hexapeptide
Aus sechs Aminosäuren bestehende Oligopeptide Aus Wikipedia, der freien Enzyklopädie
Hexapeptide sind Oligopeptide, die aus sechs Aminosäure-Bausteinen aufgebaut sind. Die Bezeichnung „Aminosäure-Baustein“ kommt daher, dass die einzelnen Aminosäuren über Peptidbindungen miteinander verknüpft sind. Dabei erfolgt die Ausbildung einer solchen Bindung durch Wasserabspaltung zwischen der Aminogruppe einer Aminosäure und der Carboxygruppe einer anderen Aminosäure.
Wie die meisten Peptide, übernimmt auch die Mehrheit der Hexapeptide eine wichtige Rolle im Organismus eines Lebewesens und/oder ist pharmakologisch aktiv.
Lineare Hexapeptide
Zusammenfassung
Kontext
Unter linearen Hexapeptiden werden Hexapeptide verstanden, bei denen die Aminosäuren-Bausteine über fünf Peptidbindungen in einer Kette miteinander verknüpft sind.
Acetylhexapeptid 8
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
  Acetylhexapeptid 8 |
Acetylhexapeptid 8 (auch: Acetylhexapeptid-3,[2] proprietärer Name Argireline) ist ein synthetisches Hexapeptid mit einer Acetylgruppe am N-Terminus sowie einer Aminogruppe am C-Terminus, das 2002 von einer Gruppe um den spanischen Chemiker Antonio Ferrer-Montiel (* 1962)[3] hergestellt wurde.[4] Acetylhexapeptid 8 bzw. ACETYL HEXAPEPTIDE-8 (INCI)[5] ist ein kosmetischer Inhaltsstoff zur Feuchthaltung der Haut. Er zeigte in vitro Wechselwirkungen mit SNARE-Proteinen und der Catecholaminfreisetzung aus chromaffinen Zellen. Cremes mit Acetylhexapeptid 8 werden als Antifalten-Mittel beworben.[6][7]
Calpinactam
Calpinactam ist ein 2009 von einer Gruppe um den Japaner Hiroshi Tomoda aus dem Pilz Mortierella alpina isoliertes Hexapeptid.
GHRP-6
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
 GHRP-6 |
GHRP-6 ist die englische Abkürzung für Growth Hormone-Releasing Peptide-6 und bedeutet übersetzt „Wachstumshormon freisetzendes Hexapeptid“. Es ist damit ein Wachstumshormon-Sekretagogum und verbessert zusätzlich die Gewebe-Viabilität verschiedener Organe.[8] GHRP-6 ist ein synthetisches Peptid, das 1983 erstmals durch eine Gruppe um den US-Amerikaner Cyril Y. Bowers hergestellt wurde.[9]
Neuromedin N
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
  Neuromedin N |
 Neuromedin N ist im Rückenmark von Schweinen enthalten[10] |
Neuromedin N ist ein Neuropeptid mit ähnlicher Wirkung wie Neurotensin.[11] 1984 wurde es von einer Gruppe um den Japaner Naoto Minamino (* 1953)[12] erstmals aus dem Rückenmark von Schweinen isoliert.[10]
Cyclische Hexapeptide
Zusammenfassung
Kontext
Cyclische Hexapeptide sind Hexapeptide mit einer ringförmigen Gestalt. Im Gegensatz zu den linearen Hexapeptiden, kommt es durch Ausbildung einer sechsten Peptidbindung zu einem Ringschluss. Dieser kann auch erfolgen, wenn eine andere kovalente Bindung vorliegt.
Echinocandin B
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
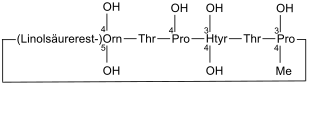 |
 Echinocandin B kommt im Schimmelpilz Aspergillus nidulans vor[13] |
Echinocandin B ist ein Antimykotikum. Es wurde 1974 durch die Schweizer Firma CIBA-GEIGY aus dem Schimmelpilz Aspergillus nidulans isoliert.[13]
Dieses Peptid hemmt die Synthese von β-(1,3)-D-Glucan, einem wichtigen Bestandteil der Zellwände von Pilzen, sodass es eine antifungische Wirkung aufweist (z. B. gegen Candida albicans).[14]
An der Struktur von Echinocandin B ist besonders, dass dieses Peptid Linolsäure enthält, wodurch es zur Hämolyse kommen soll.[15] Um zu überprüfen, ob es weitere Peptide gibt, die die Synthese von β-(1,3)-D-Glucan ebenfalls unterbinden und effizienter sind, wurde nach weiteren natürlich vorkommenden Peptiden gesucht und Analoga dieser hergestellt.[16] Dazu gehört z. B. Caspofungin.
Bouvardin
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) |
Natürliches Vorkommen |
  Bouvardin |
 Bouvardin ist in der Pflanze Bouvardia ternifolia (Rubicae) enthalten[17] |
Bouvardin wurde 1977 von einer Forschergruppe um den US-Amerikaner Jack R. Cole (* 1929)[18] aus der Pflanze Bouvardia ternifolia (Rubicae) isoliert.[17] Dieses Peptid zeigt Anti-Tumor-Aktivität gegen lymphatische Leukämie und gegen das maligne Melanom, indem es insbesondere die Protein-Synthese hemmt.[17][19][20]
Siehe auch
Literatur
- E. Boschetti, P. Giorgio Righetti: Hexapeptide combinatorial ligand libraries: the march for the detection of the low-abundance proteome continues. In: BioTechniques. Band 44, Nummer 5, April 2008, S. 663–665, doi:10.2144/000112762. PMID 18474042.
- A. Fröhlich, C. Lindermayr: Deep insights into the plant proteome by pretreatment with combinatorial hexapeptide ligand libraries. In: Journal of Proteomics. Band 74, Nummer 8, August 2011, S. 1182–1189, doi:10.1016/j.jprot.2011.02.019. PMID 21354349.
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.