Top-Fragen
Zeitleiste
Chat
Kontext
Eisen(II)-sulfid
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Remove ads
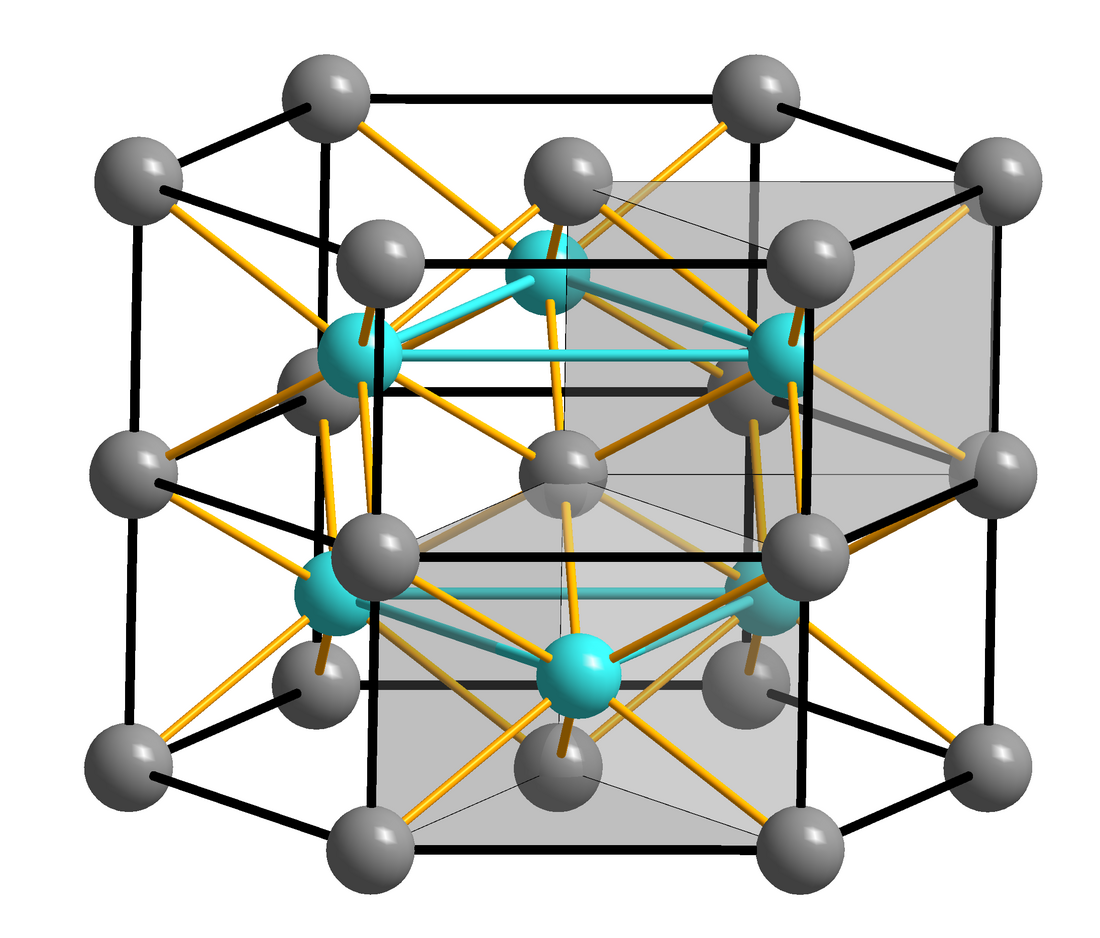
Eisen(II)-sulfid (alte Bezeichnung Schwefeleisen) ist das Sulfid des zweiwertigen Eisens mit der Formel FeS.
Remove ads
Remove ads
Eigenschaften

Eisen(II)-sulfid ist unlöslich in Wasser. Mit Säuren reagiert es unter Bildung von Schwefelwasserstoff:
Beim Erhitzen auf höhere Temperaturen erfolgt bei 138 °C und 325 °C jeweils eine kristallographische Umwandlung im festen Zustand.[3] Reines Eisen(II)-sulfid bildet hellbraune Kristalle des Nickelarsenid-Typs. Die technische Ware ist meist durch Resteisen dunkel bis schwarz gefärbt.
Remove ads
Herstellung
Sowohl im Labor als auch technisch lässt sich Eisen(II)-sulfid durch kurzes Erhitzen eines Gemisches aus Eisenpulver und Schwefelpulver in einer exothermen Reaktion herstellen:
Vorkommen
In der Natur findet sich Eisen(II)-sulfid als Pyrrhotin, Troilit und Mackinawit.[4]
Die bakterielle anaerobe Korrosion kann man durch die Schwarzfärbung durch Eisen(II)-sulfid erkennen, welches als Endprodukt entsteht. Dieser archaische Stoffwechsel der Bakterien spielt in der Eisen-Schwefel-Welt, einem Szenario für die frühe Evolution des Lebens, eine wichtige Rolle.
Die Grünfärbung von Eigelb stammt von bei langem Kochen (länger als 10 Minuten) gebildetem – unschädlichem – Eisensulfid.
Verwendung
Eisen(II)-sulfid wurde früher für die Synthese der Schwefelsäure verwendet. Dabei wurde das Eisen(II)-sulfid unter Zufuhr von Luft geröstet, wobei das für die weitere Synthese benötigte Schwefeldioxid entstand. Im Labor kann Eisen(II)-sulfid zur Herstellung von Schwefelwasserstoff dienen. Dies kann z. B. im Kippschen Apparat durchgeführt werden.
Siehe auch
- Eisen(II)-disulfid (FeS2)
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads