Curium(III)-fluorid
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Curium(III)-fluorid ist eine chemische Verbindung aus den Elementen Curium und Fluor. Es besitzt die Formel CmF3 und gehört zur Stoffklasse der Fluoride. Da alle Isotope des Curiums nur künstlich hergestellt sind, besitzt es keine natürlichen Vorkommen.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
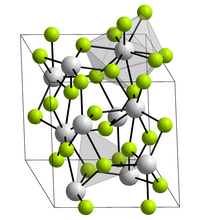 | |||||||
| _ Cm3+ _ F− | |||||||
| Kristallsystem | |||||||
| Raumgruppe |
P63/mmc (Nr. 194) | ||||||
| Gitterparameter |
a = 699,9 pm | ||||||
| Koordinationszahlen |
Cm[9], F[3] | ||||||
| Allgemeines | |||||||
| Name | Curium(III)-fluorid | ||||||
| Andere Namen |
Curiumtrifluorid | ||||||
| Verhältnisformel | CmF3 | ||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | je nach Isotop: 295–309 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
nahezu unlöslich in Wasser (10 mg·l−1)[3] | ||||||
| Gefahren- und Sicherheitshinweise | |||||||

Radioaktiv | |||||||
| |||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Darstellung
Zusammenfassung
Kontext
Curium(III)-fluorid kann durch die Umsetzung einer wässrigen Curiumlösung mit Fluoridsalzen im schwach Sauren hergestellt werden.
Eine zweite Möglichkeit ist durch die Umsetzung von Curium(III)-hydroxid mit Flusssäure gegeben. Auf diese Arten hergestelltes Curium(III)-fluorid enthält immer einige Moleküle Kristallwasser. Das wasserfreie Salz kann durch Trocknung mit heißem gasförmigem Fluorwasserstoff oder durch Trocknung im Exsikkator über Phosphor(V)-oxid erhalten werden.[2]
Eigenschaften
Curium(III)-fluorid ist ein farbloser Feststoff, der bei 1406 °C schmilzt. Die molare Masse ist abhängig vom verwendeten Isotop, beziehungsweise der Isotopenzusammensetzung. Es kristallisiert in der Lanthanfluoridstruktur mit den Gitterparametern a = 699,9 pm und c = 717,9 pm.[5] Hierbei ist jeder Curiumkern von neun Fluorkernen in einer verzerrten dreifach-überkappten trigonal-prismatischen Struktur umgeben.[6] Die Standardbildungsenthalpie ΔfH0 wird auf 1660 kJ/mol abgeschätzt, die Bildungsentropie ΔfS0 auf 121 J·mol−1K−1 (298 K).[7][3]
Verwendung
Metallisches Curium kann durch Reduktion aus Curium(III)-fluorid erhalten werden. Dieses wird hierzu in wasser- und sauerstofffreier Umgebung in Reaktionsapparaturen aus Tantal und Wolfram mit elementarem Barium zur Reaktion gebracht.[8]
Sicherheitshinweise
Einstufungen nach der CLP-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Literatur
- Gregg J. Lumetta, Major C. Thompson, Robert A. Penneman, P. Gary Eller: Curium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1397–1443 (doi:10.1007/1-4020-3598-5_9).
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


