Cumol
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Cumol ist eine organisch-chemische Verbindung aus der Stoffgruppe der aromatischen Kohlenwasserstoffe. Aufgrund der eleganten Überführung in Phenol und Aceton nach dem Hock-Verfahren und dessen großtechnischer Verbreitung in den fünfziger Jahren wurde es zu einem bedeutenden Zwischenprodukt der chemischen Industrie.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
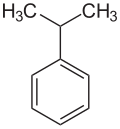 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cumol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C9H12 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit scharfem, aromatischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 120,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,86 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
152 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,49146 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Geschichte
Cumol wurde 1840 bei der Decarboxylierung von Cuminsäure entdeckt. Der erste Namensvorschlag der Entdecker war Cumen, sie verwendeten den ersten Wortbestandteil der Cuminsäure. Justus v. Liebig schlug dann den Namen Cumol vor, der fortan Eingang in die deutsche Literatur fand.[6]

Gewinnung und Darstellung
Zusammenfassung
Kontext
Die technisch ausschließlich genutzte Methode zur Herstellung von Cumol beruht auf der Friedel-Crafts-Alkylierung von Benzol mit Propen. Die Umsetzung erfolgt entweder in der Flüssig- oder Gasphase. Als Katalysatoren werden vorwiegend Lewis- oder Brønsted-Säuren sowie neuerdings auch saure Zeolithe eingesetzt.
Flüssigphase
Im Flüssigphasenprozess setzt man Benzol mit Propen bei 35–40 °C und niedrigem Propendruck von etwa 7 bar in Gegenwart von Aluminiumchlorid (AlCl3) zu Cumol um.[7]

Außerdem ist ein Verfahren mit Fluorwasserstoff bei 50–70 °C und ebenfalls geringem Propendruck bekannt. Bei der säurekatalysierten Alkylierung wird selten und vereinzelt noch Schwefelsäure eingesetzt.[7]
Gasphase
Die Alkylierung von Benzol mit Propen in der Gasphase wird bei Temperaturen von 200–250 °C und Drücken von 20–40 bar an Phosphorsäure-Katalysatoren, welche auf Siliciumdioxid geträgert sind und Bortrifluorid als Promotor enthalten, durchgeführt. Die gesamte Reaktion läuft dabei im Festbettreaktor ab.[7]

Die Selektivitäten erreichen hierbei 96–97 % bezogen auf Benzol und 91–92 % bezogen auf Propen. Als Nebenprodukte entstehen nur geringe Mengen an Di- und Triisopropylbenzol sowie Propylbenzol. Nach einer destillativen Aufarbeitung erhält man Cumol in einer Reinheit von mehr als 99,5 %.[7]
Die weltweiten Herstellkapazitäten für Cumol betrugen im Jahr 2004 mehr als 10,5 Millionen Jahrestonnen.[7] Im Jahr 2019 steigerte sich die globale Kapazität auf 19 Millionen Tonnen.[8] Seit den 1990ern werden zunehmend Zeolite als Katalysatoren verwendet.[9]
Eigenschaften
Zusammenfassung
Kontext
Cumol hat einen charakteristischen, aromatischen Geruch, die Geruchsschwelle liegt bei 0,04–6,4 mg·m−3. In vielen gängigen organischen Lösungsmitteln, z. B. Ether und Ethanol, ist Cumol löslich, in Wasser hingegen sehr schwer löslich.
Physikalische Eigenschaften
Cumol ist eine farblose Flüssigkeit, die unter Normaldruck bei 152 °C siedet.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,05419, B = 1455,811 und C = −65.948 im Temperaturbereich von 343,2 K bis 426,5 K.[10] Wichtige thermodynamische Größen werden in der folgenden Tabelle gegeben:
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−41,2 kJ·mol−1[11] 3,92 kJ·mol−1[11] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −5215,44 kJ·mol−1[11] | als Flüssigkeit |
| Wärmekapazität | cp | 215,4 J·mol−1·K−1 (25 °C)[12] 1,79 J·g−1·K−1 (25 °C) |
als Flüssigkeit |
| Kritische Temperatur | Tc | 631 K[13] | |
| Kritischer Druck | pc | 32,1 bar[13] | |
| Kritische Dichte | ρc | 2,32 mol·l−1[14] | |
| Verdampfungsenthalpie | ΔVH | 41,2 kJ·mol−1[15] | bei 364 K |
| Schmelzenthalpie | ΔfusH | 7,326 kJ·mol−1[12] | am Schmelzpunkt |
Sicherheitstechnische Kenngrößen
Cumol bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 31 °C.[1] Der Explosionsbereich liegt zwischen 0,8 Vol.‑% (40 g/m3) als untere Explosionsgrenze (UEG) und 6 Vol.‑% (300 g/m3) als obere Explosionsgrenze (OEG).[1][16] Der untere Explosionspunkt liegt bei 29 °C.[1] Die Grenzspaltweite wurde mit 1,05 mm bestimmt.[1][16] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[16] Die Zündtemperatur beträgt 420 °C.[1][16] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Cumol dient als Zwischenprodukt zur Herstellung von Phenol und Aceton nach dem Cumolhydroperoxid-Verfahren (Hock-Verfahren).[17]

In seltenen Fällen wird es auch als Lösungsmittel eingesetzt. Cumol wird auch als Klopfschutzmittel im Flugtreibstoff verwendet. Gegenüber dem auch verwendbaren Benzol besitzt es einen wesentlich niedrigeren Stockpunkt von ca. −96 °C.
Sicherheitshinweise
Cumol ist entzündlich und reizt die Atmungsorgane. Es kann zudem die Haut (Brennen/Jucken) und die Augen reizen, die Leber schädigen und zu Schwindel und Benommenheit führen. Die Internationale Agentur für Krebsforschung stufte Cumol im Jahr 2013 als möglicherweise krebserzeugend ein.[18]
Cumol wurde auf der Grundlage neuer Karzinogenitätsdaten aus den USA neu bewertet. Cumol zeigte eine krebserregende Aktivität bei Ratten und Mäusen aufgrund erhöhter Inzidenzen von Nasen- und Nierentumoren bei Ratten und Lungen- und Lebertumoren bei Mäusen. Die PDE für Cumol wurde von 55 mg/Tag (Klasse 3) auf 0,7 mg/Tag (Klasse 2) gesenkt.[19]
Weblinks
Commons: Cumol – Sammlung von Bildern, Videos und Audiodateien
- Eintrag zu Cumol. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.




