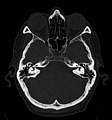
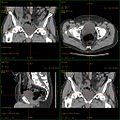
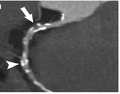
Die Computertomografie bzw. Computertomographie (von altgriechisch τομή tomé, deutsch ‚Schnitt‘ und γράφειν gráphein, deutsch ‚schreiben‘), Abkürzung CT, ist ein bildgebendes Verfahren in der Radiologie. Alternative Bezeichnungen sind CT-Scan, CAT-Scan (von computer-assisted tomography oder computed axial tomography) oder Schichtröntgen.

Im Gegensatz zur Röntgentomographie wird bei der Computertomografie ein Computer benutzt, um aus den Absorptionswerten von Röntgensignalen, die aus verschiedenen Richtungen durch den Körper treten, digital Schnittbilder zu errechnen.
Ab Einführung der ersten einfachen Geräte 1972 setzte sich die Computertomografie schnell durch, da sie im Gegensatz zu einer normalen Röntgenaufnahme eine überlagerungsfreie Darstellung der Körperstrukturen ermöglicht. Die Darstellung von Gewebearten mit unterscheidender Schwächung für Röntgenstrahlung was bis dahin nur sehr eingeschränkt möglich war.[1]
Mit über 6,8 Millionen Einsätzen im Jahr 2022 ist die Computertomografie das am häufigsten angewandte dreidimensionale bildgebende Verfahren in deutschen Krankenhäusern und wurde mehr als dreimal so häufig eingesetzt wie die Magnetresonanztomografie.[2]
Verwandte Verfahren sind die digitale Volumentomographie[3] und die Rotationsangiographie.
Funktionsweise

Beim herkömmlichen Röntgenverfahren wird das abzubildende Objekt von einer Röntgenquelle durchleuchtet und auf einem Röntgenfilm abgebildet. Es entsteht eine Projektion des Volumens auf eine Fläche. In Strahlrichtung hintereinander liegende Bildteile des durchleuchteten Körpers überlagern sich zwangsläufig. Dadurch kann beispielsweise nicht unterschieden werden, ob die im Röntgenbild sichtbare Schwächung (helle Bereiche im Bild) durch ein Material höherer Absorption oder durch eine größere Schichtdicke hervorgerufen wurde (siehe Lambert-Beersches Gesetz).
In der Computertomografie werden Absorptionsprofile des Objekts aus vielen Richtungen erstellt und daraus die Volumenstruktur rekonstruiert. Im Gegensatz zum klassischen Röntgen bestehen die gemessenen Daten nicht aus einem zweidimensionalen Bild, sondern sind ein eindimensionales Absorptionsprofil. (In heutigen Geräten werden bei einem Röhrenumlauf jedoch mehrere, bis zu 320 derartige Zeilen ausgelesen.)
Erst durch die computergestützte Bildrekonstruktion, die heute häufig mit dem Algorithmus der gefilterten Rückprojektion erfolgt, kann für jedes Volumenelement des Objektes (sog. Voxel, entspricht einem dreidimensionalen Pixel) der Absorptionsgrad ermittelt und das Bild errechnet werden.[4][5]
Das errechnete Bild ist ein Transversalschnitt durch das Untersuchungsobjekt. Mit mehreren aufeinander folgenden Röhrenumläufen lassen sich angrenzende Schnitte erzeugen. Volumengrafiken setzen sich aus mehreren Dutzend, bis zu mehreren hundert Einzelschnitten zusammen.
Für die Bildentstehung beim Computertomografen ist ein Computer zwingende Voraussetzung, da das Bild nicht wie beim klassischen Röntgenverfahren unmittelbar entsteht, sondern erst aus den gemessenen Daten errechnet werden muss. Für die Berechnung eines CT-Bildes sind Projektionen nötig, die mindestens eine 180°-Rotation um das abzubildende Objekt abdecken.
Aufbau
Jeder CT-Scanner besitzt einen kurzen Ringtunnel, auch Gantry genannt, sowie einen elektromotorisch beweglichen Tisch, auf dem der Patient bzw. das Untersuchungsobjekt liegt. Im Rahmen der Untersuchung wird das zu untersuchende Körperteil oder Objekt parallel zum Aufnahmeprozess durch diesen Tunnel gefahren. Für die Erzeugung der Hochspannung, Berechnung der Daten und Steuerung des Gerätes sind meist noch ein oder mehrere Schaltschränke vorhanden, die jedoch variabel platzierbar sind. Sie können sich im Untersuchungsraum, im Bedienraum oder in einem getrennten Raum befinden. Außerhalb des Untersuchungsraumes befindet sich die Bedienkonsole, mit der das Personal den Ablauf der Untersuchung steuert.
- Typischer CT-Scanner: Im Bild vorne, rechts: Gantry und Patiententisch. links neben Gantry: die Kontrastmittelpumpe zur Verabreichung eines Kontrastmittels. In rechter Raumecke eine Stromversorgungseinheit mit Transformatoren, rechts daneben ein Geräteschrank.
- Die Gantry mit abgenommenem Gehäuse: „D“ markiert den Detektorkranz, bei „T“ befindet sich die Röhre (englisch Tube), die ihren Fächerstrahl in Richtung der roten Linien abgibt. „R“ markiert die Rotationsrichtung von Röhre und Detektor.
- Die roten Pfeile markieren das Strahlaustrittsfenster der Röhre eines 16-Zeilen CTs. Rechts im Bild der Röhrentank; in den oben und unten angeschlossenen Rohrleitungen läuft die Kühlflüssigkeit zur Kühlung der Röhre.
- Die roten Pfeile zeigen auf den Detektor eines 16-Zeilen-Computertomographen aus dem Jahr 2009.
- Bedienkonsole eines 16-Zeilen-CTs: Auf dem linken Bildschirm Wiedergabe der Übersichtsaufnahme, für das Bedienpersonal zur Untersuchungsplanung. Rechter Monitor zeigt das lokale Bilddatenarchiv.
- Video eines laufenden CTs bei abgenommener Gehäuseabdeckung. Im Untersuchungsalltag rotieren Detektor und Röhre unsichtbar und nur geringfügig hörbar innerhalb des Gehäuses, während der Patient oder das Objekt durch die Gantry gefahren wird.
Geschichte

Die mathematischen Grundlagen der heute genutzten Computertomografie wurden 1917 durch den österreichischen Mathematiker Johann Radon entwickelt. Die Radontransformation bildet die Grundlage zur Berechnung räumlicher Aufnahmen eines Objektes und seiner von Röntgenstrahlen durchdringbaren Innenstruktur mit Hilfe der gefilterten Rückprojektion.
In den 1930er Jahren wurden im Rahmen der konventionellen Radiologie tomographische Verfahren entwickelt.[6]
Allan M. Cormack erarbeitete zwischen 1957 und 1963 Studien über die Absorption von Röntgenstrahlung durch menschliche Gewebe und entwickelte unabhängig von Radons Arbeiten dazu passende mathematische Methoden; er postulierte darauf aufbauend, dass auch geringe Absorptionsunterschiede darstellbar seien. Wie sich Cormack 1992 erinnerte, musste er das mathematische Problem allerdings selbst lösen, da er erst 1972 durch Zufall von Radons grundlegender Arbeit erfuhr.[7] Im Rahmen seiner Nachforschungen entdeckte er auch, dass Radon seinerseits auf Vorarbeiten von Hendrik Antoon Lorentz hätte zurückgreifen können, die ihm aber ebenfalls nicht bekannt waren.[1] Unter anderem in Ermangelung eines Computers konnte Cormack seine Ideen jedoch nicht in Form konkreter Apparaturen umsetzen.
Erst der bei EMI angestellte Elektrotechniker Godfrey Hounsfield realisierte im Jahr 1969 Prototypen und brachte sie zur Marktreife. Er kannte die Vorarbeiten von Cormack nicht und musste die Algorithmen für die Bildrekonstruktion ebenfalls aufwändig selbst entwickeln.[1]
Bei Hounsfields ersten Laborgeräten wurde im Jahr 1969 noch eine Isotopenquelle als Strahlenquelle verwendet, und die Abtastzeit betrug neun Tage.[1] Cormack und Hounsfield erhielten für ihre Arbeiten 1979 gemeinsam den Nobelpreis für Physiologie oder Medizin.
Nach einer Reihe von Tieruntersuchungen zum Beleg der Unbedenklichkeit wurde die erste CT-Aufnahme an einem Menschen im Jahr 1971 aufgenommen. Schon 1972 wurde der erste kommerzielle Computertomograf, der EMI Mark 1, für die klinische Anwendung im Londoner Atkinson Morley Hospital installiert.[8] Ende 1974 hatte EMI 60 derartige Scanner verkauft und installiert. In Deutschland wurde 1976 im Deutschen Krebsforschungszentrum in Heidelberg unter der Leitung von Walter Lorenz der erste Ganzkörper-Computertomograph[9] in Betrieb genommen.
Meilensteine der CT-Entwicklung
Die Geschichte der Computertomografie ist voller Innovationen, die alle Teilbereiche des Gerätes betreffen. Sie betreffen die Anordnung und Bauart von Gantry, Röhre und Detektor, aber auch die für die Bildrekonstruktion verwendeten Algorithmen. Die Entwicklungsschritte waren insbesondere in den Anfangsjahren der Computertomografie groß und zielten in dieser Zeit vor allem auf eine Verkürzung der Untersuchungszeit ab.
Gerätegenerationen
Die Änderungen der Art der Datenerfassung (Anordnung, Bewegung und Bauart von Röhre und Detektor) waren so fundamental, dass sie mit dem Begriff „Gerätegeneration“ beschrieben wurden. Diese Zählung endete jedoch mit der fünften Generation. Praktisch alle heute auf dem Markt angebotenen Computertomografen für die Diagnostik am Menschen sind Rotate-Rotate-Geräte, also Geräte der dritten Generation.[1]

- Translation-Rotations-Scanner – Bei diesen Geräten der ersten Generation war eine Röntgenröhre, die einen Nadelstrahl aussandte, einem einzelnen Detektor zugeordnet. Detektor und Röhre bewegten sich translatorisch im festen Abstand zueinander und tasteten die zu untersuchende Schicht so ab wie – bildhaft gesprochen – eine Bandsäge ein Stück Holz durchsägt. Das Stück Holz entspricht dem Untersuchungsobjekt (= Kopf des Patienten) und das Sägeblatt dem Röntgenstrahl. Nach jeder solchen Aufnahme, bei der 160 Messwerte erfasst wurden, drehten sich Röhre und Detektor um 1° um die Mitte des Untersuchungsobjektes und tasteten erneut eine Zeile ab. Der EMI Mark 1 nahm so in 5 Minuten 180 Projektionen auf. Der Detektor war zweizeilig, die Schichtdicke betrug 13 mm, die Auflösung 3 Linienpaare/cm. Nach einer Rechenzeit von 35 Minuten konnten 6 × 2 Bilder in einer Matrix von 80 × 80 = 6400 Bildpunkten, errechnet aus insgesamt 28.800 Daten, dargestellt werden.[1]
- Bei Geräten dieser Generation handelte es sich meist um reine Schädelscanner, also Geräte, mit denen ausschließlich Aufnahmen des Kopfes möglich waren. ACTA (automated computerized transverse axial), der erste in Washington im Jahr 1973 installierte „Körperscanner“, ermöglichte erstmals auch Aufnahmen von Brust- und Bauchraum. Er funktionierte ebenfalls nach dem Translations-Rotationsprinzip und hatte ein axiales Gesichtsfeld von 48 cm, das er während einer 6 Minuten dauernden Aufnahme abtastete.[1][10]
- Geräte der zweiten Generation, die ebenfalls schon 1972 auf den Markt kamen, tasteten das Untersuchungsobjekt auf dieselbe Weise ab, es kam jedoch ein Fächerstrahl zur Anwendung, der auf zehn Detektoren projizierte. Auch nahezu alle Geräte der zweiten Generation waren reine Schädelscanner, die lediglich Aufnahmen vom Kopf ermöglichten.
- Rotate-Rotate-Geräte – Die Röhre muss hier keine translatorische Bewegung mehr durchführen, da ein Fächer von Strahlen ausgesendet wird, welcher den gesamten Bereich durchleuchtet. Sie wird nur noch um den Patienten gedreht, ein auf der gegenüberliegenden Seite des drehenden Teils angebrachtes Kreissegment von Detektorzellen nimmt den Fächer auf. Diese Geräte der dritten Generation kamen im Jahr 1975 auf den Markt und erlaubten erstmals, binnen 20 Sekunden die Daten einer Schicht zu erfassen. Hierdurch war es möglich, den Brust- und Bauchbereich während einer Atemanhaltephase aufzunehmen und damit die bisher unvermeidbaren Atmungsverwischungen zu vermeiden.
- Rotate-Stationary-Geräte – Bei diesen Geräten rotiert nur noch die Röntgenröhre um den Patienten herum, während die Detektoren in einem vollen 360°-Kreis um den Patienten angebracht sind. Diese vierte Generation folgte im Jahre 1978, konnte sich aber nicht durchsetzen und verschwand bald wieder vom Markt. Problematisch war unter anderem, dass bei einer relativ zu den Detektoren bewegten Röntgenröhre kein fix am Detektor angebrachtes Streustrahlenraster verwendet werden kann, und somit mehr störende Streustrahlung mitgemessen wird.
- Elektronenstrahl-Scanner – Diese Geräte der fünften Generation wurden ca. bis zur Jahrtausendwende gebaut. Es bewegen sich hier keine mechanischen Komponenten mehr. Um den Patienten herum befinden sich ein 360°-Kreis mit Detektoren und ein Ring aus einem Material wie zum Beispiel Wolfram, welches als Target (Ziel) für den Elektronenstrahl einer Elektronenkanone dient. Nach dem Prinzip einer Braunschen Röhre wird dieser Elektronenstrahl, mittels elektromagnetischer Felder, jeweils zur gewünschten Position auf dem Targetring gelenkt. Wo er auftrifft, entsteht Röntgenstrahlung, die den Patienten durchleuchtet. Um die vollen 360 Grad des Ringes abdecken zu können, werden mehrere Elektronenkanonen und Ablenkanordnungen verwendet, die in regelmäßigen Abständen um das Target herum angebracht sind. Durch diese Technik konnten extrem schnell Bilder erzeugt werden, sogar Echtzeitaufnahmen vom schlagenden Herzen waren möglich, da sich während der Aufnahme keine mechanischen Teile bewegten, sondern lediglich der Elektronenstrahl um den Patienten geführt werden musste. Dies war im Millisekundenbereich möglich, während die schnellsten CTs selbst heute für eine 360°-Aufnahme noch mehrere Zehntelsekunden benötigen. Diese Geräte haben sich wohl aufgrund des hohen technischen Aufwands und damit des hohen Preises im medizinischen Alltag nicht durchgesetzt, wurden jedoch aufgrund ihrer hohen zeitlichen Auflösung von bis zu 30 ms in der Kardiologie sehr lange verwendet.[11] CT-Aufnahmen des Herzens hoher Qualität können heute mit hochzeiligen Spiral-CTs (64–640 Zeilen) in vergleichbarer bzw. besserer Qualität bei weit geringeren Kosten erstellt werden.
Schleifringtechnik
Auch bei den CTs der 3. Generation waren Röhre und Detektor anfangs über flexible Kabel mit der Gantry verbunden, weswegen nach einer erfolgten 360°-Umdrehung die Röhre zurückgedreht werden musste. Bei den schnellsten Geräten dauerte eine Umdrehung zwei Sekunden.
Um die Geschwindigkeit zu erhöhen, wurde die Leitungsverbindung durch außen am rotierenden Maschinenkörper liegende Schleifringe mit anliegenden Schleifkontakten ersetzt, die eine kontinuierliche Drehbewegung der inneren Komponenten ermöglichen. Die ersten „Dauerrotierer“ wurden im Jahr 1987 von den Firmen Siemens (Somatom Plus) und Toshiba (TCT 900S) auf den Markt gebracht.[1] Die kürzeste Zeit für eine volle 360°-Umdrehung lag bei diesen Geräten bei etwa einer Sekunde.
Spiral- oder Helix-CT

In der Anfangszeit der Computertomografie wurde ausschließlich axial gescannt. Bei diesem Aufnahmeverfahren wurde der Tisch nach jeder vollen 360°-Rotation der Röhre um den Patienten ein klein wenig verschoben. Der Verschiebeweg war so groß wie die gewählte Schichtdicke, also ca. 5–15 mm. Zum Verfahren des Tisches war mehr als genug Zeit, da sich die Röhre in Gegenrichtung zurückdrehen musste, schließlich waren Röhre und Detektorsystem über Kabel mit der Gantry verbunden. Jedoch wurde dieser Modus auch nach Einführung der „Dauerrotierer“ im Jahr 1987 zunächst beibehalten. Damit fiel lediglich das Zurückdrehen der Röhre weg. Eine Aufnahme bestand also aus einer kontinuierlichen Röhrenrotation bei schrittweisem Tischvorschub, der nach jeder vollen Röhrenumdrehung erfolgte. Ein Spiralmodus, bei dem sich sowohl Röhre wie auch Detektorsystem kontinuierlich bewegen, war zwar verschiedentlich diskutiert und publiziert worden, aber die Mehrheit der Hersteller lehnte eine derartige Aufnahmetechnik ab. Eine Verschiebung des Patienten während der Röhrenrotation galt als Quelle schwerer Bildartefakte und die Spiral-CT wurde spöttisch als „Methode zur Erzeugung von Artefakten in der CT“ bezeichnet.[1]
Dennoch führte der deutsche Physiker Willi A. Kalender im Jahr 1989 die Spiral-CT erfolgreich ein.[8] Das erste Gerät, das in diesem Modus arbeitete, war der Siemens Somatom Plus. Die gefürchteten Artefakte konnten mit dem Algorithmus der „Z-Interpolation“ beseitigt werden. Innerhalb von zwei Jahren brachten auch alle anderen großen CT-Hersteller Geräte heraus, die im Spiral-Modus arbeiten, das Verfahren war akzeptiert. Die schnelle Verbreitung war möglich, da zur damaligen Zeit Algorithmen nicht patentierbar waren, die Z-Interpolation daher von allen Herstellern übernommen werden konnte.[1] Alle heutigen Geräte arbeiten im Spiralverfahren, bei dem der Patient mit konstanter Geschwindigkeit entlang seiner Längsachse durch die Strahlenebene bewegt wird, während die Strahlenquellendetektoreinheit mit konstanter Winkelgeschwindigkeit rotiert. Je nach Gerät können mehrere Axialebenen – 2 bis maximal 320 – (Toshiba, Stand 2009) gleichzeitig eingelesen werden (Mehrschicht- oder Multislice-Verfahren / Mehrschicht- oder Mehrzeilenspiralcomputertomographie [MSCT]). Dadurch ist das Verfahren schneller und es lassen sich Bewegungsartefakte (z. B. durch die Atmung) reduzieren. Neben der hohen Geschwindigkeit ist ein weiterer Vorteil der modernen Mehrschicht-Spiral-CT die Gewinnung von Datensätzen mit isotropen Voxeln. Isotrope Voxel haben die Form von Würfeln. Dadurch ist eine multiplanare Reformation in beliebigen Bildebenen (axial, sagittal, koronal) ohne einen Verlust an (Detail-)Auflösung oder auch eine schräge (oblique) und gekrümmte (curved) sowie eine qualitativ hochwertige 3D-Rekonstruktion möglich. In Spiral-CTs werden Hochleistungs-Drehanodenröhren verwendet.
Mehrzeilen-CT
Die Firma Elscint stellte im Jahr 1992 als erster Hersteller einen Computertomografen der dritten Generation vor, der bei einem Röhrenumlauf zwei Schnitte gleichzeitig aufnahm.[12] Alle anderen Hersteller klinischer CTs zogen nach und die Schichtzahl verdoppelte sich auf 4 im Jahr 1998, wuchs über 6 und 8 Zeilen auf 16 im Jahr 2001, weiter auf 20, 32 und 40 Zeilen auf 64 im Jahr 2006 und erreichte mit 640 (320 Zeilen, doppelt ausgelesen) gleichzeitig akquirierbaren Bildzeilen beim Toshiba Aquilion ONE im Jahr 2011 bis heute ihren Gipfel.[13] Die entscheidenden Vorteile der Mehrschicht-Systeme liegen in der reduzierten Scanzeit, der Verringerung der Schichtdicke und der Erhöhung der Scanlänge.
Dual-Source-Computertomografie

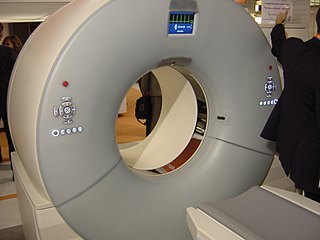
Ein Dual-Source-Computertomograph wurde 2005 von Siemens vorgestellt.[14] Im Gegensatz zum herkömmlichen Computertomographen arbeiten im Dual-Source-Computertomographen zwei rotierende, um 90 Grad versetzt angeordnete Röntgenstrahler gleichzeitig. Damit kann die Aufzeichnungszeit halbiert werden, was besonders für die Herzbildgebung nützlich ist. Die beiden Röhren können mit unterschiedlicher Spannung betrieben werden.[15]
Zwei-Spektren-CT bzw. Multi-Energy-Computertomographie
Das in der Fotografie für die Bildgebung verwendete sichtbare Licht besteht aus elektromagnetischen Wellen unterschiedlicher Wellenlänge; analog besteht das für die Computertomographie verwendete Röntgenspektrum einer Röntgenröhre ebenfalls aus elektromagnetischen Strahlen unterschiedlicher Wellenlänge. Konventionelle Computertomografen quantifizierten die Schwächung des gesamten einfallenden Röntgenspektrums; die unterschiedliche Absorptionscharakteristik eines Gewebes für unterschiedliche Wellenlängen bleibt dabei unberücksichtigt.
Die Schwächungseigenschaften von Geweben und Kontrastmittel sind von der Photonenenergie der verwendeten Röntgenstrahlung abhängig. Da im CT-Bild die Hounsfield-Werte von Kontrastmittel denen von Kalzifikationen ähneln, ist beispielsweise die Differenzierung zwischen Koronarkalk und Kontrastmittel im konventionellen CT-Bild bisweilen schwierig. Da Kontrastmittel im niederenergetischen Spektrum aber eine deutlich höhere Absorption als im höherenergetischen Spektralbereich zeigt, kann mit Hilfe der Multi-Energy-Computertomografie eine Differenzierung zwischen Kalk, bzw. Knochen und Kontrastmittel erfolgen. Knochen und Kalk können so einfach und zuverlässig aus dem Bild entfernt werden, wenn sie die Darstellung und Befundung anderer Bereiche behindern. Da sich mit der Zwei-Spektren-CT auch die Zusammensetzung des untersuchten Gewebes analysieren lässt, ist eine Charakterisierung von Nierensteinen hinsichtlich ihrer Zusammensetzung möglich. Mit dieser Technologie können auch Blutungen besser beurteilt und die Perfusion des Myokard dargestellt werden.[16]
In den 1990er Jahren bot die Firma Siemens mit dem Somatom DR ein Gerät an, mit dem zwei Aufnahmen, die mit unterschiedlichen Strahlenspektren gewonnen, überlagert und ausgewertet werden konnten.[17] Dieses, von Siemens „Zwei-Spektren-CT“ genannte Verfahren, erlaubte schon damals, präzise Knochendichtemessungen durchzuführen, sowie Bilder zu errechnen, die aussahen, als wären sie mit monochromatischer Röntgenstrahlung erstellt worden. Außerdem waren sie vollkommen frei von Artefakten, die durch Strahlaufhärtung verursacht werden. Das Verfahren setzte sich jedoch nicht durch. Es führte zu doppelter Strahlenbelastung und doppelter Untersuchungszeit, was als dem klinischen Gewinn nicht angemessen betrachtet wurde.
Geräte von Siemens,[18] General Electric[19][20][21] und Toshiba boten im Jahr 2013 die Möglichkeit der Zwei-Spektren-CT.[22]
Die Umsetzung dieser Technik variiert heute (2018) je nach Preissegment und Hersteller. Es gibt Lösungen, bei denen zwei Röntgenröhren verwendet werden, die mit unterschiedlichen Spannungen angesteuert werden, Lösungen, wo hintereinander derselbe Abschnitt mit derselben Röhre, aber unterschiedlichen Röhrenspannungen aufgenommen wird und Lösungen, bei denen die Röntgenröhre während eines Umlaufs im Millisekundenbereich schnell zwischen zwei Röhrenspannungen umschaltet. Eine dritte Variante stellt der sogenannte „Spektral-CT“ dar. In diesem Fall wird ein spezieller Yttrium-Detektor verwendet, welcher zwei Energie-Niveaus gleichzeitig auswertet. Der Vorteil hierbei liegt in der permanenten Verfügbarkeit von multienergetischen Datensätzen, sowie der geringeren Patientendosis im Vergleich zu Systemen mit 2 Röhren, da lediglich eine Strahlungsquelle verwendet wird. Des Weiteren wird damit der zeitliche Versatz bei der Aufnahme der unterschiedlichen Energieniveaus eliminiert. Derzeit ist Philips der einzige Anbieter der diese Technologie am Markt anbietet.[23]
Iterative Bildkorrektur

Vom CT aufgenommene Rohdaten werden mit Ausnahme der allerersten Geräte (EMI Mark1) durchgängig mit Hilfe der gefilterten Rückprojektion in Schnittbilder umgerechnet.[24] Da die gefilterte Rückprojektion allerdings nur in flachen 2D-Schichten theoretisch exakt funktioniert, entstehen bei Mehrschicht- und Spiral-CT Systemen Bildartefakte, die mit iterativen Korrekturverfahren abgemildert werden können.[25] Mit Hilfe solcher Verfahren kann auch das Bildrauschen derart verbessert werden, dass die für eine Untersuchung nötige Strahlendosis bei gleichbleibender Bildqualität um 30 bis 60 % gesenkt werden kann. Bei GE wird der Algorithmus ASIR (Adaptive Statistical Iterative Reconstruction) bzw. MBIR (Model based iterative Reconstruction) genannt; ASIR ist seit dem Jahr 2009 in kommerziell erhältlichen Geräten verfügbar, MBIR noch in Entwicklung; Philips nennt seinen Algorithmus iDose bzw. IMR, bei Siemens wird er IRIS (Iterative Reconstruction in Image Space) genannt und bei Toshiba AIDR (Adaptive Iterative Dose Reduction).[26] In ersten Studien konnten durch ASIR Untersuchungen mit im Mittel 2,6 mSv anstatt wie bisher 3,8 mSv durchgeführt werden. Laut Herstellerangaben ist das Potential des Verfahrens bislang (Stand 2010) noch nicht voll ausgenutzt; die Strahlenbelastung kann künftig bei gleichbleibender Bildqualität durch Einsatz von erheblich mehr Rechenleistung nochmals weiter reduziert werden.[27][20]
KI-basierte Bildrekonstruktion
Seit dem Jahr 2019 ist auch eine KI-basierte Bildrekonstruktion verfügbar.[28] Herstellerseitig wird mit einer gegenüber teiliterativen Verfahren reduzierten Strahlendosis bei verringertem Rauschen und verbesserter Detailauflösung geworben. Mit Hilfe dieses Algorithmus sei es möglich, die Bildqualität einer modellbasierten Rekonstruktion (MBIR) bei der Rekonstruktionsgeschwindigkeit eines teiliterativen Verfahrens zu erhalten.[29][30]
Mobile Geräte
Seit den 1990er Jahren wurden neben den ursprünglich fest installierten Geräten (englisch Fixed CT Scanners) mit separaten Räumen für die Rechentechnik, eigener Stromversorgung und großen mit Blei ausgekleideten Zimmern auch mobile Geräte entwickelt (englisch Mobile CT Scanners). Diese sind wesentlich kleiner und leichter, haben eingebaute Blei-Abschirmungen und werden über Akkumulatoren oder Standard-Stromversorgungen betrieben. Sie werden zum Beispiel auf Lastwagen oder Anhängern transportiert.
Im November 2008 wurde am Universitätsklinikum des Saarlandes eine Mobile Stroke Unit als weltweit erstes Rettungsfahrzeug mit integriertem CT für die prähospitale Schlaganfallbehandlung in Betrieb genommen.[31] Seit Februar 2011 wird im Stroke-Einsatz-Mobil (STEMO) der Berliner Feuerwehr im Rahmen eines Projekts der Schlaganfallforschung ein in ein Feuerwehrfahrzeug eingebautes Gerät genutzt.[32][33]
Als erstes selbstfahrendes mobiles CT-Gerät kam das SOMATOM On.site im Jahr 2021 auf den Markt. Dabei handelt es sich um einen als Kopfscanner konzipierten CT mit einem kleinen Röhrendurchmesser von 35 cm. Das On.site kann flexibel zu Patienten auf verschiedenen Stationen gefahren werden. Außerdem existiert eine in Straßenfahrzeuge eingebaute Version.[34]
Photonenzählende Detektoren

Bei allen bis zum Jahr 2021 eingesetzten Geräten trafen die Röntgenphotonen, nachdem sie den Patienten durchflogen haben, auf einen Kristall (z. B. aus Gadolinium-Oxysulfid), in dem sie in Photonen des sichtbaren Lichts umgewandelt wurden. In einer weiteren Stufe wurden sie vervielfältigt (Photomultiplier) und trafen anschließend auf eine Photodiode, welche das Licht in ein elektrisches Signal umwandelte, was dann ausgewertet wurde. Das elektrische Signal entspricht dabei einer Integration über alle Photonen (Energie-integrierender Detektor, EID), so dass Informationen zum Energiegehalt der einzelnen Photonen verloren gingen.
Bei einem quantenzählenden bzw. photonenzählenden Detektor entfällt der Umwandlungsschritt. Röntgenphotonen werden in den Halbleiterdetektoren direkt in einen elektrischen Strom umgewandelt, so dass die Information über ihren Energiegehalt erhalten bleibt. Als Detektormaterial können Cadmiumtellurid, Cadmiumzinktellurid oder Silicium benutzt werden. Korrekt implementiert bietet der Ansatz des Photon Counting CT (PCCT) den Vorteil einer mehr als doppelt so hohen räumliche Auflösung[35] sowie eine niedrigere Röntgendosis im Vergleich zu konventionellen Geräten. Auch können adipöse Patienten mit besserer Bildqualität untersucht werden. Durch einen geeigneten Schwellwert für die Energie der Photonen kann elektronisches Rauschen weitgehend herausgefiltert werden, was sich vor allem bei Untersuchungen mit niedriger Strahlendosis bemerkbar macht. Durch die Möglichkeit, die Energie der einzelnen Photonen zu kennen, ist eine Multispektral-Untersuchung ohne zusätzlichen Aufwand möglich.[36][37]
Nachteil des Verfahrens ist, dass die für diese Art der Datengewinnung notwendigen, neuartigen Detektoren aufwändig in der Herstellung sind und hohe Ansprüche an den Herstellungsprozess stellen.[38] Außerdem wird in sehr kurzer Zeit eine ganz erhebliche Datenmenge erzeugt und das System muss auf diese Datenflut ausgelegt werden. Bei einem konventionellen CT treffen pro Sekunde und Quadratmillimeter zwischen 300 und 600 Millionen Photonen auf den Detektor.[39] Selbst wenn man davon ausgeht, dass die Detektorgröße beim PCCT kleiner und der Photonenfluss geringer als bei den bisherigen, energieintegrierenden Detektoren ist, sind immer noch Daten von über 10 Millionen Photonen pro Sekunde und Detektorelement auszuwerten. Da die Systeme routinemäßig eine Multispektren-Bildgebung mit Schichtdicken im Submilimeterbereich anbieten, bedeutet dies auch bei den Bildserien potentiell drastisch vergrößerte Datensätze, die ein Gigabyte pro Untersuchung überschreiten können. Dies wiederum führt zu erhöhten Anforderungen für Hard- und Software der Befundarbeitsplätze wie auch an das Speichervolumen im PACS.
Dies waren auch die Gründe, warum dieses seit vielen Jahren bekannte Verfahren in klinischen Systemen bislang nicht zum Einsatz kam.
Siemens war im Jahr 2021 der erste Hersteller, der einen CT mit photonenzählendem Detektor anbot.[40] Ende 2021 installierte GE Healthcare in Schweden den ersten PCCT-Prototypen.[41] Die Firma Philips arbeitet ebenfalls daran, die Technologie in der Serienproduktion einsetzen zu können[42] und hat seit Ende 2022 in Lyon einen Prototyp installiert.[43] Canon möchte Anfang 2024 ein System zur klinischen Evaluation installieren.[44]
Anwendungen
Die Computertomografie wird in vielen Bereichen eingesetzt. Für die Untersuchung von Bäumen, zur zerstörungsfreien Untersuchung von archäologischen Funden[45] wie Mumien oder auch von Musikinstrumenten, zur Materialprüfung in der industriellen Computertomographie oder zur Diagnostik von Tiererkrankungen in der Veterinärmedizin.


Die größte Gerätezahl ist jedoch in der Humanmedizin anzutreffen.
Humanmedizin
Der CT gehört heute zum wichtigsten Arbeitsmittel des Radiologen, mit dem eine Vielzahl von Erkrankungen diagnostiziert werden kann. 2009 erhielten in Deutschland rund 4,88 Millionen Menschen mindestens eine Computertomografie.[46] Das Verfahren kann überall dort eingesetzt werden, wo ein Leiden bzw. Erkrankungsbild zu einer Veränderung in der Struktur des Körpers führt. Es können damit sehr sicher Knochenbrüche, Blutungen, Blutergüsse, Schwellungen (z. B. von Lymphknoten) und oft auch Entzündungen diagnostiziert werden. Da es überdies auch ein recht schnelles Bildgebungsverfahren ist, sind Computertomografen fast ausnahmslos auch in der Nähe der Notfallaufnahme eines Unfallkrankenhauses zu finden.
Weichteilorgane, Nervengewebe, Knorpel und Bänder sind gut in der CT beurteilbar. Die Darstellung dieser Gewebegruppen ist jedoch eine klare Stärke der Kernspintomographie, weshalb bei diesen Organgruppen betreffenden Fragestellungen diesem – teureren und deutlich zeitaufwändigeren, dafür aber röntgenstrahlungsfreien – Verfahren oftmals der Vorzug gegeben wird.
Tumoren und Metastasen von Krebserkrankungen können prinzipiell auch erkannt werden. Eine Schwierigkeit besteht jedoch darin, dass sich ein Tumor zwar als Raumforderung darstellt, jedoch im Bild nicht sichtbar ist, ob die Ursache dieser Raumforderung tatsächlich ein Tumor (bzw. Metastase) ist. Es ist möglich, dass ein vergrößerter Lymphknoten von Metastasen des Tumors befallen oder aber nur entzündet ist. Ebenso ist zwar ein Tumor in seiner Gestalt bisweilen gut erkennbar, aber es ist nicht erkennbar, ob nach einer stattgehabten Therapie (Chemotherapie oder Strahlentherapie) das im Bild dargestellte Tumorgewebe noch vital ist (also lebt) oder bereits aufgrund der Therapie abgestorben ist. Ebenso sind kleine Metastasen und Tumoren oftmals leicht zu übersehen bzw. können nicht hinreichend sicher von normalen Gewebestrukturen unterschieden werden. Die Kombination aus Computertomografie und Positronen-Emissions-Tomographie, die sogenannte PET/CT brachte für die Diagnostik in der Onkologie daher große Fortschritte. Die PET ergänzte, was die CT nicht liefern konnte – und umgekehrt.
Industrielle Nutzung
Außer in der Medizin wird die Computertomografie auch in materialwissenschaftlichen Themengebieten eingesetzt.[47][48] Da in diesem Fall häufig Materialien durchdrungen werden müssen, die eine stärkere Absorption als in der Medizin aufweisen, z. B. Metallgehäuse, werden in der Materialwissenschaft häufig höhere Strahlungsenergien verwendet.
Die Röntgen-CT wird in geologischen Studien verwendet, um Materialien in einem Bohrkern schnell zu identifizieren.[49] Dichte Mineralien wie Pyrit und Baryt erscheinen heller, und weniger dichte Bestandteile wie Ton erscheinen in CT-Bildern schwach durchsichtig.[50]
Flughafensicherheit
Die CT-Scanning-Technik wird auch auf Flughäfen eingesetzt, wo sie für die automatisierte Sicherheitsscannung von Gepäck und Paketen verwendet wird.[51] Dabei werden auf Computer Vision basierende Objekterkennungsalgorithmen eingesetzt, welche auf die Erkennung spezifischer Bedrohungsgegenstände anhand ihres 3D-Erscheinungsbilds abzielen, wie beispielsweise Waffen, Messer, und Flüssigkeitsbehälter. Ihr Einsatz in der Flughafensicherheit, der im März 2022 am Flughafen Shannon erstmals eingesetzt wurde, hat dort das Verbot von Flüssigkeiten über 100 ml aufgehoben. Der Flughafen London Heathrow plante die vollständige Einführung am 1. Dezember 2022. Die Transportation Security Administration (TSA) hat 781,2 Millionen Dollar für die Bestellung von über 1.000 Scannern ausgegeben, welche im Sommer 2022 in Betrieb gehen sollten.
Aufnahmemodi


Vor jeder Aufnahme wird grundsätzlich eine Übersichtsaufnahme aufgenommen. Hierbei steht die Röntgenröhre still. Der Patient wird mit Hilfe des verfahrbaren Tisches am Fächerstrahl der Röhre vorbeigefahren. Im Ergebnis erhält man ein Bild, das einer klassischen Röntgenaufnahme sehr ähnlich sieht. Dieses Bild dient jedoch nur der Planung anschließender Aufnahmen.[1]
Bis Mitte der 1990er Jahre war die rein axiale Aufnahme die einzig mögliche Aufnahmeart. Die Röhre drehte sich bei still stehendem Tisch um eine volle 360°-Drehung um den Patienten. Im Anschluss wurde der Tisch verfahren und die nächste Schicht aufgenommen. Jeder klinische CT verfügt bis heute über diesen Modus, da er ein besseres Schichtempfindlichkeitsprofil und damit eine bessere Detailerkennbarkeit bietet. Er wird allerdings mittlerweile selten eingesetzt.[1]
Bei der CT-Fluoroskopie wird auch axial gescannt; es wird an einer bestimmten Position in Zeitintervallen akquiriert. Die Aufnahmeart wird verwendet, um z. B. bei einer Punktion die Biopsienadel zu führen.[1]
Genauso wie bei der CT-Fluoroskopie wird bei der dynamischen CT wiederholt an derselben Position aufgenommen. Aus der Bildfolge kann der zeitliche Verlauf eines physiologischen Vorgangs ermittelt werden. Dies ist meist die Anflutung von CT-Kontrastmittel. Aus der Geschwindigkeit, mit der sich das Kontrastmittel im Untersuchungsbereich verteilt, kann die Durchblutung eines Organes oder Organteils bestimmt werden. Zur Visualisierung kann die Bildfolge als Kino-Sequenz dargestellt werden.
Seit Ende der 1990er Jahre kann die Anatomie des Herzens auch mit Hilfe von Mehrzeilen-CTs dargestellt werden. Bei der Computertomographie des Herzens kann sowohl der axiale als auch der Spiralmodus eingesetzt werden. Das Herz ruht zwar während ca. 70 % der Herzschlagphase, Arrhythmien und Extrasystolen können eine Aufnahme dennoch unbrauchbar machen.[1] Bei den meisten heutigen CTs (2011) muss eine vollständige Aufnahme des Herzens aus Bilddaten zusammengesetzt werden, die im Verlauf von fünf bis zehn Herzschlägen gewonnen wurden.
Die heute (2011) mit Abstand häufigste Aufnahmetechnik ist die sequenzielle Aufnahme im Spiralmodus. Sie kann mit oder ohne gleichzeitigen Einsatz von Kontrastmittel durchgeführt werden.[1]
Ablauf einer typischen CT-Untersuchung
Für eine CT-Untersuchung wird in der Regel wenig Zeit benötigt, da die Technik heute sehr ausgereift und schnell ist. Eine Routineuntersuchung kann in 3 bis 10 Minuten bequem durchgeführt werden.
Patientenvorbereitung, Kontrastmittel und Laborwerte
Der Großteil aller Untersuchungen wird mit Hilfe eines jodhaltigen Kontrastmittels durchgeführt, das intravenös injiziert wird. Da Kontrastmittel Röntgenstrahlung stärker als Wasser schwächt, lässt es – da es sich im Blut befindet – Blutgefäße und gut durchblutete Areale heller erscheinen, die sich damit von nicht bzw. wenig durchbluteten Arealen abheben. In seltenen Fällen kann es jedoch zu Komplikationen führen.
Vor einer geplanten CT-Untersuchung werden daher vom Radiologen meist zwei Werte der Laboruntersuchung des Blutes verlangt. Es sind dies der Kreatinin- und der Thyreotropin-Wert oder kurz der „Krea- und TSH-Wert“.
Im Falle eines bestehenden Jodmangels versucht die Hypophyse, den dadurch verursachten Thyroxin-Mangel (Jod ist für die Thyroxin-Bildung essenziell) durch eine verstärkte Ausschüttung von TSH zu kompensieren. Die Gabe des jodhaltigen Kontrastmittels würde in einer solchen Situation zu einer schlagartig ansteigenden Thyroxinproduktion führen und eine plötzliche Hyperthyreose, im schlimmsten Fall eine thyreotoxische Krise auslösen. Ein erniedrigter TSH-Wert deutet auf Hyperthyreose hin und muss daher vor der Kontrastmittelgabe weiter untersucht werden, um eine Komplikation zu vermeiden.
Durch das Kontrastmittel kann auch eine pseudoallergische Reaktion hervorgerufen werden, die lebensbedrohlich werden kann. Ist eine Kontrastmittelallergie bekannt, kann in Notfallsituationen mittels Medikamenten versucht werden, eine KM-Reaktion zu verhindern. Ansonsten sollte auf eine Kontrastmittelgabe verzichtet werden. Ggf. muss in einem solchen Fall auf alternative Verfahren ausgewichen werden. Dazu bieten sich oft die Sonografie oder eine Magnetresonanztomografie an.
Da eine Kontrastmittelreaktion oft Übelkeit und Erbrechen zur Folge hat, wird empfohlen, die Untersuchung nüchtern durchzuführen, sodass der Magen leer ist und Erbrochenes nicht in die Atemwege gelangen kann.
Das CT-Kontrastmittel wird über die Nieren ausgeschieden und stellt eine Belastung für diese Organe dar. Bei einem gesunden Menschen ist dies kein Problem, vorgeschädigte Nieren könnten jedoch mit der zusätzlichen Last überfordert sein. Über den Kreatininwert wird geprüft, ob eine gegebenenfalls gefährliche Nierenvorschädigung vorliegt.
Das Kontrastmittel wird über eine Hochdruckpumpe injiziert. Dazu wird vor der Untersuchung ein peripherer Venenkatheter gelegt, über den es eingebracht wird. Eine typische Einstellung wäre z. B. 50 ml Kontrastmittel, das mit einer Flussrate von 3 ml/Sekunde verabreicht wird. Im Jargon wird Kontrastmittel auch mit „KM“ und die intravenöse Einbringungsart mit „iv“ abgekürzt; das Fachpersonal spricht bei Verwendung von intravenös verabreichtem Kontrastmittel dann kurz vom „iv-KM“, die Aufnahme wird KM-Aufnahme bezeichnet. Eine Aufnahme ohne Verwendung von Kontrastmittel wird als „Nativ-Aufnahme“ bezeichnet.
Zusätzlich zu dem beschriebenen intravenösen Kontrastmittel wird bei Untersuchungen des Bauchraums häufig auch Kontrastmittel zum Trinken verwendet. Dieses verbleibt im Wesentlichen im Inneren des Magen-Darm-Traktes und dient so der besseren Darstellung desselben. Die Iod- oder Bariumsulfat-haltige Substanz wird in Wasser gelöst und vor der Untersuchung vom Patienten getrunken. Meist sind Geschmacksstoffe zugesetzt, sodass es beispielsweise nach Anis schmeckt. Typischerweise wird ein Liter Kontrastmittel zu trinken gegeben. Bei Fragestellungen, die den letzten Teil des Darmes betreffen, kann zusätzlich auch noch ein Einlauf mit Kontrastmittel erforderlich sein.
Der Patient sollte sich vor der Untersuchung in dem zu untersuchenden Körperbereich (z. B. Brustkorb) weitgehend entkleiden. Dies ist zwar nicht zwingend nötig, weil die Röntgenstrahlung Kleidungsstücke durchdringt. Metallgegenstände in der Kleidung können im Strahlenfeld Artefakte verursachen und sollten daher vor der Untersuchung entfernt werden.
Patientenlagerung und Referenzpunkt
Der Patient legt sich auf den höhenverstellbaren Untersuchungstisch, der zum bequemen Platzieren nach unten gefahren werden kann. Bei Untersuchungen des Kopfes wird der Kopf des Patienten fixiert, um einer Bildunschärfe durch unwillkürliche Kopfbewegungen zuvorzukommen. Die Arme des Patienten liegen bequem am Körper an.
Um den zu untersuchenden Bereich planen zu können, ist die Definition eines Nullpunktes nötig, auf den sich alle Koordinatenangaben beziehen. Zu diesem Zweck fährt das Bedienpersonal den Patiententisch hoch in die Untersuchungsebene und in die Gantry hinein. Für eine genauere Planung des Referenzpunktes verfügt ein CT über Positionier-Laser, so dass genau erkennbar ist, wo sich der gewählte Referenzpunkt auf den Körper des Patienten projiziert. Ein beliebter Referenzpunkt ist z. B. die deutsche Horizontale. Damit der Patient beim Setzen dieses Referenzpunktes nicht versehentlich vom Laser geblendet wird, lässt man ihn für eine kurze Zeit die Augen schließen. Der Ort des Referenzpunktes ist prinzipiell frei wählbar und bezieht sich sinnvollerweise auf die zu untersuchende Region. Soll das Sprunggelenk untersucht werden, ist es folglich zweckmäßig, den Referenzpunkt in der Nähe des Sprunggelenkes zu setzen. Ist der Ort bestimmt, wird mit einem Druck auf eine entsprechende Taste am Gerät das Koordinatensystem des Gerätes auf diesen Punkt „genullt“. Alle Angaben sowohl im Untersuchungsprotokoll wie im späteren Bild beziehen sich auf diesen Nullpunkt.
Die Planung des Untersuchungsbereichs
In der Regel sind am Gerät für jede mögliche Untersuchung vorkonfigurierte, sogenannte „Untersuchungsprotokolle“ hinterlegt, die der Anwender in Abhängigkeit von der medizinischen Fragestellung wählt. Es ist im Protokoll unter anderem festgelegt, wo der Referenzpunkt für die Untersuchung zu setzen ist. Die erste Aufnahme jeder Untersuchung ist die Übersichtsaufnahme. In diese Übersichtsaufnahme zeichnet die MTRA mit Hilfe von verschiebbaren Bildkursoren den abzubildenden Bereich ein. Alternativ können Positionsangaben auch manuell numerisch eingegeben werden, wobei die in der Medizin üblichen Lage- und Richtungsbezeichnungen zur Anwendung kommen. Für eine Aufnahme der Lunge mit Referenzpunkt im Brustbein wird dann z. B. eine Übersichtsaufnahme angefertigt, die von superior 300 bis inferior 200 reicht, was bedeutet, dass sie von 300 mm „kopfwärts“ vom Nullpunkt bis 200 mm „fußwärts“ vom Referenzpunkt reicht. Die folgende Schnittbildaufnahme wird sich innerhalb dieses Bereiches befinden.
Die Aufnahme(n)
Ablauf und Dauer der CT-Aufnahme(n) hängt stark von der Untersuchungsregion und der Fragestellung ab. Soll beispielsweise eine Arm- oder Beinfraktur diagnostiziert werden, wird meist nur eine einzelne Bildserie aufgenommen.
Für die Darstellung des Knochens oder eines Nierensteins ist kein Kontrastmittel nötig. Wenn die Beurteilbarkeit des Weichteilgewebes nicht gewünscht wird, wird daher auch kein Kontrastmittel injiziert. Im Gegensatz dazu wird für Fragestellungen, die den Brust- und/oder Bauchraum betreffen, fast immer Kontrastmittel verwendet (so eine KM-Allergie oder Niereninsuffizienz dies nicht verbieten). Je nach Fragestellung wird eine Region ein- oder mehrfach gescannt. Folgende Aufnahmetypen werden typischerweise benutzt:
- Nativ-Aufnahme ohne Kontrastmittelgabe
- Arterielle Aufnahme, die die gefüllten Arterien zeigt, nicht jedoch die Venen; für die Beurteilung des Gewebes ist sie wenig geeignet und wird ca. 20 bis 30 Sekunden nach Kontrastmittelgabe gestartet.
- Venöse Aufnahme, die Venen sowie Gewebe in gutem Kontrast zeigt und ca. 60 bis 70 Sekunden nach Kontrastmittelgabe erfolgt.
- Bisweilen auch: Spätaufnahmen (LVCT = late venous CT), die 90 Sekunden bis wenige Minuten nach Kontrastmittelgabe erfolgen.
Da eine CT-Aufnahme von Brust und/oder Bauchraum selbst bei den schnellsten Geräten mehrere Sekunden in Anspruch nimmt, wird der Patient gebeten, während der Aufnahme die Luft anzuhalten. Andernfalls können Bildstörungen die Folge sein, vergleichbar mit dem „Verwackeln“ in der Fotografie. Gespeicherte Sprachkommandos werden heute vom Gerät vollautomatisch ausgegeben, das Bedienpersonal spricht sie meist nicht selbst (kann dies im Einzelfall jedoch trotzdem tun). Zusätzlich gibt es an manchen Geräten eine numerische Anzeige, die den Patienten über die verbleibende Atemanhaltezeit informiert. Werden über dieselbe Region mehrere Aufnahmen gefahren, wird der Patient mehrmals darum gebeten, die Luft anzuhalten. Ein Beispiel für solch eine Aufnahmesequenz ist die Metastasensuche in der Leber.
Aufnahmen der Lunge werden in Einatemlage durchgeführt, um sicherzustellen, dass sich das Lungengewebe voll entfaltet hat. Folglich wird der Patient darum gebeten, einzuatmen und dann die Luft anzuhalten. Da es für den Patienten bequemer ist, erst auszuatmen und dann die Luft anzuhalten und die Atemlage für Aufnahmen des Bauchraums keine Rolle spielt, wird bei diesen Sequenzen darum gebeten, die Luft anzuhalten, nachdem ausgeatmet wurde.
Das CT-Bild
In den ersten Jahren wiesen CT-Bilder in der transversalen Bildebene eine erheblich höhere Auflösung auf als in der sagittalen bzw. koronalen. Transversalschnitte waren daher damals die einzig sinnvolle Form der Bilddarstellung;[1] Radiologien befunden bis heute bevorzugt Transversalschnitte. Zur Orientierung: Der Betrachter blickt (vom Patienten aus gesehen) von unten auf einen Transversalschnitt, weshalb das, was aus Patientensicht links ist, sich im Bild rechts befindet.
Hounsfield-Skala und Fensterung
Im CT-Bild wird die Schwächung des Gewebes für das von der Röhre emittierte Röntgenspektrum in Form von Grauwerten dargestellt. Die Schwächungswerte werden in sogenannte CT-Zahlen umgerechnet und auf der Hounsfield-Skala ausgegeben. Luft hat definitionsgemäß die CT-Zahl −1000 und Wasser den Wert 0. Der Grund für die Umrechnung ist, dass die spektrale Zusammensetzung der verwendeten Röntgenstrahlung in Abhängigkeit von Aufnahmeparametern wie Röhrenspannung und Vorfilterung variiert. Würden im CT-Bild die Schwächungswerte direkt dargestellt, würde das Bild jeweils unterschiedlich ausfallen. Eine Vergleichbarkeit von Bildern, wie sie für die Befundung in der Medizin unabdingbar ist, wäre so nicht möglich. Durch Normierung der gemessenen Schwächung auf die Schwächungswerte von Wasser und Luft wird dieses Problem umgangen.
Für die bildliche Darstellung wird jeder CT-Zahl ein Grauwert zugeordnet. Da das menschliche Auge jedoch nicht in der Lage ist, die 4000 vom Gerät differenzierbaren Grauwerte aufzulösen, wird mit Hilfe der Fensterung ein für die jeweilige Fragestellung optimierter Dynamikbereich des Bildes eingeblendet.
In der medizinischen Fachsprache wird ein Gewebe, das einen niedrigeren Absorptionsgrad aufweist als erwartet, als hypodens (Hypodensität) bezeichnet; bei höherem Schwächungskoeffizienten als hyperdens (Hyperdensität). Zwei Bildpunkte, die Gewebe mit gleichem Absorptionsgrad repräsentieren, sind einander isodens.
Multiplanare Reformation und 3D-Darstellungen

Erst mit der Einführung von Mehrzeilen-Spiral-CTs Mitte der 1990er Jahre gab es in der Computertomographie isotrope Voxel.[1] Da alle heutigen (2011) klinischen CTs kleine isotrope Voxel erzeugen können, ist eine hohe räumliche Auflösung in beliebigen Raumrichtungen möglich. Durch die multiplanare Reformation werden auch sagittale und koronale Darstellungen in hoher Qualität möglich, die für den Nicht-Radiologen erheblich einfacher zu verstehen sind. Die Maximum Intensitäts Projektion stellt die Maximalwerte aus einem frei wählbaren Datenvolumen dar, die auf eine Ebene projiziert werden, vergleichbar einem Schattenbild. Durch die heute auf Auswerte- bzw. PACS-Workstations preiswert verfügbare Rechenleistung können aus den Daten auch hochwertige 3D-Darstellungen in Form von MIP, Surface-Rendering oder – am aufwändigsten und beeindruckendsten – Raycasting erzeugt werden.
Für den Radiologen in der klinischen Routine ist die MIP zur Gefäßdarstellung und der Suche nach Lungenmetastasen sehr hilfreich. Eine 3D-Darstellung ist zur präoperativen Darstellung von Mehrfragment-Frakturen für den Chirurgen nützlich. Raytracing und MIP werden ferner im Rahmen von Spezialanwendungen für Visualisierungen in der Computertomographie des Herzens und der virtuellen Koloskopie verwendet.
Sliding thin slab
Die kleinstmögliche Schichtdicke heutiger CTs liegt im Bereich von etwa 0,3 mm. Dünne Schichten erlauben zwar die Darstellung kleinster Bilddetails, sind jedoch der Grund für die – trotz allem technischen Fortschritt – immer noch hohe Strahlenbelastung durch computertomographische Untersuchungen, denn die Höhe des Bildrauschens wird wesentlich von der gewählten Schichtdicke bestimmt. Der Radiologe benötigt für die Befundung nur in seltenen Fällen Schichtdicken von 1 mm und darunter. Auf der anderen Seite können Bilder einer (rauscharmen) dickschichtig rekonstruierten Untersuchung nur in begrenztem Umfang und nur bei Vorliegen der Rohdaten im Nachhinein in dünne Schichten umgerechnet werden. Je größer die Schichtdicke in einem CT-Bild ist, desto rauscharmer ist es, desto größer ist aber auch die Wahrscheinlichkeit, dass sich im Bild Artefakte durch den Partialvolumeneffekt zeigen. Dieses Dilemma kann durch die sliding thin slabs Darstellung (abgekürzt sts) umgangen werden. Die Bilder werden hierbei dünnschichtig (z. B. mit 1 mm Dicke und weniger) rekonstruiert, jedoch dickschichtig (z. B. 5 mm) dargestellt. Beispiel: Bei einer angenommenen 1-mm-Rekonstruktion mit 5-mm-Darstellung werden 5 Schichten addiert. Blättert der Radiologe im Bild, wird der nächste 1-mm-Schnitt in die Darstellung hinzugenommen und der letzte 1-mm-Schnitt entfernt. Es wird wieder ein Bild mit 5 mm effektiver Dicke dargestellt. Das betrachtete Bild ist rauscharm wie ein Bild, das in 5 mm Dicke aufgenommen worden wäre, jedoch kann mit einem Inkrement von 1 mm geblättert werden. Außerdem kann die Schichtdicke jederzeit auf bis zu 1 mm verringert oder über 5 mm hinaus erhöht werden. Die Mittelung in der sts-Darstellung kann in manchen Nachverarbeitungsworkstations in Form einer Mittelung (klassische STS), als MIP, als Min-IP oder als VR (Volume Rendering = Raycasting) erfolgen. Ebenso ist bisweilen möglich, die Ansichten multiplanar reformatierter Bilder in sts-Darstellungen umzurechnen.[1]
- Craniale Computertomographie Abgebildet sind Felsenbein und Nasennebenhöhlen. Aufgrund der hohen Auflösung der Aufnahme des verwendeten 64-Zeilen-CTs sind selbst die Gehörknöchelchen erkennbar.
- Koronal reformatierte Darstellung von Abdomen und Becken; gut zu erkennen sind u. a. die Leber und die beiden Nieren.
- Kombination aus multiplanarer Reformatierung und sliding thin slab. Der Bildkursor befindet sich in der Harnblase. Die Originalschichtdicke beträgt 1,25 mm, dargestellt wird in allen Ansichten gemittelt (= average) in 3,7 mm bzw. 3,8 mm Dicke.
- Kombination aus multiplanarer Reformatierung und sliding thin slab. Der Bildkursor befindet sich im rechten Lungenflügel. Die sts-Bildstapel werden in Form von MIP-Darstellungen gezeigt (STS-MIP).[52] Links oben befindet sich eine VR-Darstellung der Lunge; sie zeigt einen Blick auf die koronal an Kursorposition geschnittene Lunge.
- CT-Angiographie; mittels multiplanarer Reformation (hier die sog. curved MPR) sind auch Schnittdarstellungen entlang beliebiger Gefäßverläufe möglich, wodurch die gezeigte Arteriosklerose sehr gut visualisiert werden kann.
Strahlenexposition
Ein Nachteil der Computertomografie ist die Strahlenexposition. Vergleicht man eine CT-Aufnahme beispielsweise mit der natürlichen Strahlenbelastung, so führt eine typische Abdomenaufnahme zu einer Exposition, die 2,8 Jahren natürlicher Hintergrundstrahlung entspricht.[1] Obgleich dies ca. 500-mal höher ist als bei einer Thorax-Röntgenaufnahme,[53] ist es auch in diesem Dosisbereich statistisch nicht möglich, eine später auftretende Erkrankung mit hinreichender Sicherheit auf die vorangegangene Strahlenexposition zurückzuführen. Bis heute wird daher aus der Häufigkeit von Erkrankungen, die aus einer sehr viel höheren Strahlenbelastung resultierten, linear auf die zu erwartenden Fälle bei niedriger Strahlenbelastung extrapoliert,[54] obgleich für dieses angenommene Risiko keine belastbare Statistik vorliegt.[1] Denkbar – jedoch bis heute statistisch nicht belegbar – wären auch Hormesis-Effekte (also positive Effekte) bei geringen Strahlendosen. Es existiert eine Reihe von Studien, die in diese Richtung deuten.[55] Daneben ist aber auch ein mitohormesischer Effekt möglich, wonach besonders geringe Dosen eher eine schädliche Wirkung entfalten.
Solange es jedoch keine stichhaltigen Belege gibt, dass es bei geringen Strahlenbelastungen kein oder ein erheblich niedrigeres Risiko gibt, als es bei hohen Strahlendosen zweifelsfrei existiert, muss dieses angenommene Risiko bei der Indikationsstellung berücksichtigt werden. Die hohe Aussagekraft der CT kann die Durchführung rechtfertigen. Ärzte unterschätzen laut Heyer die Strahlenbelastung bei der Computertomografie:[56] Diese machte im Jahr 2003 gut 6 % aller Röntgenuntersuchungen aus, war aber für mehr als 50 % der medizinischen Röntgenstrahlung verantwortlich.[57] Jährlich werden in den USA mehr als 62 Mio. CT-Scans durchgeführt. Jede dritte dieser Untersuchungen ist nach Experteneinschätzungen nicht notwendig.[58] Eine Übersichtsarbeit im New England Journal of Medicine warnt, dass die jetzt durchgeführten CTs in einigen Jahrzehnten für 1,5–2 % aller Krebserkrankungen verantwortlich sein könnten. Die Autoren der Übersichtsarbeit stellten aber auch klar, dass in den etablierten Indikationen der Nutzen das Risiko überwiege.[59] Eine 2009 veröffentlichte Studie macht 70 Millionen CT-Scans in den USA für 29.000 Krebsfälle verantwortlich und berechnet die jährlichen CT-Todesfälle in den USA mit 14.500.[60] Nach einer neuen Studie haben Kinder, die mehrere CT-Untersuchungen des Kopfes erhalten haben, später ein leicht erhöhtes Krebsrisiko.[61] Bei Mädchen würde jede 300. bis 390. CT-Aufnahme von Abdomen und Becken zu einer zusätzlichen Krebserkrankung führen, bei Wirbelsäulenscans käme es je nach Alter bei jeder 270. bis 800. Aufnahme zu einer zusätzlichen Krebserkrankung; Kopf-CTs würden vor allem das Leukämierisiko steigern.[62] Eine andere Studie zeigte, dass Kinder, bei denen eine CT-Untersuchung durchgeführt wurde, ein um 24 Prozent erhöhtes Risiko haben, später an Krebs zu erkranken; jede weitere CT-Aufnahme hätte das Risiko um 16 Prozent gesteigert.[63]
Die Strahlenexposition durch eine CT-Aufnahme wird durch die Größen CTDI und DLP quantitativ beschrieben. Multipliziert man das CTDI mit der Länge des bestrahlten Bereiches, erhält man das DLP. Bei Kenntnis der bestrahlten Region kann man hieraus die Organdosen der betroffenen Organe und daraus wiederum die Effektive Dosis errechnen. Die folgende Tabelle zeigt die effektiven Dosen typischer Untersuchungen bezogen auf 75-kg-Standardpatienten. Die tatsächlich aufgewendete Dosis einer CT-Untersuchung kann aber schon wegen der starken Abhängigkeit von der Körpermasse (Dicke der zu durchstrahlenden Schicht) besonders am Rumpf (Thorax/Abdomen) im Einzelfall um ein Vielfaches höher ausfallen.
| Untersuchung | Effektive Dosis (mSv) | Energiedosis (mGy) |
|---|---|---|
| Natürliche Strahlenbelastung pro Jahr | 2,1[64] | 2,4[65] |
| Kopf-CT | 1,5[66] – 2,3[67] | 56[66] |
| Abdomen-CT | 5,3[66] – 10[67] | 14[66] |
| Thorax-CT | 5,8[66] – 8[67] | 13[66] |
| Thorax-, Abdomen- und Becken-CT | 9,9[66] | 12[66] |
| Screening Mammografie | 0,2–0,6[64] | 3[66] |
| Röntgenaufnahme des Thorax | 0,02[67] – 0,1 |
Die zugrundeliegende Einheit Sievert berücksichtigt nicht Unterschiede im Intensitätsverlauf und der spektralen Zusammensetzung zwischen künstlich erzeugter und natürlicher Röntgenstrahlung.
Einflussparameter auf die Strahlenbelastung
Einer der wichtigsten Güteparameter für die Bildqualität eines CT ist das Bildrauschen, das zum größten Teil von Quantenrauschen im Detektor verursacht wird. Eine Verbesserung der Bildqualität ist mit Änderungen von Aufnahmeparametern verbunden, die meist zu einer Erhöhung der Strahlenbelastung des Patienten führen. Die Untersuchungsparameter sollen aus Strahlenschutzgründen so gewählt werden, dass der Rauschanteil im Bild ausreichend niedrig ist, dass eine sichere Befundung noch möglich ist. Es wird folglich auch hier gemäß dem ALARA-Prinzip nicht ein möglichst gutes, sondern nur ein hinreichend gutes Bild angestrebt.
Der Zusammenhang zwischen dem Bildrauschen , dem gewählten Rekonstruktionsalgorithmus , der Schwächung , der Systemeffizienz , dem Milliampere-Sekundenprodukt und der Schichtdicke ist:[1]
Aus dieser Gleichung ergibt sich unter anderem, dass sich bei Vervierfachung der Schwächung das Bildrauschen verdoppelt. Der gewählte Rekonstruktionsalgorithmus kann die für eine bestimmte Bildqualität nötige Strahlendosis um 30–40 Prozent verändern.[68]
Vorfilterung der Röntgenstrahlung
Das Emissionsspektrum jeder Röntgenröhre enthält niederenergetische Strahlenanteile, die vollständig vom Untersuchungsobjekt absorbiert werden und damit nicht zur Bildgebung beitragen. Zur Verringerung der Strahlenbelastung wird daher ein Röntgenfilter aus mehrere Millimeter dickem Blech (z. B. aus Aluminium, Kupfer oder Beryllium) eingebaut; eine Mindest-Vorfilterung ist seit Jahren sogar gesetzlich vorgeschrieben. Das Blech absorbiert die niederenergetischen Anteile des Röntgenspektrums vollständig, verringert jedoch auch die Intensität der für die Bildgebung benutzten Spektralanteile.
Die Dosisleistung einer Röhre kann folglich nur dann mit den Angaben von Röhrenspannung und Röhrenstrom beschrieben werden, wenn neben dem Fokus-Objektabstand auch die Vorfilterung bekannt ist und in die Berechnung mit einbezogen wird.
Röhrenspannung
Eine Erhöhung der Röhrenspannung erhöht bei gleichem Röhrenstrom die Strahlenbelastung für den Patienten. In der klassischen Radiografie verringert dies auch den Bildkontrast, in der CT werden dagegen nur die Hounsfieldwerte dichter Knochenstrukturen etwas verringert, da der Bildkontrast rein durch die Wahl des Hounsfieldfensters bestimmt wird.
Photonen höherer Energie werden durch das Gewebe zwar geringer geschwächt als niederenergetische Photonen, jedoch steigt die insgesamt im Gewebe deponierte Energie stark an. Bei einer Röhren-Vorfilterung durch 2 mm Kupfer beträgt die Äquivalentdosisleistungskonstante bei 100.000 Volt = 100 kV Röhrenspannung 0,35 mSv·m²/mA·min – bei 140 kV Röhrenspannung jedoch schon ca. 1,4 mSv·m²/mA·min.[69] Daraus folgt, dass eine Röntgenröhre bei 140 kV eine 4-fach höhere Dosisleistung liefert als bei 100 kV, wenn man den Röhrenstrom unverändert belässt.
Aus Strahlenschutzgründen wäre es folglich wünschenswert, mit niedrigen Röhrenspannungen um ca. 60–80 kV zu arbeiten, was jedoch nur selten möglich ist. Für die Bildgebung in der Computertomografie ist eine hohe Intensität (= Dosisleistung) der Röntgenstrahlung erforderlich. Die erforderliche Dosisleistung liegt bei Verwendung der leistungsfähigsten Drehanoden-Röhren leider auch heute noch im Allgemeinen höher, als mit dem höchsten einstellbaren Röhrenstrom bei einer Anodenspannung von beispielsweise 80 kV erzielt werden kann. Um ein ausreichend niedriges Bildrauschen zu gewährleisten, bleibt daher meist nichts anderes übrig, als die Röhrenspannung über den aus Strahlenschutzgründen optimalen Wert zu heben, denn der Wirkungsgrad einer Röntgenröhre steigt mit dem Quadrat der Röhrenspannung. Üblich sind Werte von ca. 120 kV, bei korpulenten Patienten auch 140 kV.
Artefakte durch Strahlaufhärtung treten umso stärker in Erscheinung, je niedriger die Röhrenspannung ist. Dies ist ein weiterer Grund, warum meist mit mehr als 100 kV Röhrenspannung gearbeitet wird.
Röhrenstrom
Der Röhrenstrom verhält sich linear zur Dosis, d. h. eine Verdopplung des Röhrenstroms verdoppelt die Strahlenbelastung.
Rotationszeit
Ebenso verhält es sich mit der Rotationsdauer. Die beiden Parameter werden daher meist zusammengefasst. Angegeben wird das Produkt aus Rotationsdauer und Röhrenstrom in Milliampere-Sekunden, in der Gleichung oben abgekürzt mit Q und der Einheit mAs. Bei Halbierung der Rotationsdauer der Röhre muss folglich der Röhrenstrom verdoppelt werden, soll das Bildrauschen konstant bleiben.
Zusammenhang von Bildrauschen und Schichtdicke
Aus obiger Gleichung folgt ebenso, dass bei Halbierung der Schichtdicke (bei gleicher Rotationsdauer) der Röhrenstrom verdoppelt werden muss, soll das Bildrauschen konstant bleiben. Umgekehrt kann der Röhrenstrom halbiert werden, wenn die Schichtdicke verdoppelt wird. Um das Bildrauschen zu halbieren, muss der Röhrenstrom vervierfacht werden. Alternativ kann die Schichtdicke vervierfacht oder beides verdoppelt werden.
Pitch, Rekonstruktionsfilter und Kontrastierung
Die Strahlenbelastung wird auch wesentlich vom gewählten Pitchfaktor bestimmt. Der Zusammenhang ist linear: Wird der Pitchfaktor bei sonst gleichen Parametern verdoppelt, halbiert sich die Strahlenbelastung.
Im Parameter fA ist neben dem Pitchfaktor auch der Einfluss des für die Bildrekonstruktion verwendeten Faltungskerns der gefilterten Rückprojektion enthalten: Dieser kann glättend oder kontrastanhebend wirken. Neben dem Kontrast wird allerdings auch das Bildrauschen verstärkt. kann je nach Faltungskern bis zu einem Faktor 5 differieren. Die Faltungskerne werden je nach Hersteller etwas unterschiedlich benannt. Glättende Kerne heißen smooth oder soft, der Standardkern meist standard, kontrastverstärkend sind bone, edge, lung, high oder ultrahigh. Durch Wahl eines geeigneten Faltungskerns kann das Bild für das zu befundende Gewebe mit optimaler Qualität berechnet und damit unnötige Strahlendosis vermieden werden. Ein häufiger Kontrastverstärkungsmodus wird als HR-CT (High Resolution CT) bezeichnet.
Möglichkeiten zur Verringerung der Strahlenexposition
Die Strahlenbelastung des Patienten kann durch eine Reihe von Maßnahmen gesenkt werden. Eine aus Strahlenschutzgründen wünschenswerte Dosisersparnis bedeutet auch eine Verringerung der Röhrenbelastung, was letztlich die Lebensdauer der Röhre erhöht. Da CT-Röhren höhere 5-stellige Beträge kosten, ist hiermit ein weiterer Anreiz zur Dosissenkung geschaffen – zumindest für den niedergelassenen Radiologen, der die Kosten für einen Röhrentausch selbst zu tragen hat.
Untersuchungsbereich und medizinisches Aufnahmeprotokoll
Allen voran ist der Radiologe in der Pflicht, der die Zahl der CT-Untersuchungen auf die tatsächlich klar indizierten Fälle begrenzen muss. Jede zusätzliche Aufnahme bedeutet eine zusätzliche Strahlenbelastung und allzu oft werden mehrere Aufnahmen (nativ, arterielle Kontrastmittel-Phase, venöse Kontrastmittel-Phase, Spätphase) über dieselbe Untersuchungsregion gefahren. Auch mit der Begrenzung des Scan-Bereiches auf die relevante Untersuchungsregion kann einfach und effizient die Dosis reduziert werden.
Technisches Aufnahmeprotokoll
Die MTRA hat mit der Wahl des korrekten Untersuchungsprotokolls mit auf die Fragestellung optimierter Schichtdicke, Pitchfaktor, Faltungskern und Bildrauschen eine weitere, sehr mächtige Möglichkeit zur Dosisersparnis. Bei schlanken Patienten und Kindern kann und soll in aus Strahlenschutzgründen optimalen Röhrenspannungsbereichen von 60 bis 100 kV gearbeitet werden.
Dosismodulation
CTs aller großen Hersteller verfügen heute über eine Dosismodulation. Der Röhrenstrom wird dabei der vorliegenden Schwächung angepasst, sowohl in x-y- als auch in z-Richtung. Dies bedeutet, dass bei Aufnahmen der Lunge, die Leistung im Vergleich zum Abdomen zurückgenommen wird. Aber auch bei der Rotation wird der Röhrenstrom moduliert. Da der menschliche Körper einen näherungsweise ovalen Querschnitt hat, wird die Röhrenlast diesem Umstand angepasst. Die Leistung wird zurückgenommen, wenn von vorne bzw. von hinten (aus Sicht des Patienten) gestrahlt wird und hochgeregelt, wenn von der Seite gestrahlt wird. Meist ist diese Dosisregelung mit einer zweiten Automatik kombiniert, die den Röhrenstrom auch in Abhängigkeit vom Body-Mass-Index des Patienten regelt. Die Hersteller benutzen unterschiedliche Namen für diese Funktionen, z. B. Auto-mA, Smart-mA, Caredose 4D, Doseright oder Sure-Exposure.[70]
Schichtdicke
Werden mehrere Schichten summiert dargestellt, verringert dies zwar die Auflösung im Bild, jedoch auch das Bildrauschen. Verzichtet der Arzt auf eine hohe Auflösung, weil er den Befund auch in einer Darstellung mit beispielsweise fünf Millimeter Schichtdicke hinreichend gut erkennen kann, kann durch Wahl eines darauf abgestimmten Aufnahmeprotokolls signifikant Dosis eingespart werden. Die Verwendung der Darstellung Sliding thin slab kann damit schließlich auch zur Dosissenkung beitragen.
Alternativen
Im Jahre 1977 wurden die ersten Studien zur Magnetresonanztomographie, abgekürzt MRT, am Menschen publiziert.[71]
Dieses auch als Kernspintomographie bezeichnete Verfahren bietet zwei große Vorteile:
- Es wird keine potenziell krebserregende Röntgenstrahlung verwendet.
- Organe und Gewebe können auch ohne Verwendung von Kontrastmittel mit hohem Weichteilkontrast abgebildet werden, was insbesondere bei Patienten mit eingeschränkter Nierenfunktion ein gewichtiges Argument darstellt. Der Weichteilkontrast ist sogar deutlich besser als bei den modernsten Computertomographen.
Nachteilig waren lange Zeit die schlechtere Verfügbarkeit bedingt durch den höheren Anschaffungspreis der MRT-Geräte. Das starke Magnetfeld, die räumliche Enge im Gerät und die im Vergleich zur CT auch heute noch lange Untersuchungszeit bringen weitere Einschränkungen mit sich: So können zum Beispiel intensivmedizinisch überwachungspflichtige Patienten, Patienten mit Klaustrophobie oder Patienten, die z. B. schmerzbedingt nicht für eine längere Zeit ruhig liegen können, nur eingeschränkt im MRT untersucht werden. Die erheblich längere Untersuchungszeit ist auch im Hinblick auf Unschärfe durch physiologische Patientenbewegung (Herz, Lunge, Darm) bis heute ein relevanter Nachteil. Außerdem ist die MRT zwar in der Lage, Weichteile mit exzellentem Weichteilkontrast darzustellen, aber prinzipbedingt bei der Darstellung von Knochen und Zähnen im Nachteil. Die MRT stellt damit oftmals keine Alternative, sondern ein komplementäres Verfahren dar.
Im zahnärztlichen Bereich ist eine alternative Bildgebung die Digitale Volumentomographie (= DVT).[3] Für Angiographie-Anlagen und C-Bögen sind bisweilen Softwareoptionen verfügbar, die in Form der Rotationsangiographie ebenso eine räumliche Darstellung ermöglichen. In DVT sowie in der Rotationsangiographie werden ähnliche Algorithmen wie bei der CT zur Bildberechnung verwendet.
Diagnostik in Deutschland
| Jahr | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CT-Untersuchungen | 7.442.307 | 7.993.497 | 8.393.000 | 8.779.000 | 9.251.000 | 9.859.000 | 10.236.000 | 10.548.000 | 10.910.000 | 11.643.000 | 11.689.698 | 12.225.017 | 11.562.959 | 12.562.471 |
| CT-Geräte | 2.434 | 2.399 | 2.446 | 2.558 | 2.559 | 2.643 | 2.688 | 2.735 | 2.719 | 2.862 | 2.866 | 2.896 | 2.904 | 2.929 |
Kursive Werte stellen Schätzwerte dar.
Literatur zur Geschichte der CT
- Cornelius Borck: Computertomographie. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 268 f.
Weblinks
- Edmund Weitz: Wie funktioniert ein CT (Computertomographie, Radontransformation) auf YouTube, 6. August 2023.
Einzelnachweise
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.