Chorda dorsalis
inneres Achsenskelett aller Chordatiere Aus Wikipedia, der freien Enzyklopädie
Die Chorda dorsalis („Rückensaite“; von lateinisch chorda „Saite“ und dorsum „Rücken“) oder auch Notochord, Achsenstab, selten Urwirbelsäule und häufig schlicht Chorda, ist das ursprüngliche innere Achsenskelett aller Chordatiere (Chordata) und für sie das namensgebende Merkmal. Die Chorda dorsalis ist ein langer, dünner und biegsamer Stab im Rückenbereich. Sie gehört zu den Primitivorganen.

Alle Chordatiere legen zumindest als Embryonen eine Chorda dorsalis an, die manchmal noch von einer bindegewebigen Chordascheide umhüllt ist.[1] Zu den Chordata gehören drei heute noch lebende Tiergruppen: die Lanzettfischchen (Leptocardia), die Schädeltiere (Craniata) und die Manteltiere (Tunicata). Bei den Lanzettfischchen und einigen erwachsenen Schädeltieren durchzieht die Chorda dorsalis die gesamte Körperlänge zwischen Neuralrohr und Darmkanal. Bei den übrigen heutigen Schädeltieren bildet sie sich vollständig oder bis auf kleine Reste zurück, weil sie von der Wirbelsäule (und den Zwischenwirbelscheiben)[2] ersetzt wird.[3] Manteltiere (Tunicata) bilden hingegen nur im Ruderschwanz der Larve eine Rückensaite aus.[4]
Die Chorda dorsalis besitzt sowohl eine Skelett- als auch eine Entwicklungsfunktion. In ihrer Skelettfunktion dient sie als nachgiebiges Innenskelett, das die Körpergestalt streckt und stabilisiert,[5] sowie als Ansatzstelle für Muskeln, die den Körper krümmen. Die Entwicklungsfunktion liegt im Wesentlichen darin, während der Embryonalentwicklung die Bildung bestimmter anderer Gewebe und Organe einzuleiten, unter anderem des Zentralnervensystems.[2]
Begriff
Zusammenfassung
Kontext

Im Jahr 1828 veröffentlichte der deutsch-baltische Naturforscher Karl Ernst von Baer seine Beobachtungen zur Entwicklung von Hühnerembryonen. In den Embryonen war ihm eine Struktur aufgefallen, die sich während der Neuralleistenbildung rückenseitig des Darmkanals der Länge nach durch den Körper zog.
„Mit den Rückenplatten bildet sich aber noch ein anderer Theil, den ich Rückensaite (Chorda dorsalis) nenne.“
Damit hielt der Begriff der Chorda dorsalis Einzug in das gerade entstehende Forschungsfeld der Entwicklungsbiologie. Während der nächsten 20 Jahre wurden außerdem mehrere rezente Chordatiere anatomisch untersucht, die ihre Chordae dorsales im Erwachsenenalter behielten.[7][8] Schließlich erwähnte im Jahr 1847 der britische Paläontologe Richard Owen die Rückensaite erstmals auch bei einem Fossil, dem Plesiosaurus.
“Viewing the subvertebral wedge-bones in the wider relations, I subsequently described them as ‘detached developments of bone in the lower part of the capsule of the notochord (chorda dorsalis, auct.)’.”
„Die subvertebralen keilförmigen Knochen im größeren Zusammenhang betrachtend, beschrieb ich sie im Folgenden als ‚eigenständige knöcherne Bildungen im unteren Abschnitt der Scheide des Notochord (chorda dorsalis, auct.)‘.“
– Richard Owen: Description of the atlas, axis und subvertebral wedge bones in the Plesiosaurus, with remarks on the homologies of those bones[9]
Richard Owen hatte aber nicht nur den Begriff für die Paläontologie geöffnet, er hatte ihn ersetzt. Statt Chorda dorsalis bevorzugte er seinen eigenen Ausdruck Notochord. In den nächsten Jahrzehnten setzte sich Owens Wortschöpfung im englischen Sprachraum (und damit international) weitgehend durch. Heute beschränkt sich die Verwendung von Chorda dorsalis eher auf deutschsprachige Veröffentlichungen.[10]
Die Chorda dorsalis wurde 27 Jahre später von dem deutschen Zoologen Ernst Haeckel herangezogen, um die Gruppenbezeichnung „Chordathiere“ zu konstruieren.[11] Damit lieferte er die Wortgrundlage des Begriffs Chordata (Rückensaitentiere), der im Jahr 1875 vom britischen Zoologen William Sweetland Dallas für eine Übersetzungsarbeit geprägt wurde.[12] Allerdings wird der Begriff heute häufig und fälschlicherweise auf den britischen Genetiker William Bateson zurückgeführt.[13]
Aufbau
Zusammenfassung
Kontext
Unter den heutigen Chordatieren existieren vier gewebliche Varianten der Chorda dorsalis.[2] Die Variante, die bei fast allen Schädeltieren vorkommt, wird als ursprünglich angesehen. Demzufolge besaß der letzte gemeinsame Vorfahre aller Chordata eine Chorda dorsalis, wie sie die Schädeltiere heute noch aufbauen. Die anderen drei Varianten stellen dann Vereinfachungen oder Spezialisierungen dar, die in den jeweiligen Entwicklungslinien aus dem ursprünglichen Zustand eigenständig evolviert worden sind. In allen vier Varianten zeigt sich die Rückensaite immer als ein dorsal gelegenes, vorne und hinten zugespitzt endendes und stabförmiges Gebilde.[14]
Lanzettfischchen
Die Chorda dorsalis reicht beim Lanzettfischchen von der Kopf- bis zur Schwanzspitze und besteht aus einem Stab von Epithelmuskelzellplatten. Das spezialisierte Muskelgewebe wird anfänglich mit Epithelzellen angelegt, die sich anschließend zu Muskelzellen mit quergestreiften Muskelfasern aus den Myofilamenten Paramyosin und Aktin umwandeln. Diese Epithelmuskelzellen zergliedern sich daraufhin weiter zu Epithelmuskelzellplatten.[15] Die flachen Epithelmuskelzellplatten besitzen runde Querschnitte und liegen innerhalb der Chorda dorsalis geldrollenartig hintereinander.[16] Nur wenige der Platten enthalten Zellkerne. Die Dichte der Muskelfasern kann sich zwischen benachbarten Platten stark unterscheiden, wobei dreißig bis vierzig Epithelmuskelzellplatten zusammengenommen die Breite von einem der sich außerhalb anschließenden Rumpfmuskulatur-Streifen (Myomere) haben. Die Platten werden voneinander durch schmale, Gel-gefüllte Interzellularräume getrennt. Die Kraftübertragung der Epithelmuskelzellplatten auf den Körper des Lanzettfischchens erfolgt durch Hemidesmosomen, die zwischen den Platten und der unmittelbar darüber liegenden, innersten Schicht der Chordascheide verlaufen. Im erschlafften Zustand besitzt die Rückensaite einen runden, im angespannten hingegen einen hochovalen Querschnitt. Die Muskelarbeit der Chorda dorsalis ermöglicht dem Lanzettfischchen schlängelndes Schwimmen und rückwärtiges Eingraben in lockeren Meeresgrund.[17]
Dem Chordagewebe liegen dorsal und ventral zwei schmale Streifen aus netzartig verzweigten Müller-Zellen auf.[18][19] Den dorsalen Müller-Zellen und vor allem den Epithelmuskelzellplatten entwachsen kleine Zellfortsätze, die mit Zellplasma gefüllt sind (Plasmafortsätze). An der linken und rechten Ecke der dorsalen Seite der Chorda dorsalis wachsen sie gesammelt weiter und bilden das linke und das rechte Chordahörnchen.[20] Dort passieren sie durch kleine Poren die dünne[18] Chordascheide und erreichen schließlich das Neuralrohr. Am Neuralrohr gehen die Muskelzellfortsätze und Müller-Zellfortsätze synaptische Verbindungen mit den Nervenzellen ein. Jeder Plasmafortsatz bildet eine einzige Synapse.[14][15] Die synaptische Verschaltung der Chordahörnchen ähnelt entfernt der Muskelinnervation der Spulwürmer (bsp. Ascaris). Deren Muskelzellen des Hautmuskelschlauchs bilden aber viel breitere Plasmafortsätze (Muskelarme), die sich zudem büschelartig endverzweigen und dann mehrere Synapsen mit verschiedenen Nervenzellen ausformen.[21]
Manteltiere
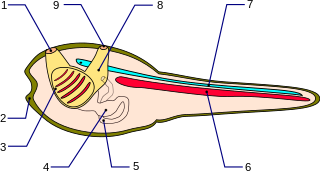
Bei den Manteltieren kommt die Chorda dorsalis nur im Schwanz vor und besteht aus einem Rohr von Epithelzellen. Das Zellplasma der Epithelzellen ist reich an Glykogen und besitzt manchmal Dottereinschlüsse.[22] Die Epithelzellen können flach bis würfelförmig erscheinen und sie umschließen einen Hohlraum, der mit einer glykoproteinreichen gallertartigen Masse ausgefüllt ist.[23]
Die auf den Ruderschwanz beschränkte Chorda dorsalis ist bei den meisten Arten ausschließlich in den stets freischwimmenden Larven vorhanden und dient der Fortbewegung. Nachdem sich die Larve am Meeresuntergrund festgesetzt hat, wird die Rückensaite vollständig abgebaut.[23] Die geschwänzten Manteltiere (Copelata) behalten ihre Rückensaite auch im erwachsenen Zustand, denn sie bleiben ihr Leben lang freischwimmend. Ihre im rechten Winkel abgeknickte Chorda dorsalis dient zur Fortbewegung und zum Zufächeln von Nahrungsbestandteilen.[24]
Schädeltiere
Die Chorda dorsalis der Schädeltiere reicht von der Mitte des Kopfes bis in die Schwanzspitze. Sie besteht aus chordoidem Gewebe, einer eigenen Form von Stützgewebe.[25] Das chordoide Gewebe erweist sich als eine lange Reihung großer Epithelzellen[26] ohne Zwischenzellsubstanz, die miteinander durch Desmosomen und Gap Junctions[27] verbunden sind.[25] Jede Zelle enthält viele Intermediärfilamente[18] und jeweils (meistens nur) eine große Zellvakuole,[28] prall gefüllt mit einer glykogenreichen Flüssigkeit.[2] Die vakuolisierten Zellen erscheinen bläschenförmig, das Zellplasma ist mitsamt den abgeplatteten Zellkernen an die schmalen Ränder gedrängt.[25]
Das chordoide Gewebe wird zuerst als Reihe großer flacher Epithelzellen angelegt (Geldrollenstadium). Daraufhin befüllen sich die Vakuolen und der Zellinnendruck (Turgor) erhöht sich immens. Jede der turgeszenten Zellen weitet sich und die Chorda dorsalis wird insgesamt gestreckt.[25] Der große hydrostatische Druck der turgeszenten Epithelzellen verleiht der Rückensaite ihre Steifheit[26] bei gewisser Biegsamkeit.[23] Sie bildet ein hydrostatisch bedingtes, federndes Achsenskelett.[29] Sehr viele heutige Schädeltiere besitzen nur als Embryonen eine Rückensaite, die danach umfangreich oder gänzlich durch eine Wirbelsäule ersetzt wird.[2]
- Rezente Hohlstachler (Actinistia): Die Chorda dorsalis der einzigen heutigen Gattung der Quastenflosser, Latimeria, reicht von der Mitte des Kopfes bis in die Schwanzspitze und bleibt auch im erwachsenen Tier vorhanden. Sie besteht aus einem Rohr von Epithelzellen, dessen freier Innenraum von einer öligen Flüssigkeit ausgefüllt wird.[2] Mit einem Durchmesser zwischen 35 und 40 Millimetern besitzt Latimeria die breiteste Rückensaite aller rezenten Tiere.[1]
Adulte Chorda dorsalis
Zusammenfassung
Kontext
Bei bestimmten Chordatieren persistiert die Chorda dorsalis bis in das Erwachsenenalter, sie bleibt also vorhanden. Eine solche adulte Chorda dorsalis[29] übernimmt dauerhaft die mechanische Funktion des Achsenskeletts. Sie ist der biegsame Stützstab,[30] der die Länge des Rumpfes aufrechterhält, und bietet den Widerpart für Rumpf- und Schwanzmuskulatur, wodurch Beuge- und Schlängelbewegungen ermöglicht werden.[2] Wenn Längsmuskulatur des Rumpfes kontrahiert, verhindert die Rückensaite, dass sich gleich die ganze Körperseite mit zusammenzieht.[31]
Chordascheide

Jede adulte Chorda dorsalis wird von einer Chordascheide umhüllt (Vagina notochordalis, Perichordalscheide).[26] Ausschließlich embryonal existierende Rückensaiten besitzen keine[32][33] oder nur in dünnen Ansätzen[34] Chordascheiden. Die Chordascheide ist zellfrei und besteht aus vielen[30] zugkräftigen kollagenen Fasern.[26] Insgesamt besitzt sie einen straffen Materialcharakter[25] und ist nicht dehnbar.[26] Entgegen der manchmal verbreiteten Auffassung besteht die Chordascheide nicht aus zwei,[2][29][35] sondern aus drei Schichten.
- Membrana elastica externa: Die äußere und dünne Schicht der Chordascheide.[35] Die Membrana elastica externa besteht aus elastischen Fasern. Sie geht in die Chordafaserscheide über.[29]
- Chordafaserscheide: Der mittlere und hauptsächliche Anteil der Chordascheide.[36] Die Chordafaserscheide besteht aus straffen und nicht-dehnbaren Fasern.[35] Sie ist dafür verantwortlich, dass die Chordascheide insgesamt als nicht-dehnbar erscheint.
- Membrana elastica interna: Die innere und sehr dünne Schicht der Chordascheide. Die Membrana elastica interna besteht aus einem feinen Netz elastischer Fasern[37] und umgibt unmittelbar die Chorda dorsalis.[36]
Fast sofort nach ihrer Entstehung scheiden die Chordazellen eine sie umhüllende, kollagene Schicht aus. Etwas später werden weitere kollagene Fasern abgegeben. Sie schieben sich zwischen die erste Hülle und die Chordazellen. Wenn die Faserbildung schließlich eingestellt wird, hat sich die Chordascheide vollständig aufgebaut. Die erste kollagene Hülle wird zur Membrana elastica externa, die danach eingeschobenen Fasern stellen die Chordafaserscheide und die Membrana elastica interna.[25][36]
Wenn einer adulten Chorda dorsalis Skelettelemente aus Knorpel oder Knochen anliegen (Wirbelelemente) oder sie gar von Wirbelkörpern eingeschnürt wird, bleibt ihre Chordascheide eher dünn. Die Chordascheide geht in die Wirbelkörperbildung ein, indem knorpel- oder knochenbildende Zellen in sie dringen.[18] Die Chordascheide bleibt andererseits auch dünn bei den Lanzettfischchen, obwohl Lanzettfischchen weder Wirbelelemente noch Wirbelkörper besitzen.[18] Das liegt an der geringen Länge der Chordahörnchen, die den Abstand zwischen Rückensaite und Neuralrohr überbrücken müssen.[20]
Embryonale Chorda dorsalis
Zusammenfassung
Kontext
Bei vielen heutigen Schädeltieren wird die Chorda dorsalis nur embryonal angelegt. Sie ist ein Übergangsorgan, das später häufig durch eine Wirbelsäule gänzlich ersetzt oder auf kleine Bereiche zwischen und in Wirbelkörpern eingeengt wird.[2] Mit der Entstehung der Wirbelkörper setzt die Rückbildung der Chorda dorsalis ein. Die embryonale Chorda dorsalis besitzt induktive Funktion für die Embryogenese. Sie stößt die Entstehung und Differenzierung anderer Gewebe in ihrer Nachbarschaft an und gilt als wichtigster Induktor der übrigen embryonalen Körperachsenorgane,[31] zu denen noch die Somiten sowie die Neuralleisten und das Neuralrohr gerechnet werden.[38]
Die Ursprünge der embryonalen Chorda dorsalis können im Modellorganismus Krallenfrosch (Xenopus laevis) bis zum Blasenkeim (Blastula) zurückverfolgt werden.[39] Der Blasenkeim stellt ein embryonales Stadium dar, das von Lanzettfischchen, Manteltieren und modernen Lurchen durchlaufen wird. Bei den anderen Chordatieren entspricht dem Blasenkeim eine Keimscheibe (Blastodiskus).[40] Der Blasenkeim besitzt bereits ein Oben und ein Unten, seine Gestalt kann in eine animale und in eine vegetative Halbkugel geteilt werden.[41] Die Zellen der vegetativen Halbkugel exprimieren die Morphogene vg-1 (synonym bmp6) und nodal zur Herstellung der Proteine namens Vg-1-related protein und Nodal. Beide Stoffe werden von den Zellen ausgeschüttet und driften zum Mittelbereich des Blasenkeims, der Marginalzone. Die Proteine induzieren in den Marginalzonenzellen die Expression des Morphogens t(brachyury) zur Synthese des Proteins Brachyury.[42] Es entsteht der Mesodermring des Blasenkeims.[43] Danach wechselt der Embryo in die nächste Phase seiner Entwicklung, in die Gastrulation. Nun wird sich bald die Chorda dorsalis ausformen:
Die Gastrulation beginnt, wenn sich an einem Punkt kurz unterhalb der Marginalzone der Blasenkeim eindellt und halbmondförmig nach innen stülpt.[44] Die Einstülpung wird Urmund genannt (Blastoporus), dem bei Nabeltieren die Primitivrinne entspricht.[45] Die Brachyury-exprimierenden Zellen der Marginalzone werden von der Einstülpungsbewegung mit erfasst. Sie wandern über den oberen Rand des Urmunds in das Innere des Keims.
Der obere Rand des Urmunds wird auch dorsale Urmund-Lippe genannt[44] (Spemann-Organisator),[46] der bei Nabeltieren der Primitivknoten (Hensen-Knoten) entspricht.[47] Nach Flaschenzellen und den Zellen der Prächordalplatte[48] migrieren als dritte Zellgruppe[49] jene Zellen in das Innere des Keims, die als zweites Feld des Spemann-Organisators bezeichnet werden.[50] Sie exprimieren zusätzlich zum Morphogen t(brachyury) das Morphogen not, das zu den Homöobox-Genen (Hox-Gene) gehört.[51] Diese Zellen verbinden sich mit dem Urdarm (Archenteron), einem röhrenförmigen Gebilde, das vom Urmund in das Innere des Keims wächst. Die Zellen bleiben vorerst in der Mitte der oberen Urdarmaußenseite liegen. Dieser Mittelstreifen aus t(brachyury)- und not-exprimierenden Zellen im Dach des Urdarms ist das prächordale Mesoderm, die Chordaanlage.[52] Links und rechts vom Mittelstreifen befinden sich die beiden Seitenstreifen des Urdarmdachs. Auch ihre Zellen stammen ursprünglich aus der Marginalzone, lagen dort aber leicht seitlich zur dorsalen Urmund-Lippe und stellen nun das präsomitische Mesoderm, die Somitenanlagen.[53]
Kurz darauf schnürt sich das Gewebe der Chordaanlage wieder vom Urdarm ab.[54][55] Es wandert aufwärts in den Raum zwischen Urdarm und embryonaler Außenwand, die hier aus animalem Ektoderm besteht. Die Zellen der Chordaanlage wachsen zur stabförmigen Chorda dorsalis, die bei Säugetier-Embryonen anfänglich noch hohl ist.[48] In der Fachliteratur wird häufig bloß diese allerletzte Phase des Prozesses erwähnt,[26][56][57] dadurch könnte die Chorda dorsalis als endodermales Gebilde aus Zellen des Urdarms erscheinen. Die Zellen der Chorda dorsalis sind aber schon vorher zu Mesoderm geworden – genauer gesagt zu Chordamesoderm[58] – aufgrund der Expression des Morphogens t(brachyury).[59] Gleichzeitig zur Chorda dorsalis schnürt sich noch das Gewebe der paarigen Somitenanlagen vom Urdarm ab (Enterocoelie).[60] Es wandert seitlich aufwärts in den Raum zwischen Urdarm und embryonaler Außenwand, leicht oberhalb links und rechts zur Chorda dorsalis. Die Zellen der Somitenanlagen formen vorerst das paarige und blasenförmige paraxiale Mesoderm.[61]
Die Zellen der neuen Chorda dorsalis exprimieren mehrere Morphogene, unter anderen chrd und nog zur Bereitstellung der Proteine Chordin und Noggin. Die Proteine werden von den Chordazellen abgegeben und diffundieren zu den Zellen jenes animalen Ektoderms, das sich in unmittelbarer Nachbarschaft oberhalb zur Chorda dorsalis befindet. Dort stoppen sie die inhibitorische Wirkung eines Proteins namens BMP-4. Nicht länger gehemmt, differenzieren die Ektoderm-Zellen zu Nerven-Vorläuferzellen (Neuroblasten), aus denen sich anschließend Neuralrohr und Neuralleisten formen werden. Die Chorda dorsalis induziert also den Beginn der Neurulation.[62] Etwa gleichzeitig zerfällt das paarige paraxiale Mesoderm der Länge nach in die Somiten, zwei Reihen mesodermaler Bläschen. Der Zerfall beginnt hinter der Kopfanlage.[63] An ihm ist die Chorda dorsalis zwar nicht beteiligt,[64] sie wird aber maßgeblich das weitere Schicksal der Somiten bestimmen.
In Zebrabärbling-Embryonen (Danio rerio) wurde entdeckt, dass die Zellen der Chorda dorsalis vorübergehend vier Homöobox-Gene exprimieren, die hoxb1, hoxb5, hoxc6 and hoxc8 heißen. Deren Genexpressionen geschehen aber nicht gleichzeitig und nicht überall in der Rückensaite. Stattdessen werden sie zeitlich und örtlich nacheinander abgelesen. Zum Beispiel beginnt die Expression des Morphogens hoxb1 im Embryo zehneinhalb Stunden nach der Befruchtung. Sie wird stark heruntergefahren, nachdem das neunte Somitenpaar gebildet wurde, und endet vollständig, wenn das zwölfte Somitenpaar ausgeformt wird. Dabei ist die hoxb1-Expression örtlich auf den vorderen Abschnitt der Chorda dorsalis beschränkt. Die drei anderen Homöobox-Gene werden daraufhin ebenfalls sowohl zeitlich als auch örtlich nacheinander aktiviert und deaktiviert.[65] Die Genprodukte der Hox-Gene tragen wahrscheinlich dazu bei, dass der Rückensaite benachbarte Zellen körperabschnittweise variierte Gewebe ausformen.[66][67]

Die Zellen der Chorda dorsalis exprimieren außerdem das Morphogen shh, mit dem das Protein Sonic hedgehog synthetisiert wird. Sonic hedgehog wird einerseits in die dorsale Seite der Membranen der Chordazellen gebaut. Dadurch werden die Zellen der Unterseite des Neuralrohrs, die der Chorda dorsalis direkt aufliegen, von Sonic hedgehog berührt.[68] Auf dieses Signal hin verdicken sich die berührten Zellen zur Bodenplatte des Neuralrohrs. Die Bodenplattenzellen produzieren nun ihrerseits Sonic hedgehog. Ein Teil davon wird in das Innere des Neuralrohrs gegeben, wobei die Konzentration von Sonic hedgehog mit der Entfernung zur Bodenplatte abnimmt und auf der ungefähren Mitte des Neuralrohrs gänzlich verschwindet. Entlang seines Konzentrationsgefälles führt Sonic hedgehog zu unterschiedlichen Differenzierungen der Neuroblasten. In großer Nähe zur Bodenplatte entstehen V3-Interneurone, darüber Motoneurone und weiter zur Neuralrohr-Mitte noch andere Interneuron-Typen.[69] Die Chorda dorsalis induziert also die dorso-ventrale Gliederung des Neuralrohrs durch membranständiges Sonic hedgehog.[70]
Sonic hedgehog wird andererseits in wasserlöslicher Form in den Spalt zwischen Chorda dorsalis und Somiten gegeben. Es erreicht die inneren unteren Anteile der Somiten, die der Chorda dorsalis am nächsten liegen. Auf dieses Signal hin differenzieren sich die Zellen jener Somitenanteile zu Sklerotom-Zellen. Sie lösen sich allmählich von den Rest-Somiten und wandern in Richtung Chorda dorsalis. Dort werden sie sich bald um die Rückensaite legen und sie in (anfänglich noch knorpelige) Wirbelkörper schnüren.[71] Während der einsetzenden Wanderung der Sklerotom-Zellen gibt die Chorda dorsalis aber weiteres Sonic hedgehog ab. Der Stoff ist nun daran beteiligt, einen Teil der Rest-Somiten zu Muskel-Vorläuferzellen (Myoblasten) differenzieren zu lassen.[72] Die Zellen dieser Myotome wechselwirken ihrerseits mit noch nicht abgewanderten Sklerotom-Zellen und wandeln sie zum Syndetomen.[73] Dann emigrieren die Myoblasten und als letzte Somiten-Reste verbleiben die Dermatome. Alle Anteile der Somiten werden schließlich durch den gesamten Körper migrieren und an vielen Stellen Gewebe anlegen: die Sklerotom-Zellen die Wirbelkörper, die Myotom-Zellen die quergestreifte Muskulatur, die Syndetom-Zellen sehnenartige Strukturen[74] und die Dermatom-Zellen die Lederhaut.[75] Die Chorda dorsalis induziert also den Zerfall der Somiten[76] sowie direkt (Sklerotom und Myotom) und indirekt (Syndetom und Dermatom) die Weiter-Differenzierung der Somitenzellen durch wasserlösliches Sonic hedgehog.[77]
Mit der Einschnürung durch Wirbelkörper[78] verebbt die induktive Wirkung der Rückensaite.
Evolution
Zusammenfassung
Kontext
Die Entwicklung der Chorda dorsalis hängt untrennbar mit der Stammesgeschichte der Chordatiere zusammen. Deren erste Spuren sind mehr als 520 Millionen Jahre alt. Chordata zählen zu den Neumundtieren (Deuterostomia), zu denen noch Stachelhäuter (Echinodermata) und Kiemenlochtiere (Hemichordata) gehören. Die ursprünglichen Neumundtiere waren spiegelsymmetrisch (bilateralsymmetrisch)[79] und besaßen die Veranlagung, Innenskelette (Endoskelette) zu bilden.[80] Es ist nicht geklärt, ob sie festsaßen (benthisch-sessile Lebensweise) oder über den Meeresboden krochen (benthisch-vagile Lebensweise) oder ob sie sich freischwimmend bewegten (pelagische Lebensweise).[57][81]
Hydroskelett
Zumindest aber bevorzugten die direkten Ahnen der Chordatiere eine vagile Lebensweise.[82] Anfänglich werden sie sehr wurmähnlich ausgesehen und wahrscheinlich einen ebensolchen Körperbau besessen haben: Direkt unter der Körperoberfläche befand sich ein Hautmuskelschlauch, der aus einer Schicht Längsmuskulatur und einer Schicht Ringmuskulatur bestand. Mittig im Inneren dieses Muskelrohrs befand sich das Darmrohr. Der Raum zwischen Muskelrohr und Darmrohr wurde von der sekundären Leibeshöhle, dem Coelom, eingenommen. Die Leibeshöhle war mit einer Flüssigkeit gefüllt. Der hydrostatische Druck der Leibeshöhlenflüssigkeit hielt Hautmuskelschlauch und Gedärm dauerhaft auf Abstand und beugte inneren Verletzungen vor, weil Darmrohr und Hautmuskelschlauch nicht aneinander rieben. Außerdem diente die Leibeshöhlenflüssigkeit als verformbares, aber nicht kompressibles Hydroskelett. Der evolutionäre Nutzen des Hydroskeletts lag in der Verminderung des Bewegungsenergiebedarfs: Für eine schlängelnd-kriechende Fortbewegung zieht sich die Längsmuskulatur einer Seite des Hautmuskelschlauchs zusammen. Damit sich die Körperseite dabei nicht klumpenartig verdickt und auf die inneren Organe drückt, kontrahiert bei Tieren ohne Hydroskelett gleichzeitig die Ringmuskulatur. Der Einsatz der Ringmuskulatur erhöht den Energieaufwand aber beträchtlich. Ein Hydroskelett leistet andererseits der kontrahierenden Längsmuskulatur hydrostatischen Widerstand und die Ringmuskulaturarbeit kann eingespart werden. Die Beweglichkeit des wurmähnlichen Körpers kann allerdings noch gesteigert werden, wenn in die Leibeshöhle Trennwände gezogen werden. Die Kammerung des Hydroskeletts durch derartige bindegewebige Septen verbessert die Kontrolle über die Verformungen, die der wurmähnliche Körper durch Bewegungen erfährt, so dass Kriech- und Grabbewegungen vereinfacht werden.[5] Außerdem wurden nun effektive Schwimmbewegungen möglich. Evolutionär wurde die erste pelagische Lebensweise weiter verbessert, indem der wurmähnliche und gekammerte Körper gestreckt und seitlich abgeflacht wurde. Dieses evolutionäre Stadium ist möglicherweise in Fossilien der Gattung Yunnanozoon[83][84] (= Cathayamyrus,[85][86] Haikouella,[87][88] Zhongxiniscus[89]) aus dem Unterkambrium erhalten geblieben.[90]
Rückensaite
Die freischwimmenden, abgeflachten Würmer schlugen daraufhin einen evolutionären Weg ein, der zu den Chordata führte. Es wurden Muskelbänder entwickelt, die parallel an beiden Körperseiten vom Rücken zum Bauch führten (segmentale Körpermuskulatur). Diese Myomere ermöglichten gut koordiniertes schlängelndes Schwimmen. Allerdings wäre ihr Nutzen sehr begrenzt, wenn sie über ein breites Hydroskelett gespannt würden. Darum benötigte segmentale Körpermuskulatur ein neuartiges und schlankes Achsenskelett. Das Achsenskelett diente als Ansatzpunkt für die Muskelbänder und behinderte sie nicht beim Arbeiten. Es gewährleistete schlängelndes Schwimmen und hielt gleichzeitig dauerhaft die stromlinienförmige Körpergestalt aufrecht. Allerdings durfte es nicht zu steif ausfallen, um Bewegungen weiterhin zuzulassen: Die Chorda dorsalis ist das flexible Endoskelett, das als Angepasstheit an die pelagische Lebensweise evolviert worden ist.[5][91] Die evolutive Herausbildung der Chorda dorsalis ging direkt einher mit einer verlängerten Expression des Gens t(brachyury) in jenen mesodermalen Zellen, die während der frühen Embryonalentwicklung als Mittelstreifen auf der oberen Urdarmaußenseite eingelagert wurden.[92]
Mit der Rückensaite wurde das Hydroskelett überflüssig und es ging verloren. Der Antriebsapparat der Chordatiere wurde mit Myomeren und Chorda dorsalis auf die dorsale Körperhälfte beschränkt – als einzigartiger Chorda-Myomeren-Apparat der Chordatiere.[5] Die Myomere wurden noch durch Myosepten getrennt. Das sind dünne Schichten aus Bindegewebe, die Myomere voneinander isolieren. Mit ihnen wurde das Überspringen von Muskelerregungen erschwert, somit die Muskelkoordination verbessert und die Beweglichkeit weiter verfeinert.[93] Eine eher wenig abgewandelte Form solcher Chordata stellen die heutigen Lanzettfischchen dar (Leptocardia). Allerdings wurden bisher keinerlei Fossilien von Ahnen der kleinen und gänzlich Hartteil-freien Lebewesen gefunden.[94]
Die ältesten fossil belegten Chordatiere gehörten zur Gruppe der schädellosen Myllokunmingiida und stammten aus Unterkambrium und Mittelkambrium. Ihre Gattungen heißen Haikouichthys[95] (= Myllokunmingia)[96] und Zhongjianichthys[97] sowie Metaspriggina.[98] Das Achsenskelett der Myllokunmingiida bestand aus der Chorda dorsalis. Möglicherweise verfügten sie über kollagenfreies Knorpelgewebe, das aber kaum zum Achsenskelett beitrug.[99] Der Körperbau existierte ganz ähnlich weiter bei den Pikaiidae, deren Evolutionslinie fossil im Mittelkambrium nachweisbar wird.[100][101]
In unterkambrischen Gesteinsschichten wurden zahnähnliche Gebilde gefunden, die Conodonten genannt werden. In jenen Schichten werden sie der Gattung Protohertzina zugeordnet.[102] Conodonten finden sich danach in vielen Gesteinen. Die letzten Vorkommen enden mit der Trias. Die Körper der Tiere, die in sich die Conodonten trugen, wiesen keine Hartteile auf. Die Gestalt der Conodontentiere (Conodontophora) ist nur von extrem wenigen Abdrücken bekannt, zum Beispiel von der viel später lebenden Gattung Clydagnathus aus dem Unterkarbon.[103] Gemäß ihren Fossilien besaßen die Conodontophora langgestreckte lanzettliche Körper mit durchgehenden Rückensaiten. Außerdem trat eine Vorform des Schädels auf.[104][105] Wegen der Schädel-Vorform verkürzte sich das Vorderende der Chorda dorsalis. Sie begann nicht mehr in der Körperspitze, sondern erst ungefähr in der Mitte des Kopfes, hinter den Augen.[104]
Rückensaitenrückbildung
Alle bisher genannten Tiere lebten pelagisch.[106] Im Unterkambrium spaltete sich aber auch schon die eigene Entwicklungslinie der Manteltiere (Tunicata) ab.[107] Die älteste Gattung der Manteltiere aus jener Zeit heißt Shankouclava.[108][109] Während gleichzeitig Myllokunmingiida, Pikaiidae und Conodontophora unter Einsatz ihrer Rückensaiten die pelagische Lebensweise realisierten, schlugen Manteltiere einen anderen Weg ein. In ihrer Entwicklungslinie wurde die Chorda dorsalis, die erst vor wenigen Millionen Jahren evolviert worden war, schon wieder in doppelter Weise abgebaut. Einerseits wurde sie zeitlich auf freischwimmende Larvalstadien beschränkt[110][111] und andererseits räumlich auf den Ruderschwanz begrenzt.[23] Viel später könnten Manteltiere der Ordnung Aplousobranchia vor dem Erwachsenwerden geschlechtsreif geworden sein (Neotenie). Aus ihren Nachkommen könnten die geschwänzten Manteltiere (Copelata) hervorgegangen sein. Die winzigen Tiere bleiben ihr kurzes Leben lang in einer Art Larvalstadium samt rechtwinkelig abgeknickter Schwanz-Chorda.[112]
| Systematik der Chordata unter Berücksichtigung adult persistierender Chordae dorsales a | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fettdruck: Erwachsene Tiere besaßen oder besitzen Rückensaiten statt Wirbelsäulen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
a: Die Rücksensaiten der angesprochenen Tiere werden nicht vollständig rückgebildet beziehungsweise durch Wirbelsäulen ersetzt. Die Chordae dorsales kommen also nicht nur in Larven oder Embryonen vor, stattdessen überdauern (persistieren) sie in erwachsenen (adulten) Formen. |
Wirbelelemente
Noch während des Kambriums entstanden aus schädellosen Vorformen die ersten Schädeltiere (Craniata), die Rundmäuler (Cyclostomata).[123][124] Zur Gruppe der Rundmäuler werden Neunaugen (Petromyzontida) und Schleimaale (Myxinoidea) gerechnet. Ihre weichen, knochenlosen Körper hinterließen jedoch höchst selten Fossilien. Deshalb stammen die bisher ältesten bekannten Neunaugen aus dem Oberdevon (Priscomyzon)[125] und Unterkarbon (Hardistiella).[126]
Bei den Neunaugen persistierte stets die Rückensaite. Dorsal angelagert waren aber bogenförmige Knorpelstrukturen, die Neuralbögen (Arcus neurales) genannt werden.[127] Die Neuralbögen waren wahrscheinlich die ersten Wirbelelemente[128] und Frühformen gab es vielleicht schon bei Haikouichthys.[129] Wirbelelemente waren Skelettelemente aus Knorpel oder (später auch) aus Knochen[130] und können die Rückensaite zu allen Seiten flankieren (parachordale Elemente[131] oder perichordale Elemente[35]). Wirbelelemente bewirken eine zusätzliche Verfestigung des Achsenskeletts.[131] Wenn sich Wirbelelemente zur Chorda dorsalis gesellen, wird von Kamptospondylie gesprochen.[132] Zwar wurden bisher an fossilen Neunaugen und anderen fossilen kieferlosen Fischen keine Wirbelelemente entdeckt,[133] dies liegt jedoch sehr wahrscheinlich daran, dass sie aus Knorpel bestanden und nicht erhalten blieben.
Die ältesten Fossilien der Schleimaale kommen aus dem Oberkarbon (Myxinikela, Myxineidus).[134][135] Die Chorda dorsalis der Schleimaale besitzt keinerlei Wirbelelemente,[2] es liegt Aspondylie vor.[132] Die Wirbelelemente wurden rückgebildet,[136] als die einzigartige Beweglichkeit der Schleimaale evolviert wurde, denn sie können ihren Leib verknoten.[137] Unter Schädeltieren besitzen einzig Schleimaale eine aspondyle Rückensaite.[2]
Schädel

Die Evolution des Schädels verdrängte die Chorda dorsalis aus der Kopfregion. Fortan begann bei allen Schädeltieren die Rückensaite erst hinter der Hirnanhangsdrüse (Hypophyse)[1] an der Basis des hinteren Schädelabschnitts, des Hirnschädels (Neurocranium).[138] Ursprüngliche Schädeltiere besaßen ein Achsenskelett aus einer adulten Chorda dorsalis, die am Hinterende des Schädels ansetzte und von parachordalen Elementen eingefasst wurde, von denen die Neuralbögen die evolutionär ältesten waren.[139] Die Situation kann einerseits an rezenten Neunaugen, andererseits an fossilen, ebenfalls kieferlosen Schalenhäutern nachvollzogen werden (Ostracodermi),[127] die mit Anatolepis ab dem Oberkambrium bekannt sind.[140][141]
Dieser Teil des Körperbaus änderte sich vorerst auch nicht, als die Kiefermäuler (Gnathostomata) aus den Schalenhäutern evolviert wurden. Wegen gewisser Ähnlichkeiten im Bau des Riechorgans gingen sie wahrscheinlich aus einer Schalenhäuter-Gruppe namens Galeaspida hervor.[142][143] Als erste Kiefermäuler traten im Unterordovizium die Panzerfische auf (Placodermi). Ihre ältesten fossil belegten Gattungen stammen allerdings mit Shimenolepis[144] erst aus dem Untersilur und mit Silurolepis aus dem Obersilur.[145] Schon kurz vor dem Mittelordovizium spalteten sich aus den Panzerfischen die echten Kiefermäuler ab (Eugnathostomata), denn erste Hautschuppen von derartigen Fischen wurden in mittelordovizischen Gesteinsschichten entdeckt.[146]
Eine Abspaltung der echten Kiefermäuler von den Panzerfischen wird durch die Fossilien Qilinyu und Entelognathus nahegelegt, die bis in das Obersilur überlebt hatten und deren Schädel Mosaiken aus placodermen und eugnathostomen Knochen enthielten.[147][148] Aus den basalen echten Kiefermäulern gingen zwei Gruppen hervor, die Knorpelfische (Chondrichthyes) und die echten Knochentiere (Euteleostomi). Ihre basalen gemeinsamen Vorfahren besaßen noch ein Mosaik von Merkmalen beider Nachfolgegruppen, wie es ersichtlich wird am fossilen Fisch Janusiscus, der bis ins Unterdevon vorkam.[149] Die Knorpelfische teilten sich in Stachelhaie (Acanthodii) und Elasmobranchomorpha. Mit Sinacanthus[150] und Kannathalepis[151] können beide Gruppen als Fossilien bis in das Untersilur zurückverfolgt werden. Dabei gingen die Elasmobranchomorpha aus Stachelhaien hervor, was anhand des Schädels, der Bezahnung und des Schultergürtels der Mosaikform Doliodus aus dem Unterdevon nachvollzogen werden kann.[152] Die echten Knochentiere gliederten sich ebenfalls in zwei Evolutionslinien, in Strahlenflosser (Actinopterygii) und Fleischflosser (Sarcopterygii). Frühformen der Strahlenflosser werden mit Andreolepis/Lophosteus[153] und Meemannia[154] aus dem Obersilur beziehungsweise Unterdevon belegt. Aus den gleichen Zeithorizonten stammen die ersten fossilen Frühformen der Fleischflosser namens Guiyu[155], Psarolepis[156], Achoania und Sparalepis.[157] Die sieben Gattungen vereinigten in sich mosaikhaft noch Merkmale beider Gruppen, führten jedoch entweder schon ein bisschen mehr in Richtung Strahlenflosser oder in Richtung Fleischflosser.
Wirbelsäulen
Seit Anatolepis waren ungefähr 70 Millionen Jahre vergangen. Dennoch persistierten die kamptospondylen Rückensaiten sowohl bei allen Panzerfischen[158] und Stachelhaien[159] als auch bei sämtlichen sonstigen, bisher erwähnten Schädeltieren. Dann jedoch wurde die Chorda dorsalis viermal unabhängig voneinander[160] von Wirbelkörpern (Centra) unterbrochen,[127] indem sie umwachsen und eingeschnürt[161] beziehungsweise vollständig durch knorpelige oder knöcherne Wirbelsäulen (Columnae vertebrales) ersetzt wird. Wirbelkörper entwickelten sich aus parachordalen Elementen. Sie wurden in regelmäßigen Abständen in die Chorda dorsalis geschaltet.[127] Wirbelsäulen bewirkten einerseits eine weitere Verfestigung und Versteifung des Achsenskeletts[162] und boten andererseits sehr feste Muskelverankerungen und starken Muskelwiderpart.[127]

Wirbelkörper wuchsen um die Chorda dorsalis herum und in sie hinein. Blieb von der Rückensaite ein Rest in der Mitte des Wirbelkörpers vorhanden, liegt intravertebrale Chordapersistenz vor. Ebenso konnte zwischen den Wirbelkörpern etwas Chorda dorsalis verbleiben in intervertebraler Chordapersistenz.[163] Die intervertebralen Chorda-dorsalis-Reste gewährleisten die Beweglichkeit der Wirbelsäule. Doch auch diese letzte Funktion der Rückensaite wurde in einigen Evolutionslinien schließlich aufgegeben. Dann evolvierten Wirbelgelenke, mit denen die Wirbelkörper direkt miteinander beweglich verbunden werden. Auf der anderen Seite konnten Wirbelkörper genauso schließlich untereinander verwachsen, um größtmögliche Steifheit zu evolvieren. In beiden Fällen wurde die Chorda dorsalis überhaupt nicht mehr benötigt und sie involierte vollständig:
- Neoselachii: Eine Gruppe Elasmobranchomorpha aus den Reihen der Plattenkiemer (Elasmobranchii) evolvierte zu den Neuhaien (Neoselachii). Zu ihnen gehören alle heute lebenden Haie und Rochen. Ihr fossil erster Vertreter stammte aus dem jüngsten Unterdevon und heißt Mcmurdodus.[164] Bei den Neuhaien wurde die Chorda dorsalis durch eine Wirbelsäule aus kalkhaltigem Knorpel (Kalkknorpel)[165] ersetzt.[166] Die Chordascheide verknorpelte und verwuchs mit parachordalen Elementen. Sowohl die Gelenkkörper als auch die Neuralbögen wurden miteinander bindegewebig verbunden.[167] Eine solche Wirbelsäule wäre sehr steif, würde sie nicht wegen ihrer Knorpeligkeit biegsam bleiben[168] und aus bis zu 400 Einzelwirbeln bestehen.[167] Im Inneren der Wirbelkörper blieben Chorda-dorsalis-Reste zurück,[169] es liegt eine intravertebrale Chordapersistenz vor.
- Actinopterygii: Aus den ursprünglichen Strahlenflossern (Actinopterygii) entwickelten sich im Unterkarbon jene Fische, von denen alle noch heute lebenden Strahlenflosser abstammen.[170] Von dieser Kronengruppe der Strahlenflosser spalteten sich schon damals die Flösselfische (Cladistia) ab, die viele ursprüngliche anatomische Merkmale bewahrt haben und deren erste bekannte fossile Vertreter in einer Gruppe namens Scanilepiformes gesehen werden.[171] An den Flösselfischen kann belegt werden, dass die Strahlenflosser der Kronengruppe eine kräftige knöcherne Wirbelsäule mit intravertebraler und intervertebraler Chordapersistenz entwickelt hatten.[172] Flösselfische der Gattung Serenoichthys aus der Oberkreide besaßen Wirbelsäulen mit etwa 30 Wirbelkörpern.[173] Wegen der höheren Zugfestigkeit von Knochengewebe sind die Wirbelkörper der Strahlenflosser dünner als die der Knorpelfische. Häufig sind sie miteinander locker bindegewebig verbunden und echte Wirbelgelenke fehlen.[174] Zwar wurde schon etwas später bei den Knorpelganoiden (Chondrostei) die Wirbelsäule gegen eine kamptospondyle Chorda dorsalis[175] rückgetauscht,[176] insgesamt aber setzte sich die knöcherne Wirbelsäule unter Strahlenflossern durch. Sie wurde an die Evolutionslinie der Neuflosser (Neopterygii) vererbt, bei denen verschiedene Gattungen als erste fossile Vertreter diskutiert werden.[177] Innerhalb der Neuflosser-Gruppe der Knochenganoiden (Holostei) schritt die Wirbelsäulenverknöcherung bei intravertebraler und intervertebraler Chordapersistenz besonders weit fort. Im Knochenhecht Lepisostes aus der Gruppe der Knochenhechtartigen (Lepisosteiformes) formen sich schließlich echte Wirbelgelenke[178] und die Wirbelkörper verknöchern vollständig – ein einmaliger Befund unter Fischen.[179]
- Amniota: Ein Zweig der vierfüßigen Landwirbeltiere (Tetrapoda) evolvierte zu den Nabeltieren (Amniota). Ihr erster fossil fassbarer Vertreter aus dem Unterkarbon heißt Casineria.[180] Außerhalb des Wassers fehlte der Auftrieb, um die Tierkörper zu stützen. Stattdessen lastete die Schwerkraft vollständig auf dem Skelett.[131] Daraus entstand der Evolutionsdruck, aus den Wirbelelementen ihrer fleischflossigen Vorfahren[181] echte, tragende Wirbelsäulen zu evolvieren. Wenige breite Wirbelkörper wurden in die Chorda dorsalis gebaut[182] und miteinander gelenkig verbunden. In den Spalten zwischen den Wirbelkörpern wuchsen faserknorpelige Zwischenwirbelscheiben und ersetzten die intervertebrale Chorda dorsalis.[183] Bei vielen heute lebenden Nabeltieren verbleibt ein Rest Rückensaite in den Wirbelkörpern. Nur bei älteren ausgewachsenen Vögeln (Aves) und bei Säugetieren (Mammalia) wird die intravertebrale Chordapersistenz gänzlich beendet.[184][185]
- Lissamphibia: Auch die modernen Lurche (Lissamphibia) zählen zu den Landwirbeltieren und ihr Achsenskelett wurde ähnlich daran angepasst, die Körperlast an Land zu tragen. Ihre Wirbelsäulen entwickelten sich allerdings unabhängig von denen der Nabeltiere.[178][186] Knorpelige Zwischenwirbelscheiben ersetzten die Chorda dorsalis zwischen den gelenkig verbundenen Wirbelkörpern.[187][188] Bei den heutigen Arten besteht häufig eine intravertebrale Chordapersistenz. Nur unter den echten Starrbrustfröschen (Firmisternia), zu denen beispielsweise die echten Frösche (Ranidae) gehören, wird das Chordagewebe in den Wirbelkörpern vollständig knöchern ersetzt (holochordale Ossifikation).[189] Moderne Amphibien treten fossil erstmals mit Gerobatrachus im Unterperm in Erscheinung,[190] ihre Entwicklungslinie sollte darum etwas früher im Oberkarbon aufgekommen sein.[191] Innerhalb der heutigen Lissamphibien verläuft die embryonale beziehungsweise larvale Herausbildung der Wirbelsäule zeitlich unterschiedlich. Einerseits werden Wirbelkörper bei Schleichenlurchen (Gymnophiona) und Schwanzlurchen (Caudata) verhältnismäßig früh ausgeformt.[192] Andererseits geschieht die Bildung der wenigen[193] Wirbelkörper von Froschlurchen (Anura) verzögert. Darum behalten Froschlurche länger eine durchgehende Chorda dorsalis während ihrer Individualentwicklung.[192] Sie ähneln darin jener ursprünglichen und ausgestorbenen Amphibiengruppe, die als Labyrinthzähner (Labyrinthodontia) zusammengefasst werden. Unter bestimmten Labyrinthzähnern überdauerte eine durchgehende Chorda dorsalis bis ins Erwachsenenalter.[194] Schleichenlurche und Schwanzlurche andererseits tun es jeweils eher den Hülsenwirblern (Lepospondyli) gleich, die unabhängig von ihnen schon im Unterkarbon ebenfalls lang gestreckte und sehr schlanke Körper entwickelt hatten.[195]
Die viermalige unabhängige Evolution der Wirbelsäule ging stets von den gleichen Ausgangsstrukturen aus, die bereits im letzten gemeinsamen Vorfahren aller Schädeltiere vorhanden waren: Die Chorda dorsalis und die Wirbelelemente sind unter allen Schädeltieren homologe Merkmale.[127] Die Wirbelsäulen wurden aber vierfach konvergent aus diesen gleichen homologen Ausgangsmerkmalen evolviert. Demzufolge handelt es sich bei den Wirbelsäulen nicht um Homologien, sondern um Homoiologien. Wirbelsäulen brachten den Kiefermäulern so große evolutionäre Vorteile, dass die meisten mit aspondyler oder kamptospondyler Chorda dorsalis inzwischen ausgestorben sind. Die überlebenden Ausnahmen stellen Seekatzen (Chimaeriformes aus der Unterklasse der Holocephali), Knorpelganoiden (Chondrostei), Quastenflosser (Actinistia) und Lungenfische (Dipnoi) mit jeweils wenigen rezenten Arten.[2]
Chordoide Gebilde
Zusammenfassung
Kontext

Organe und Organteile, die mehr oder weniger große Ähnlichkeit mit der Chorda dorsalis zu besitzen scheinen, können chordoide Gebilde genannt werden.[57] Die Gebilde sind jedoch weder evolutionäre Vorformen (Orimente) noch Reste (Rudimente) der Rückensaite. Es sind eigenständige Entwicklungen (Homoplasien).
- Axochord: Ringelwürmer (Annelida) und die übrigen Tiere aus der Gruppe der Lophotrochozoa bilden ein Axochord. Es handelt sich um einen paarigen Streifen aus mesodermalen Muskelzellen, der zwischen dem Verdauungstrakt und dem Bauchmark liegt. Die Axochord-Zellen umgeben sich mit einer gemeinsamen Hülle aus straffem kollagenen Bindegewebe. An ihm setzen paarige Muskelgruppen an, die sich bauchseitig durch die Körper ziehen. Ein Axochord wurde auch bei Pfeilwürmern (Chaetognatha) entdeckt. Somit könnte es sich bei diesem paarigen bauchseitigen Muskelstreifen um eine Struktur handeln, die schon der letzte gemeinsame Vorfahre aller heutigen Urmundtiere (Protostomia) vor ungefähr 542 Millionen Jahren[196] besessen hatte.[197][198]
- Bukkalcirren der Lanzettfischchen (Leptocardia): Die Mundöffnung der Lanzettfischchen wird umkränzt von Cirren („Lippententakel“,[199] „Bukkalcirren“,[200] „Mundcirren“[201]). Jeder Cirrus wird von einem dünnen Stäbchen aus einzeln hintereinander aufgereihten, seitlich abgeflachten und filamentreichen Zellen durchzogen. Demzufolge zeigt jedes Stäbchen einen Aufbau, der stark einer winzigen Chorda dorsalis ähnelt.[202][203]
- Chorda intestinalis: Die Chorda intestinalis kommt in Plattwürmern (Plathelminthes) der Gattung Nematoplana vor. Sie befindet sich im Darmdach am vorderen Körperende. Die Chorda intestinalis versteift die Körpergestalt des Plattwurms durch turgeszente Zellen.[204]
- Hypochorda: Die Hypochorda (Subnotochordalstab) ist ein einzelliger flacher Streifen, der bei nicht-amniotischen Schädeltieren während der Embryonalphase angelegt wird.[205] Die Hypochorda trennt sich erst vom Dach des Urdarms, nachdem sich die mesodermalen Chorda- und Somitenanlagen bereits vollständig abgeschnürt haben. Deshalb handelt es sich bei der Hypochorda um endodermales Gewebe. Die Hypochorda wird zwischen Urdarmdach und Chorda dorsalis eingezogen. Ihre Abschnürung erfolgt mit Hilfe eines chemischen Signals, das von der unmittelbar anliegenden Chorda dorsalis ausgeht. Die Hypochorda gibt selbst ein Protein der VEGF-Gruppe ab, das den Aufbau der dorsalen Aorta induziert.[206]
- Nucleus pulposus: Bei Säugetieren bildet der zentrale Gallertkern (Nucleus pulposus) zusammen mit dem knorpeligen Faserring (Anulus fibrosus) die Zwischenwirbelscheibe. Der Kern besteht aber weder aus Knorpel noch aus Chordamesoderm, sondern aus einer zähflüssigen amorphen Gallerte. Darin befinden sich stark wasserziehende Glykosaminoglykane sowie Kollagenfasern. Die Gallerte stellt eine Art Wasserkissen dar, dessen hydrostatischer Druck den Faserring aufspannt. Der Kern ist kein Rest der Rückensaite, sondern eine ersetzende Neubildung. Die Substanzen des Nucleus pulposus werden aber von den Chordazellen bereitgestellt. Wenn im Embryo eine Zwischenwirbelscheibe angelegt wird, gibt der darin eingeschlossene Chorda-dorsalis-Abschnitt Glykosaminoglykane und Kollagenfasern an die Umgebung. Die abgegebenen Stoffe weiten den Raum auf die Maße des Nucleus pulposus.[207] Anschließend zerfällt die eingeschlossene Chorda dorsalis zuerst in kompakte Chordasegmente. Sie werden weiter zu einem netzartig zerfaserten Rest abgebaut, der Chordareticulum genannt wird. Das Chordareticulum besteht aus wenigen und nicht turgeszenten Epithelzellen des Chordamesoderms. Mit der Zeit werden die Epithelzellen immer weniger, beim Menschen verschwinden die letzten nach dem dritten Lebensjahr.[208] Während des Jugendalters existieren im Gallertkern einzelne Chondrozyten sowie rundliche Zellen,[209] die Fibroblasten ähneln. Beim Erwachsenen wird das Innere des Gallertkerns weitgehend zellfrei. Zudem nehmen allmählich die Anteile der Glykosaminoglykane ab und der Kollagenfasern zu. Dadurch verliert der Kern an Wasser und Ausdehnung. Die Lücke, die seine schrumpfenden Ränder hinterlassen, wird durch hinterher wachsenden Faserknorpel des Faserrings verfüllt.[2][210][211] In seltenen Fällen können geringe Reste der Chorda dorsalis am Vorder- oder Hinterende der Wirbelsäule zurückblieben. Die Reste können zu Geschwulsten auswachsen, die Chordome genannt werden.
- Stomochord: Das Stomochord ist eine steife und gestreckte Aussackung des Verdauungstrakts (Darmdivertikel), die vom Dach des Mundes bei Kiemenlochtieren (Hemichordata) ausgeht und sich nach vorn in den Kopflappen (Prosoma) zieht. Das Stomochord stabilisiert den Übergang vom Kopflappen in den Kragen (Mesosoma).[1][81] Das Stomochord besitzt nicht die blasen- oder säckchenähnliche Form eines einfachen Darmdivertikels, sondern kann in mehrere Abschnitte gegliedert werden, die sich voneinander in Weite und Form unterscheiden. Vom Munddach entspringt der erste abgeflachte und flaschenähnliche Abschnitt. Hinter seinem flaschenhalsförmigen Ende schließt sich ein mittlerer Abschnitt mit taschenartigen Aussackungen an. Der mittlere Abschnitt geht über in eine dünne Röhre, die sich schließlich zu einem stabförmigen Fortsatz verjüngt. Nur der Fortsatz besitzt eine gewisse Ähnlichkeit zur Chorda dorsalis.[212]
Literatur
- Thomas Stach: Chordate phylogeny and evolution: a not so simple three-taxon problem. In: Journal of Zoology. Band 276, 2008, doi:10.1111/j.1469-7998.2008.00497.x, S. 117–141.
- Dietrich Starck: Vergleichende Anatomie der Wirbeltiere Band 2. Springer-Verlag, Berlin/Heidelberg 1979, ISBN 3-540-09156-4, S. 35–66.
- Derek L. Stemple: Structure and function of the notochord: an essential organ for chordate development. In: Development. Band 132, 2005, doi:10.1242/dev.01812, S. 2503–2512.
Weblinks
Wiktionary: Chorda dorsalis – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
