Butan
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Butan, auch n-Butan ist ein gasförmiges farbloses Alkan, das die geradkettige (CH3–CH2–CH2–CH3) Form der beiden Strukturisomere der Butane (Summenformel C4H10) darstellt. Natürliches Butangas besteht hauptsächlich aus n-Butan. Das verzweigte Isomer Isobutan mit der Halbstrukturformel CH(CH3)3 wird auch als Methylpropan bezeichnet und kommt in der Natur wesentlich seltener vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
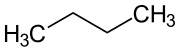 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Butan | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H10 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, fast geruchsloses Gas[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 58,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−0,5 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (61 mg·l−1 bei 20 °C)[3] | ||||||||||||||||||
| Dipolmoment |
0[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
2400 mg·m−3, 1000 ml·m−3[3] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Eigenschaften
Zusammenfassung
Kontext
Butan ist bei Raumtemperatur und Normaldruck gasförmig und hat einen Schmelzpunkt von −138 °C und einen Siedepunkt von −0,5 °C. Die molaren Enthalpien der entsprechenden Phasenübergänge betragen 4,66 kJ/mol (Schmelzen)[6] und 22,44 kJ/mol (Verdampfen)[7]. Der Tripelpunkt liegt bei (0,0067 hPa; −138,3 °C) und der kritische Punkt bei (37,96 bar; 152,0 °C).[3]
Der Dampfdruck bzw. Sättigungsdampfdruck von n-Butan in Abhängigkeit der Temperatur [8] lässt sich mit hinreichender Genauigkeit ( < 4 % im Bereich −20 °C bis 152 °C) nach folgender Gleichung (gemäß Geradengleichung[9] zwischen Siede- und kritischem Punkt) berechnen:
- .
Butan kristallisiert in der monoklinen Raumgruppe P21/c (Raumgruppen-Nr. 14)[10][11], ist schwerer als Luft und wirkt in hohen Konzentrationen narkotisierend bis erstickend.[3] In Wasser ist Butan nahezu unlöslich (90 mg/l).
Butan hat einen Flammpunkt von −60 °C und eine Zündtemperatur von 365 °C.
Der Explosionsbereich von n-Butan liegt in Luft zwischen der unteren Explosionsgrenze (UEG) von 1,4 Vol.-% (33 g·m−3) und der oberen Explosionsgrenze (OEG) von 9,4 Vol.-% (231 g·m−3).[3] Das Volumen ist als Normkubikmeter bei einer Temperatur von 0 °C und einem Druck von 101,325 kPa zu verstehen.[12]
Der Heizwert liegt bei 12,69 kWh·kg−1, dies entspricht 32,31 kWh·m−3.
Vorkommen
Butan ist ein sogenanntes Flüssiggas, das bei der Erdöldestillation anfällt. Es kommt im Erdöl und im Erdgas vor.[13]
Reaktionen
Unter idealen Bedingungen oxidiert Butan zu Kohlenstoffdioxid und Wasser.
Mit den Halogenen Fluor, Chlor und Brom reagiert Butan (zum Teil nur unter Einfluss von Licht) in einer Radikalkettenreaktion zur halogenierten Derivaten.[14]
Verwendung
Butan wird zur Herstellung von Buta-1,3-dien und Maleinsäureanhydrid und seit dem FCKW-Verbot als Treibgas in Sprays verwendet. Innerhalb der Europäischen Union ist es als Lebensmittelzusatzstoff E 943a zugelassen.[15] Im Gemisch mit wechselnden Anteilen Isobutan und / oder Propan wird Butan als Brenngas („Flüssiggas“) für Feuerzeuge[16] und Campingkocher verwendet.[17] Unter der Bezeichnung R600 dient es als Kältemittel für Kühlschränke, Klimaanlagen und ähnliche Anwendungen.[18]
Gebrauch als Droge
Butan wird als Droge verwendet. Die Wirkung ist mit ähnlichen Schnüffelstoffen zu vergleichen[19] und wird primär von Jugendlichen gesucht.[20][21] Beim Konsum kann es zu einer Sauerstoffunterversorgung kommen, da sich das dichtere Butan in der Lunge absetzt und somit das nutzbare Lungenvolumen abnimmt. Es kann zu Übelkeit, Erbrechen und im schlimmsten Fall zu erheblichen Hirnschädigungen führen. Lebensgefahr besteht bei Erhöhung des Gehirndrucks. Durch Senkung der Krampfschwelle kann die Krampfanfälligkeit gesteigert werden. Psychische Abhängigkeit ist möglich. In geschlossenen Räumen und Fahrzeugen kann es zudem zu einem hochexplosiven Gas-Luft-Gemisch kommen.[22]
Literatur
- Geert Oldenburg: Propan – Butan. Springer, Berlin 1955.
Weblinks
Wiktionary: Butan – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Commons: Butan – Sammlung von Bildern, Videos und Audiodateien
- Informationsblatt zu chemisch-physikalischen Eigenschaften der Flüssiggase Propan und Butan. (PDF; 349 KB) Deutscher Verband Flüssiggas e. V., Dezember 2022, abgerufen am 30. Juli 2024.
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





