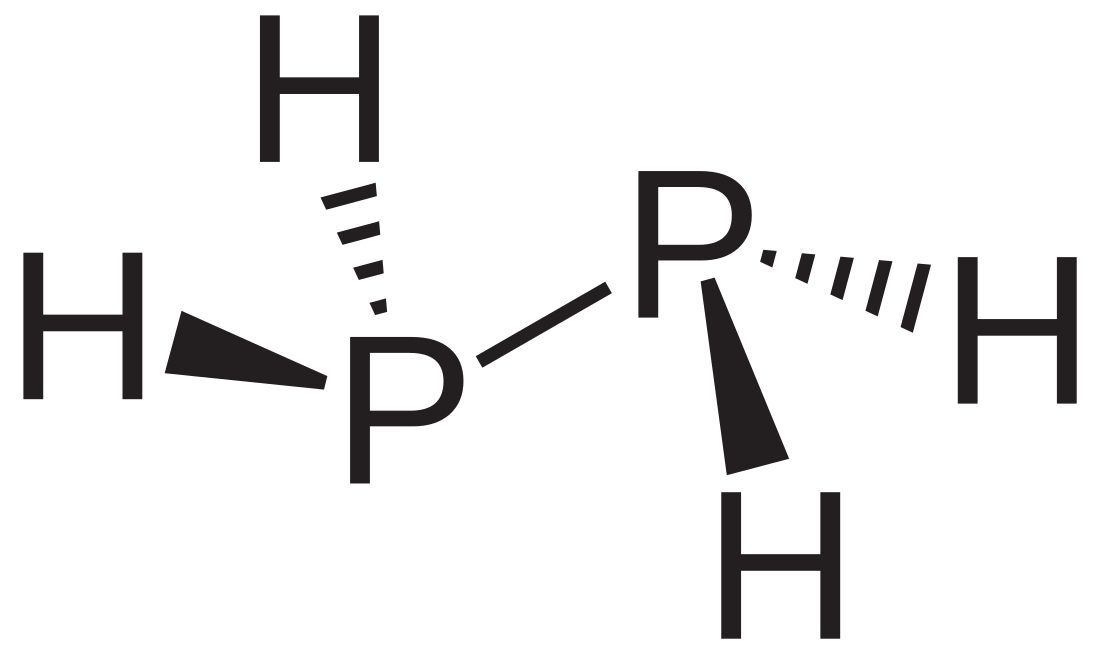
Diphosphan gehört zu den Phosphanen und ist ein binäres Phosphorhydrid mit der Summenformel P2H4. Oberhalb von −99 °C liegt es als farblose Flüssigkeit vor. An Luft ist es nicht stabil, sondern entzündet sich spontan. Zudem disproportioniert es bei Temperaturen oberhalb von −30 °C zu PH3 und höheren Phosphanen.[3] Es kommt häufig als Verunreinigung in kommerziell erhältlichem Monophosphan vor.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | Diphosphan | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | P2H4 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 65,98 g·mol−1 | |||||||||
| Schmelzpunkt |
−99 °C[1] | |||||||||
| Siedepunkt |
52 °C[1] | |||||||||
| Löslichkeit |
schlecht in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Herstellung
Diphosphan kann durch Hydrolyse von Calciummonophosphid (Ca2P2) gewonnen werden:
Dabei ergibt die Hydrolyse von 400 g Ca2P2 bei −30 °C etwa 20 g P2H4. Als Verunreinigung fallen weitere Phosphane an.[3]
Eigenschaften und Reaktionen
Diphosphan ist eine farblose, an der Luft selbstentzündliche Flüssigkeit, die sich in Gegenwart von Säurespuren, bei Temperaturen oberhalb von −10 °C (vor allem unter der Einwirkung des Lichtes) sowie an rauen Oberflächen zersetzt. Sie ist mischbar mit Kohlenstoffdisulfid, Pyridin, Kohlenwasserstoffen, Ethern, Diethylenglycolmonomethylether, Diethylenglykoldimethylether, Hexamethylphosphorsäuretriamid, und löslich in Methanol.[4] Sie liegt in Gauche-Konformation vor, mit einem P-P-Abstand von 2,219 Ångström. Das 1H NMR-Spektrum besteht aus 32 Linien aus der A2XX'A'2 Aufspaltung.[5]
Die Reaktion von Diphosphan mit Butyllithium führt zu verschiedenen kondensierten Polyphosphanen.[6]
Organische Diphosphane
Es sind verschiedene organische Derivate von Diphosphan bekannt. Dabei sind einige oder alle Wasserstoffatome durch Organylreste substituiert. Ihre Synthese erfolgt durch reduktive Kupplung z. B. aus Chlordiphenylphosphan:
Das Methylderivat P2Me4 erhält man durch Reaktion von Thiophosphoryltrichlorid mit Methylmagnesiumbromid.[7]
Quellen
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.