9-Hydroperoxy-10E,12Z-octadecadiensäure ist eine konjugierte Fettsäure mit einer Hydroperoxid-Funktion und kommt natürlich als biosynthetisches Intermediat vor, das aus Linolsäure gebildet und weiter zu Oxylipinen umgesetzt wird. Ein ebenfalls vorkommendes Isomer ist die 13-Hydroperoxy-9,11-octadecadiensäure. Auch Linolensäure bildet analoge Hydroperoxide.[2]
Schnelle Fakten Strukturformel, Allgemeines ...
| Strukturformel |
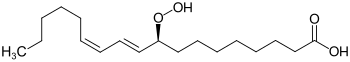 |
| (S)-Enantiomer |
| Allgemeines |
| Name |
9-Hydroperoxy-10,12-octadecadiensäure |
| Andere Namen |
- (10E,12Z)-9-Hydroperoxy-10,12-octadecadiensäure
- (R)-9-Hydroperoxy-trans-10,cis-12-octadecadiensäure
- (±)9-HPODE
- 9-LOOH
|
| Summenformel |
C18H32O4 |
| Externe Identifikatoren/Datenbanken |
|
|
| Eigenschaften |
| Molare Masse |
312,44 g·mol−1 |
| Sicherheitshinweise |
|
|
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). |
Schließen
9-Hydroperoxy-10-12-octadecadiensäure ist ein Intermediat bei verschiedenen biosynthetischen Prozessen in Pflanzen, insbesondere der Bildung von Oxylipinen.[3] Die Verbindung ist chiral und kommt natürlich vor allem als (S)-Enantiomer vor.[4] Beispielsweise bildet die Lipoxygenase aus Kartoffeln bevorzugt enenatiomerenreine (S)-9-Hydroperoxy-10-12-octadecadiensäure.[5] Die Lipoxygenase aus Tomaten bildet zu etwa 99 % das (S)-9-Hydroperoxid mit einem Enantiomerenüberschuss von etwa 82 %.[6] Demgegenüber bildet die Lipoxygenase aus Sojabohnen bevorzugt 13-Hydroperoxy-9,11-octadecadiensäure und in geringeren Mengen das 9-Isomer und dieses auch nicht enantiomerenrein, sondern zu etwa 73 % (S)-Konfiguration und zu 27 % (R)-Konfiguration.[5] Oxylipine, die aus der Verbindung gebildet werden, sind unter anderem Hydroxy-Verbindungen, Epoxyhydroxy-Verbindungen, Aldehyde, Ketone und Divinylether.[3][2]
Ein wichtiger Prozess, der über 9-Hydroperoxy-10-12-octadecadiensäure als Intermediat verläuft, ist die Biosynthese der Colnelsäure durch eine Divinylether-Synthase (z. B. in Tabak, Kartoffeln oder Tomaten).[3][4][7][8][9] Eine Hydroperoxid-Lyase kann die Verbindung in Aldehyde, (3Z)-Nonenal und 9-Oxononansäure, spalten. Dieser Reaktionsweg ist zum Beispiel in der Familie Cucurbitaceae verbreitet und die gebildeten Verbindungen sind wichtige Aromastoffe in Gurken und Melonen (Cucumis melo).[10][11][12] Auch 4-Hydroxy-2-nonenal wird in Pflanzen aus 9-Hydroperoxy-10,12-octadecadiensäure gebildet, wobei fast racemisches Produkt entsteht.[13]
Bei Grünen Pfirsichblattläusen auf Ackerbohnen wurde nachgewiesen, dass diese Oxylipine von den Pflanzen aufnehmen, darunter auch 9-Hydroperoxy-10-12-octadecadiensäure.[14]
Tabakpflanze
Kartoffelpflanze
Gurkenpflanze
Melonenpflanze
Grüne Pfirsichblattläuse
Die Verbindung wird durch eine Lipoxygenase aus Linolsäure gebildet. Die Reaktion läuft über einen antarafacialen Angriff eines enzymgebundenen Disauerstoffmoleküls und führt durch die Stereoselektivität zum (9S)-Isomer.[4][15] Linolsäure kann auch 13-Hydroperoxy-9,11-octadecadiensäure bilden. Manche pflanzlichen Enzyme bilden selektiv vorwiegend nur eines der beiden Positionsisomere, andere bilden beide.[4][2][7][15] Enzyme, die vor allem das 9-Isomer bilden, kommen zum Beispiel in Kartoffeln und Tomaten vor, solche, die beide Isomere bilden, z. B. in Stachelbeeren, Hefe und anderen Pilzen.[15][16]
Die Synthese aus Linolsäure mittels eines geeigneten Enzyms (z. B. aus Mais) ist auch im Labor möglich.[7] Die Regioselektivität hängt dabei stark vom pH ab. Bei pH 6,6 wird vor allem das 9-Isomer gebildet, bei pH 9 vor allem das 13-Isomer.[17]
Zum Nachweis werden Hydroperoxide wie 9-Hydroperoxy-10-12-octadecadiensäure vorzugsweise in stabilere Verbindungen überführt. Diese Verbindung kann konkret in Methyl-9-Hydroxystearat und dann deren Trimethylsilylether überführt werden und dieser durch GC-MS nachgewiesen werden.[18]
Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
T. V. Savchenko, O. M. Zastrijnaja, V. V. Klimov: Oxylipins and plant abiotic stress resistance. In: Biochemistry (Moscow). Band 79, Nr. 4, April 2014, S. 362–375, doi:10.1134/S0006297914040051. Tatyana Savchenko, Evgeny Degtyaryov, Yaroslav Radzyukevich, Vlada Buryak: Therapeutic Potential of Plant Oxylipins. In: International Journal of Molecular Sciences. Band 23, Nr. 23, 23. November 2022, S. 14627, doi:10.3390/ijms232314627, PMID 36498955, PMC 9741157 (freier Volltext). Ren Wang, Wenbiao Shen, Linglong Liu, Ling Jiang, Yuqiang Liu, Ning Su, Jianmin Wan: A novel lipoxygenase gene from developing rice seeds confers dual position specificity and responds to wounding and insect attack. In: Plant Molecular Biology. Band 66, Nr. 4, März 2008, S. 401–414, doi:10.1007/s11103-007-9278-0. Vladimir Nikolaev, Pallu Reddanna, Jay Whelan, George Hildenbrandt, C.Channa Reddy: Stereochemical nature of the products of linoleic acid oxidation catalyzed by lipoxygenases from potato and soybean. In: Biochemical and Biophysical Research Communications. Band 170, Nr. 2, Juli 1990, S. 491–496, doi:10.1016/0006-291X(90)92118-J. Catherine N.S.P. Suurmeijer, Manuela Pérez-Gilabert, Harry T.W.M. van der Hijden, Gerrit A. Veldink, Johannes F.G. Vliegenthart: Purification, product characterization and kinetic properties of soluble tomato lipoxygenase. In: Plant Physiology and Biochemistry. Band 36, Nr. 9, September 1998, S. 657–663, doi:10.1016/S0981-9428(98)80014-4. Vladimir Y Gorshkov, Yana Y Toporkova, Ivan D Tsers, Elena O Smirnova, Anna V Ogorodnikova, Natalia E Gogoleva, Olga I Parfirova, Olga E Petrova, Yuri V Gogolev: Differential modulation of the lipoxygenase cascade during typical and latent Pectobacterium atrosepticum infections. In: Annals of Botany. Band 129, Nr. 3, 11. Februar 2022, S. 271–286, doi:10.1093/aob/mcab108, PMID 34417794, PMC 8835645 (freier Volltext). E. J. Corey, Stephen W. Wright: Total synthesis of colneleic acid. In: The Journal of Organic Chemistry. Band 55, Nr. 5, März 1990, S. 1670–1673, doi:10.1021/jo00292a049. Payal Sanadhya, Anil Kumar, Patricia Bucki, Nathalia Fitoussi, Mira Carmeli-Weissberg, Menachem Borenstein, Sigal Brown-Miyara: Tomato Divinyl Ether-Biosynthesis Pathway Is Implicated in Modulating of Root-Knot Nematode Meloidogyne javanica's Parasitic Ability. In: Frontiers in Plant Science. Band 12, 25. August 2021, doi:10.3389/fpls.2021.670772, PMID 34512679, PMC 8424051 (freier Volltext). K Matsui, A Minami, E Hornung, H Shibata, K Kishimoto, V Ahnert, H Kindl, T Kajiwara, I Feussner: Biosynthesis of fatty acid derived aldehydes is induced upon mechanical wounding and its products show fungicidal activities in cucumber. In: Phytochemistry. Band 67, Nr. 7, April 2006, S. 649–657, doi:10.1016/j.phytochem.2006.01.006. Kenji Matsui, Chika Ujita, Sho-hei Fujimoto, Jack Wilkinson, Bill Hiatt, Vic Knauf, Tadahiko Kajiwara, Ivo Feussner: Fatty acid 9- and 13-hydroperoxide lyases from cucumber 1. In: FEBS Letters. Band 481, Nr. 2, 15. September 2000, S. 183–188, doi:10.1016/S0014-5793(00)01997-9. Nathalie Tijet, Claus Schneider, Bernard L. Muller, Alan R. Brash: Biogenesis of Volatile Aldehydes from Fatty Acid Hydroperoxides: Molecular Cloning of a Hydroperoxide Lyase (CYP74C) with Specificity for both the 9- and 13-Hydroperoxides of Linoleic and Linolenic Acids. In: Archives of Biochemistry and Biophysics. Band 386, Nr. 2, Februar 2001, S. 281–289, doi:10.1006/abbi.2000.2218. Claus Schneider, Keri A. Tallman, Ned A. Porter, Alan R. Brash: Two Distinct Pathways of Formation of 4-Hydroxynonenal. In: Journal of Biological Chemistry. Band 276, Nr. 24, Juni 2001, S. 20831–20838, doi:10.1074/jbc.M101821200. Nicolas Harmel, Pierre Delaplace, Elizabeth Blée, Patrick Du Jardin, Marie-Laure Fauconnier: Myzus persicae Sulzer aphid contains oxylipins that originate from phloem sap. In: Journal of Plant Interactions. Band 2, Nr. 1, März 2007, S. 31–40, doi:10.1080/17429140701320880. Leslie Crombie, David O. Morgan, Elisabeth H. Smith: An isotopic study (2H and 18O) of the enzymic conversion of linoleic acid into colneleic acid with carbon chain fracture: the origin of shorter chain aldehydes. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 3, 1991, S. 567, doi:10.1039/p19910000567. Barbara Bisakowski, Xavier Perraud, Selim Kermasha: Characterization of Hydroperoxides and Carbonyl Compounds Obtained by Lipoxygenase Extracts of Selected Microorganisms. In: Bioscience, Biotechnology, and Biochemistry. Band 61, Nr. 8, Januar 1997, S. 1262–1269, doi:10.1271/bbb.61.1262. G. A. Veldink, G. J. Garssen, J. F. G. Vliegenthart, J. Boldingh: Positional specificity of corn germ lipoxygenase as a function of pH. In: Biochemical and Biophysical Research Communications. Band 47, Nr. 1, April 1972, S. 22–26, doi:10.1016/S0006-291X(72)80004-4. C. E. Eriksson, Karin Leu: Gas chromatographic separation of linoleic acid hydroperoxides as trimethylsilyl ethers of methyl hydroxystearates. In: Lipids. Band 6, Nr. 2, Februar 1971, S. 144–146, doi:10.1007/BF02531332.





