Aryny, také nazývané benzyny, jsou reaktivní molekuly odvozené od molekul aromatických sloučenin odstraněním dvou substituentů. Nejčastěji se objevují ortho-aryny, mohou však také vznikat meta- a para-aryny.[1] Aryny patří mezi cykloalkyny.
o-Aryny, neboli 1,2-didehydroareny, mají, jako i ostatní cykloalkyny s menšími cykly, vysoké vnitřní napětí.[2]

Toto napětí vede ke snížení překryvu p orbitalů a tedy k oslabení trojné vazby.[3] Frekvence vibrací trojné vazby v benzynu odpovídá vlnočtu 1846 cm−1,[4] což naznačuje, že je trojná vazba slabší než by byla za nepřítomnosti vnitřního napětí. Ortho-benzyn je ovšem spíše cyklickým alkynem než biradikálem, což vyplývá z velkého rozdílu energií mezi singletovým a tripletovým stavem a reaktivity odpovídající alkynu.

LUMO arynu má mnohem nižší energii než LUMO alkynu, u kterého není silné vnitřní napětí, díky čemuž lépe interaguje s HOMO nukleofilů. Benzyn je díky tomu elektrofilem a dobře reaguje s nukleofily.[5] Podrobná analýza MO benzynu byla publikována v roce 1968.[6]

Vzhledem ke své vysoké reaktivitě musejí být aryny připravovány těsně před využitím. Je také třeba zabránit jeho dimerizaci.
Prvním známým způsobem přípravy byla dehydrohalogenace arylhalogenidů:

Tyto reakce probíhají při vysokých teplotách a za přítomnosti zásad. Ortho-disubstituované areny lze však použít i za mírnějších podmínek.
Další možností je dehalogenace 2-bromfluorbenzenu pomocí hořčíku.[7] Kyselina anthranilová může být pomocí diazotace následované neutralizací přeměněna na 2-diazoniobenzen-1-karboxylát. Tato zwitteriontová látka je výbušná,[8] ale přesto je vhodným prekurzorem benzynu.[9]

Jako výchozí látky lze také použít trimethylsilylaryltrifláty.[10] Odštěpení fluoridu z trifluormethylsulfonové akupiny vede k eliminaci triflátu a vzniku benzynu:

Pomocí hexadehydro Dielsovy–Alderovy reakce (cykloadiční reakce 1,3-diynu s alkynem) lze také získat benzyn.[11]

N-aminací 1H-benzotriazolu kyselinou hydroxylamin-O-sulfonovou vzniká produkt, který lze octanem olovičitým oxidovat na benzyn s téměř 100% výtěžností.[12]

Aryny jsou značně reaktivní i při nízkých teplotách. Jejich reaktivitu lze rozdělit do tří hlavních skupin: nukleofilní adice, pericyklické reakce a vložení vazby.
Nukleofilní adice na aryny
Za přítomnosti zásaditých nukleofilů se arylhalogenidy deprotonují v pozici alfa vzhledem k odcházející skupině, což vede k dehydrohalogenaci. Výsledky studií na základě výměny izotopů naznačují, že u arylfluoridů, a někdy i arylchloridů, probíhá eliminace ve dvou krocích, po deprotonaci dochází k odstranění nukleofilu; proces je tak podobný E1cB mechanismu u alifatických sloučenin. U bromarenů a jodarenů místo toho eliminace probíhá soustředěným synkoplanárním mechanismem.[13][14] Vzniklý benzyn vytváří adiční produkty, často nukleofilní adicí a následnou protonací. Tvorba benzynového meziproduktu je nejpomalejším krokem reakce.[15]

Pomocí „arynových párovacích reakcí“ se připravují bifenylové sloučeniny, používané při výrobě léčiv, v zemědělství a jako ligandy v řadě reakcí katalyzovaných kovy.[16]

Sloučeniny arenů s kovy mohou reagovat s dalšími aryny, což vede k řetězcové polymerizaci. Při použití kyanidu měďného jako iniciátoru adice prvního arynu mohou vznikat polymery obsahující kolem 100 arenových jednotek.[17]
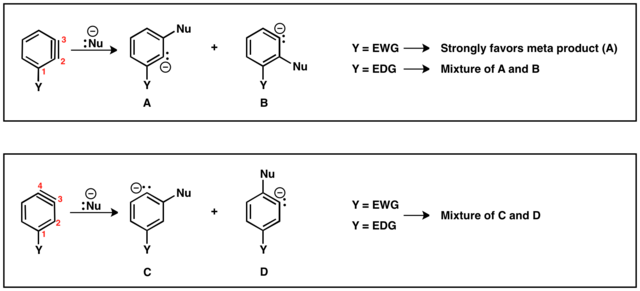
Když jsou odcházející skupina a substituent vůči sobě v poloze ortho nebo para, tak může vzniknout pouze jeden benzynový meziprodukt. Jsou-li v poloze meta, pak se mohou vytvořit dva různé produkty (A a B). Jestliže je substituentem skupina odtahující elektrony, tak HB je kyselejší než HA, což vede ke vzniku regioizomeru B. V případě, kdy je substituentem skupina dodávající elektrony, naopak vzniká regioizomer A, který má v tomto případě kyselejší proton.

Možné regioizomery jsou dva: trojná vazba může být mezi druhým (C2) a třetím uhlíkem (C3) nebo mezi C3 a C4. Substituenty v poloze ortho vůči odcházející skupině vytvoří trojnou vazbu mezi C2 a C3, zatímco substituenty v poloze para vyztvoří produkt s trojnou vazbou mezi C3 a C4. Z meta substituentů mohou vzniknout oba regioizomery.
Jestliže se trojná vazba nachází mezi C2 a C3, tak substituenty odtahující elektrony, jako je trifluormethyl (CF3), budou řídit nukleofilní adici tak, aby proběhla co nejblíže k substituentu. Naproti tomu substituenty dodávající elektrony, například methyl (CH3), budou vyvolávat jen velmi nízkou selektivitu produktů. V případech, kdy je trojná vazba mezi C3 a C4, je vliv substituentu na regioselektivitu minimální a často tak vznikají směsi obou možných produktů.[15]
Pericyklické reakce arynů
U benzynů probíhá rychlá dimerizace za vzniku bifenylenů. V některých případech tato reakce probíhá obzvlášť rychle a s velmi vysokou výtěžností.[9][12] Trimerizací se tvoří trifenyleny.[18]
Benzyny mohou podstoupit [4+2] cyklizace. Pokud reakce probíhá za přítomnosti antracenu, je produktem tryptycen.[7] Níže je znázorněn soustředěný mechanismus Dielsovy–Alderovy reakce benzynu s furanem. Jiné [4+2] cyklizační reakce arynů mohou probíhat postupným mechanismem.

Příkladem cyklizační reakce arynu může být příprava 1,2,3,4-tetrafenylnaftalenu.[19] 1,2,4,5-Tetrabrombenzen může reagovat s n-butyllithiem za tvorby tetrahydroanthracenu.[20]

[4+2] cykloadice arynů se často využívají při totálních syntézách přírodních látek. Hlavním omezením těchto postupů je nutnost použití dienů s menšími cykly, jako jsou furan a cyklopentadien.[10] V roce 2009 byl takovýmto způsobem připraven herbindol A.[21] 6,7-indolyn reaguje s cyklopentadienem za vzniku tetracyklického produktu.

Aryny také reagují s alkeny v [2+2] cykloadicích. Protože jsou benzyny elektrofily, tak jsou k takovým reakcím nejvhodnější alkeny se substituenty dodávajícími elektrony.[22]
Vzhledem k tvorbě významných množství vedlejších produktů se arynové [2+2] cykloadice málokdy používají při přípravách přírodních látek, existují ovšem i takovéto případy. V roce 1982 byla popsána syntéza taxodionu s využitím [2+2] cykloadice arynu s acetalem ketenu.[23]

Také je možné provést palladiem katalyzovanou [2+2+2] kocykloadici arynu a diynu při syntéze taiwaninu C.[24]

Připojení vazby na molekuly arynů
První případ reakce arynu vedoucí k připojení vazby sigma na molekulu byla příprava melleinu popsaná v roce 1973.[25]

Kromě 1,2-didehydrobenzenu (benzynu) existují také dva další izomery: 1,3-didehydrobenzen a 1,4-didehydrobenzen.[1] Pomocí výpočetní chemie bylo zjištěno, že jejich energie jsou 444, 510 a 577 kJ/mol.[26]

Byly zkoumány vzájemné přeměny 1,2-, 1,3- a 1,4-didehydrobenzenu.[26][27] Přeměna 1,2-didehydrobenzenu na 1,3-didehydrobenzen by měla probíhat při pyrolýze (za teploty 900 °C) fenylovaných prekurzorů arynů.[26] K přeměně jednoho arynu v jiný jsou potřeba velmi vysoké teploty.

1,4-didehydroareny
Při pokusech o přípravu 1,4-didehydrobenzenu, prováděných při teplotách okolo 300 °C, docházelo k vytvoření rovnováhy [1,6-D2]-As [3,2-D2]-B, ovšem nikoliv s C a D. Přesun atomů deuteria na B a skutečnost, že nedošlo ke vzniku C nebo D, lze vysvětlit pouze přítomností cyklického a symetrického meziproduktu–1,4-didehydrobenzenu.[28]

1,4-didehydrobenzen se může vyskytovat ve dvou stavech: singletovém a tripletovém, přičemž singletový má nižší energii.[29][30] Tripletový stav má dvě neinteragující radikálová centra, a tak může odštěpovat vodíky stejně dobře jako fenylový radikál. Singletový stav je však stabilnější, při tvorbě přechodného stavu při odštěpení vodíku tak dochází k určité ztrátě energie, zde tak takováto reakce probíhá pomaleji.
Mnoho přírodních látek se připravuje s využitím arenových meziproduktů.[10] Nukleofilní adice na aryny mají využití při úplných syntézách přírodních látek a jsou také jedněmi z nejstarších známých způsobu použití arynů.[10] Příklady látek syntetizovaných přes arynové meziprodukty jsou kryptaustolin (1) a kryptowolin (2).[31]

Při přípravě tetracyklického meroterpenoidu (+)-lifagalu také vzniká aryn.[32] Součástí je cyklizace vytvářející aryn, čímž vzniká poslední cyklická jednotka molekuly.[10]

Vícesložkovými reakcemi arenů lze účinně a rychle připravovat 1,2-disubsituované areny. Při syntézách přírodních látek se však využívají jen ojediněle.[10] Při syntéze dehydroaltenuenu B se využívá čtyřsložková párovací reakce arynu.[33]

V tomto článku byl použit překlad textu z článku Aryne na anglické Wikipedii.
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.