proteïna From Wikipedia, the free encyclopedia
L'hemoglobina (abreujada com a Hb o Hgb) és la proteïna que transporta l'oxigen i conté ferro. Es troba als glòbuls vermells dels vertebrats,[1] i als teixits d'alguns invertebrats.
 | |
| Substància química | família de complexos proteics |
|---|---|
| Estructura química | |
| Fórmula química | C₂₉₅₂H₄₆₆₄O₈₁₂₅S₈Fe₄₃₂₁ |
En mamífers, la proteïna constitueix aproximadament un 97% del contingut sec del glòbul vermell, i al voltant d'un 35% del contingut total (incloent-hi aigua). L'hemoglobina transporta oxigen des dels pulmons o brànquies fins a la resta del cos (i.e. els teixits) on allibera l'oxigen per a l'ús de les cèl·lules. També té més varietat de funcions transport de gas i modulació que varien d'espècie a espècie, i són bastant diversos en alguns invertebrats. Per exemple, l'hemoglobina transporta CO₂ de tornada des dels teixits fins als pulmons.
L'hemoglobina té una capacitat d'unió a l'oxigen d'entre 1.36 i 1.37 ml O₂ per gram d'hemoglobina,[2] que augmenta la capacitat de plegament d'oxigen total en sang setanta vegades.[3]
L'hemoglobina es troba als eritròcits incloent-hi les neurones d'A9 dopaminèrgic a la substància negra, macròfags, cèl·lules alveolars, i cèl·lules mesangials del ronyó. En aquests teixits, no té la funció de transportador d'oxigen, sinó que actua com a antioxidant i regulador del metabolisme del ferro.[4]
La proteïna transportadora d'oxigen hemoglobina va ser descoberta per Friedrich Ludwig Hünefeld el 1840.[5] El 1851,[6] Otto Funke publicava una sèrie d'articles en els quals descrivien creixement successiu de cristalls a l'hemoglobina que es diluïen als glòbuls vermells, amb un dissolvent com aigua pura, alcohol o èter, seguit per l'evaporació lenta del dissolvent des de la proteïna resultant de la solució.[7]
L'oxigenació reversible d'hemoglobina era descrita uns anys més tard per Felix Hoppe-Seyler.[8] El 1959 Max Perutz determinava l'estructura molecular de l'hemoglobina per cristal·lografia de raig X.[9][10] Aquesta feina va ser el resultat de la seva participació amb John Kendrew el Premi Nobel de 1962 en Química.
La funció de l'hemoglobina a la sang va ser descobert pel fisiòleg Claude Bernard. El nom de l'hemoglobina ve de la unió d'hemo i globina, reflectint el fet que cada subunitat d'hemoglobina és una proteïna globular amb un grup hemo integrat. Cada grup d'hemo conté un àtom de ferro, que pot lligar una molècula d'oxigen a través d'enllaços iònics. El tipus més freqüent d'hemoglobina als mamífers conté quatre d'aquestes subunitats.
Les seqüències d'hemoglobina difereixen entre espècies. Fins i tot dins d'una mateixa espècie, existeixen diferents variants d'hemoglobina. Per exemple, mutacions als gens de la proteïna hemoglobina en una espècie, és el resultat de variants d'hemoglobina,[11][12] algunes d'aquestes formes mutants d'hemoglobina causen un grup de malalties hereditàries anomenades hemoglobinopaties. La més coneguda és malaltia de les cèl·lules falciformes, que va ser la primera malaltia humana que es va entendre el seu mecanisme a nivell molecular. Un conjunt separat de malalties anomenades talassèmies impliquen una subproducció d'hemoglobina normal i a vegades hemoglobines anormals, durant problemes i mutacions en la regulació del gen de la globina. Totes aquestes malalties produeixen anèmia.[13]
Els estudis recents han suggerit variants genètiques en ratolins cérvol que explica com els ratolins cérvol que viuen a les muntanyes poden sobreviure en el poc aire que acompanya altituds altes. Una investigació de la Universitat de Lincoln a Nebraska va trobar mutacions a quatre gens diferents que poden explicar diferències entre ratolins cérvol que viuen en prats baixos i els que viuen a les muntanyes. Després d'examinar els ratolins salvatges capturats tant a altes com a baixes altituds, es trobava que els gens de les dues races són «virtualment idèntics exceptuant la capacitat de transportar oxigen de la seva hemoglobina». «La diferència genètica permet als ratolins de grans altituds fer un ús més eficaç del seu oxigen», ja que n'hi ha menys quantitat disponible, com els de les muntanyes.[14]
L'hemoglobina (Hb) se sintetitza per una sèrie complexa de passos. La part hemo se sintetitza en una sèrie de passos als mitocondris i al citosol dels glòbuls vermells immadurs, mentre que les parts de la proteïna globina són sintetitzades per ribosomes al citosol.[15] La producció de Hb continua a la cèl·lula durant el seu primer desenvolupament des del proeritroblast fins al reticulòcit a la medul·la òssia. En aquest punt, el nucli es perd als glòbuls vermells dels mamífers, però no en ocells i moltes altres espècies. Fins i tot després de la pèrdua del nucli als mamífers, el RNA ribosòmic residual permet la síntesi de Hb fins que el reticulòcit perdi el seu RNA després d'entrar a la vasculatura (aquesta hemoglobina sintetitzadora d'RNA dona al reticulòcit el nom i l'aparença de reticulat).
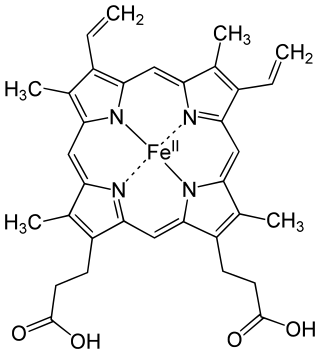
L'hemoglobina té les característiques de les dues estructures terciàries i quaternàries de les proteïnes. La majoria dels aminoàcids d'hemoglobina tenen forma d'hèlix alfa, connectades per segments no helicoïdals curts.[16] Els ponts d'hidrogen estabilitzen les seccions helicoïdals d'aquesta proteïna, provocant atraccions amb la molècula, plegant cada cadena polipeptídica d'una manera específica.[17] L'estructura quaternària d'hemoglobina ve donada per les seves quatre subunitats tetraèdricament.
En la majoria dels humans, la molècula d'hemoglobina és un conjunt de quatre subunitats de proteïna globulars. Cada subunitat es compon d'una cadena de proteïna lligada estretament a un grup d'hemo. Cada cadena de proteïna connecta un conjunt de segments estructurals d'hèlix d'alfa que estan units en un plegament de globina, anomenats així perquè és mateix plegament utilitzat en unes altres proteïnes d'hemoglobina com la mioglobina.[18][19] Aquest patró de plegament conté una cavitat que lliga fortament amb el grup hemo.
Un grup d'hemo consta d'un catió ferro (2+) (Fe2+) que s'aguanta en un anell heterocíclic, conegut com a porfirina. L'anell de porfirina consta de quatre molècules pirròliques cícliques connectades juntament amb l'ió ferro lligat al centre.[20] L'ió ferro, és el lloc d'unió amb l'oxigen (i.e. transporta l'oxigen i CO₂ per la sang), es coordina amb els quatre nitrògens en el centre de l'anell, tots estan en un únic pla. El ferro es lliga fortament a la proteïna globular mitjançant l'anell d'imidazole del residu F8 d'histidina sota l'anell de porfirina. Una sisena posició pot revertir l'oxigen lligat coordinant-se amb un enllaç covalent,[21] completant el grup d'octaèdric de sis lligands. La unió d'oxigen es fa amb una geometria «doblegada a l'extrem de sobre» on un àtom d'oxigen lliga Fe i altres sobresortint d'aquell angle. Quan no es lliga l'oxigen, una molècula d'aigua unida molt dèbilment omple el lloc, formant un octàedre distorsionat.
El ió ferro pot estar en l'estat Fe2+ o l'estat Fe3+, però ferrihemoglobina (methemoglobina) (Fe3+) no pot lligar oxigen.[22] Lligant, l'oxigen temporalment s'oxida (Fe2+) a (Fe2+), així el ferro ha d'existir en l'estat d'oxidació +2 per poder lligar oxigen. L'enzim metahemoglobina reductasa reactiva hemoglobina trobada en estat inactiu (Fe3+) reduint el centre de ferro.
En humans adults, el tipus d'hemoglobina més comú és un tetràmer (que conté 4 subunitats de proteïnes) anomenada hemoglobina A, consta de dues subunitats α i dues β fita no enllaçades covalentment, formades per 141 i 146 residus d'aminoàcids, respectivament. Això s'expressa com α₂β₂. Les subunitats són estructuralment similars i tenen la mateixa mida. Cada subunitat té un pes molecular d'aproximadament 17 000 daltons, per un pes molecular total del tetràmer de vora 68 000 daltons (64 458 g/mol).[23] 1 g/dL = 0,6206 mmol/L. L'hemoglobina A és la que s'estudia més intensament de les molècules d'hemoglobina.
La molècula d'hemoglobina està feta de 2 cadenes α i 2 cadenes γ. Les cadenes γ es canvien gradualment per cadenes β com quan creix un nen.[24]
Les quatre cadenes polipeptídiques estan unides per ponts salins, ponts d'hidrogen, i interaccions hidròfobes. Hi ha dues classes de connexions entre la cadena α i la β: α₁β₁ i α₁β₂.
En general, l'hemoglobina es pot saturar amb molècules d'oxigen (oxihemoglobina), o desaturar amb molècules d'oxigen (desoxihemoglobina).[25]
L'oxihemoglobina es forma durant respiració, quan l'oxigen es lliga al component hemo de la proteïna hemoglobina dels glòbuls vermells. Aquest procés ocorre als capil·lars pulmonars adjacents als alvèols pulmonars. L'oxigen viatja a través del corrent sanguini per ser portat a les cèl·lules on s'utilitza en la glucòlisi aeròbica i per la producció d'ATP amb el procés de fosforilació oxidativa. No ajuda, tanmateix, a contrarestar una disminució del pH de la sang. La ventilació, o respiració, pot invertir aquesta condició per eliminació del diòxid de carboni, així provocant un canvi augmentant el pH.[26]
La desoxihemoglobina és la forma d'hemoglobina sense oxigen unit. Els espectres d'absorció d'oxihemoglobina i desoxihemoglobina són diferents. L'oxihemoglobina té una absorció significativament més baixa 660nm de longitud d'ona, mentre que la desoxihemoglobina, la seva absorció és una mica més alta, 940 nm. Això explica el color vermell d'hemoglobina i el color blau de la desoxihemoglobina. Aquesta diferència s'utilitza per mesurar la quantitat d'oxigen a la sang dels pacients, amb un instrument anomenat pulsoxímetre.
Assignar l'oxigenació d'hemoglobina a un estat oxidat és difícil perquè l'oxihemoglobina (Hb-O₂), per mesures experimentals, és diamagnètic (cap parella d'electrons desaparellats), tot i així les baixes energies de les configuracions d'electrons tant en oxigen com en ferro són paramagnètics (suggerint com a mínim un electró desaparellat al complex). Les formes d'oxigen d'energia baixes i els dos estats d'oxidació de ferro, són aquests:
Totes aquestes estructures són paramagnètiques (tenen electrons desaparellats), no diamagnètics. Així, una distribució no intuïtiva d'electrons en la combinació del ferro i oxigen existeix, per explicar el diamagnetisme observat i cap electró desaparellat.
Les tres possibilitats lògiques per produir Hb-O₂ diamagnètic (cap spin net) són:
Dades experimentals directes:
Així, l'estat d'oxidació més proper del ferro a Hb-O₂ és l'estat de +3, amb oxigen en estat -1 (com superòxid. O₂-). El diamagnetisme en aquesta configuració sorgeix de l'electró desaparella del superòxid que s'alinea antiferromagnèticament des de l'electró desaparellat al ferro, per no donar cap spin net a la configuració sencera, d'acord amb l'experiment d'oxihemoglobina diamagnètica.[27]
La segona de les tres possibilitats lògiques pel diamagnetisme de l'oxihemoglobina, s'han mostrat certes en l'experiment: l'oxigen lliure (possibilitat 1) i les llargues separacions de càrregues (possibilitat 3) són els dos no favorables estats d'alta energia. El canvi del ferro a un estat d'oxidació més alt en Hb-O₂ disminueix la mida de l'àtom, i permet que entri al pla de l'anell de porfirina, estirant del residu d'histidina i iniciant els canvis al·lostèrics observats a les globulines.
Els primers postulats per químics bioinorgànics reclamaven que la possibilitat 1 (a dalt) era la correcta i aquell ferro hauria d'existir en l'estat d'oxidació II. Això semblava especialment probable des de l'estat d'oxidació de ferro III com methemoglobina, quan no estava acompanyat pel superòxid. O₂- per "aguantar" l'oxidació de l'electró, se sabia que la methemoglobina deixava incapaç hemoglobina de formar el triplet normal d'enllaços O₂ com passa a l'aire. Se suposava així que el ferro romania com Fe(II) quan el gas d'oxigen es lligava als pulmons. La química del ferro en aquest model anterior clàssic era elegant, però la presència exigida de l'oxigen diamagnètics d'energia alta exigit no estava explicada. Clàssicament se sostenia que la vinculació d'una molècula d'oxigen ocupava el lloc spin↑ Ferro(II) en un camp octaèdric de lligands forts; aquest canvi dels camps augmentaria l'energia de separació dels cristalls del camp, que provoca l'aparellament dels electrons de ferro dins la configuració d'espín ↓, que seria diamagnètic en Fe(II). Es creu en efecte que aquest aparellament forçat d'espín ↓ passa al ferro quan lliga a l'oxigen, però no és suficient per explicar el canvi de mida del ferro. Es necessita l'extracció d'un electró addicional del ferro per l'oxigen, ja que explica tant la mida més petita del ferro com l'observació d'un increment de l'estat d'oxidació, i el lligam més dèbil d'oxigen.
Ens hauríem de fixar que l'assignació d'un estat d'oxidació de nombre sencer és un formalisme, ja que els enllaços covalents no exigeixen ordres d'enllaços perfectes que impliquen transferir un electró totalment. Així, els tres models per a Hb-O₂ paramagnètic poden contribuir en algun grau (per ressonància) a la configuració electrònica real de l'Hb-O₂. Tanmateix, el model de ferro Hb-O₂ que és Fe(III) és més correcte que la idea clàssica que romangui en Fe(II).
A més a més del lligand d'oxigen que lliga l'hemoglobina d'una manera cooperativa, els lligands d'hemoglobina també inclouen inhibidors competitius com monòxid de carboni (CO) i lligands al·lostèrics com diòxid de carboni (CO₂).
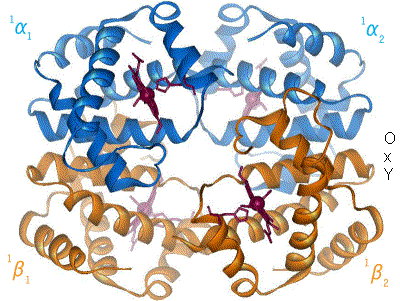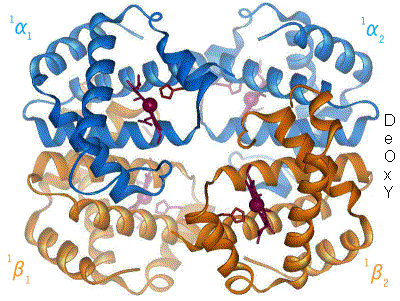
Un model visual esquemàtic del procés que lliga a l'oxigen, mostrant els quatre monòmers i hemos, i cadenes de proteïna només com diagrama, per facilitar la visualització de la molècula. L'oxigen no es mostra en aquest model, però per a cada un dels àtoms de ferro aquest uneix al ferro (esfera vermella) al pla de l'hemo. Per exemple, a l'esquerra superior dels quatre grups hemos, l'oxigen s'uneix a l'esquerra de l'àtom de ferro mostrat a l'esquerra superior del diagrama. Això provoca que l'àtom de ferro es mogui endarrere cap a l'hemo que l'està aguantant, arrossega el residu d'histidina (pentàgon vermell a la dreta del ferro) més proper, com ell fa. I al seu temps, estira de la cadena de proteïna que té la histidina.
Una altra vista de com la unió dels lligands provoca un canvi conformacional (estructural) a hemoglobina. Només es mostra un dels quatre grups hemo, però més electrons de la cadena de proteïnes s'inclou en aquest diagrama, en comparació amb el de damunt. La unió i l'alliberació d'oxigen (color verd) il·lustra les diferències estructurals entre oxi- i desoxihemoglobina, respectivament. La histidina que és estirada pel moviment de l'àtom de ferro, es mostra en groc.
Quan l'oxigen s'uneix al complex de ferro, provoca que l'àtom de ferro s'enretiri cap al centre del pla de l'anell de porfirina (vegi diagrama que es mou). Al mateix temps, la cadena del costat de l'imidazole del residu d'histidina que interacciona amb l'altre pol del ferro s'estira cap a l'anell de porfirina. Aquesta interacció de forces de l'anell del costat de fora del tetràmer, provoca una pressió en l'hèlix de proteïna que conté la histidina a mesura que es mou més a prop de l'àtom de ferro. Aquesta pressió es transmet als tres monòmers restants del tetràmer on provoca un canvi conformacional similar als altres llocs del grup hemo de tal manera que la unió amb l'oxigen en aquests llocs és més fàcil.
En la forma tetramèrica d'hemoglobina d'un adult normal, la unió d'oxigen és un procés cooperatiu. La unió d'afinitat de l'hemoglobina amb l'oxigen augmenta amb la saturació de la molècula d'oxigen, amb la primera lligam d'oxígens influeix la forma dels llocs d'unió per als pròxims oxígens, de manera favorable per lligar. Aquesta unió cooperativa positiva s'aconsegueix completament mitjançant canvis conformacionals del complex de la proteïna hemoglobina com hem explicat a dalt, i.e. quan una subunitat de la proteïna hemoglobina s'oxigena, provoca un canvi conformacional o estructural de tot el complex, fent que les altres subunitats tinguin més afinitat amb l'oxigen. Com a conseqüència, la corba d'unió de l'oxigen a l'hemoglobina és sigmoïdal, (forma de S), en contra de la corba hiperbòlica normal associada amb la unió no cooperativa.
La capacitat d'unió d'oxigen de l'hemoglobina es veu disminuïda en presència de monòxid de carboni perquè els dos gasos competeixen pels mateixos llocs d'unió en l'hemoglobina. El monòxid de carboni encaixa preferentment al lloc de l'oxigen, el grup hemo.
La unió amb l'oxigen es veu afectada per molècules com monòxid de carboni (CO) (per exemple: fumar de tabac, tub d'escapament de cotxes i combustió incompleta dels forns). L'afinitat de l'hemoglobina per unir-se al CO és 200 vegades millor que l'afinitat per l'oxigen,[28] això significa que les quantitats petites de CO redueixen dramàticament l'habilitat de l'hemoglobina per transportar oxigen. Quan l'hemoglobina es combina amb CO, forma un compost vermell molt brillant anomenat carboxihemoglobina, que pot fer que la pell de víctimes per intoxicació de CO sembli rosa quan es moren, en comptes de blanc o blau. Quan inspirem, l'aire conté nivells de CO tan baixos com un 0,02%, provoquen el mal de cap i nàusees; si la concentració augmenta fins a un 0,1%, la inconsciència seguirà. En grans fumadors, fins a un 20% dels llocs actius d'oxigen poden estar bloquejats per CO.
De manera similar, l'hemoglobina també té una unió amb afinitat competitiva amb el cianur (CN-), monòxid de sofre (SO), diòxid de nitrogen (NO₂), i sulfur (S2-), incloent-hi sulfur d'hidrogen (H₂S). Tots aquests uneixen el ferro al grup hemo sense canviar el seu estat d'oxidació, però no obstant això inhibeixen la unió amb l'oxigen, provocant una toxicitat greu.
L'àtom de ferro del grup d'hemo ha d'estar inicialment en l'estat d'oxidació ferrós (Fe2+) per suportar l'oxigen i la unió d'altres gasos i per transportar (temporalment es canvia a fèrric durant el temps d'unió amb l'oxigen, com hem explicat a dalt). L'oxidació inicial a l'estat d'oxidació fèrric (Fe3+) sense oxigen converteix l'hemoglobina en "hemiglobina" o methemoglobina (pronunciat "MET-hemoglobina"), que no pot unir oxigen. L'hemoglobina en els glòbuls vermells normals és protegida per un sistema de reducció per impedir que això passi. El diòxid de nitrogen i l'òxid nitrós són capaços de convertir una fracció petita d'hemoglobina en methemoglobina; tanmateix, això no té importància mèdica (el diòxid de nitrogen és verinós per uns altres mecanismes, i l'òxid nitrós s'utilitza rutinàriament en l'anestèsia quirúrgica en moltes persones que no produeixen methemoglobina excessivament).
El diòxid de carboni ocupa un lloc d'unió diferent en l'hemoglobina. El diòxid de carboni es dissol més immediatament en sang desoxigenada, facilitant el seu trasllat des del cos després que l'oxigen s'hagi alliberat als teixits sotmesos al metabolisme. Aquest augment de l'afinitat amb el diòxid de carboni a prop de la sang venosa es coneix com l'efecte Haldane. A través de l'enzim anhidrasa carbònica, el diòxid de carboni reacciona amb aigua per cedir àcid carbònic, que es descompon en anions hidrogencarbonat i cations oxoni:
CO₂ + H₂O → H₂CO₃ → HCO₃- + H+

Per això la sang amb nivells de diòxid de carboni elevats és més baixa en pH (més àcida). L'hemoglobina pot unir a protons i diòxid de carboni que provoquen un canvi conformacional a la proteïna i facilita l'alliberament d'oxigen. Els protons s'uneixen a diversos llocs de la proteïna, mentre el diòxid de carboni s'uneix al grup α-amino. El diòxid de Carboni s'uneix a l'hemoglobina i forma carbaminohemoglobina.[29] Aquesta disminució en l'afinitat de l'hemoglobina per l'oxigen, unint-se a diòxid de carboni i àcid es coneix com l'efecte Bohr (canvis de la corba de saturació d'O₂ cap a la dreta). Al contrari, quan disminueixen els nivells de diòxid de carboni a la sang (i.e., en els capil·lars de pulmons), el diòxid de carboni i protons s'alliberen de l'hemoglobina, augmentant l'afinitat de la proteïna per l'oxigen.
L'hemoglobina necessita alliberar l'oxigen que uneix perquè si no, no hi ha cap punt d'unió amb això. La corba sigmoïdal de l'hemoglobina ho fa eficaç agafant (agafant O₂ als pulmons), i deixant (O₂ als teixits).[30]
En gent aclimatada a altituds altes, la concentració de 2,3-Bisfosfoglicerat (2,3-BPG) a la sang augmenta, la qual cosa permet a aquests individus repartir una quantitat més gran d'oxigen als teixits sota condicions de tensió d'oxigen més baixa. Aquest fenomen, on la molècula Y afecta la unió de la molècula X a una molècula de transport Z, s'anomena un efecte al·lostèric heterotròpic.
Una variant de l'hemoglobina, anomenada hemoglobina fetal (HbF, α₂γ₂), es troba als fetus que estan en desenvolupament, i uneix l'oxigen amb més afinitat que l'hemoglobina adulta. Això significa que la corba d'unió d'oxigen per l'hemoglobina fetal varia a l'esquerra (i.e., un percentatge més alt d'hemoglobina fa lligar l'oxigen amb una tensió d'oxigen menor), en comparació amb l'hemoglobina adulta. Com a resultat, la sang fetal de la placenta pot agafar oxigen de la sang materna.
L'hemoglobina també porta monòxid de nitrogen, NO, en la part de la molècula que hi ha la globina. Això millora l'alliberació d'oxigen a la perifèria i contribueix al control de la respiració. El NO lliga de manera reversible a un residu de cisteïna específic; la unió depèn de l'estat (R o T) de l'hemoglobina. L'hemoglobina S-nitrosilada que en resulta influeix a diverses activitats NO relacionades com el control de resistència vascular, pressió arterial i respiració. NO és alliberat al citoplasma d'eritròcits, però és transportat per un intercanviador d'anió anomenat AE1.[31]
S'ha realitzat un estudi per examinar la influència de la forma de l'hemoglobina (Hb) sobre el mètode de partició de compostos orgànics volàtils inhalats (VOCs) a sang [humana i animal]. El benzè era el prototip VOC utilitzat en les investigacions per a aquesta recerca a causa de les propietats similars que comparteix amb molts altres VOCs. Específicament, aquest estudi analitza la influència de la solubilitat d'aigua de l'Hb sobre el coeficient de partició (PC) d'un VOC en comparació amb la influència de l'"espècie" o forma d'Hb. Les diferents formes de sang utilitzades inclouen: hemoglobina humana (HbA), Hb de rata, i hemoglobina de cèl·lules falciformes (HbS). L'Hb de la rata conté poca aigua i està en una forma quasi cristal·lina, trobada dins els glòbuls vermells (RBC), significa que són més hidrofòbiques que Hb-humana que és soluble en aigua. L'hemoglobina de les cèl·lules de falciformes (HbS) és soluble en aigua però es pot convertir en insoluble a l'aigua, formant polímers hidròfobs, quan es desoxigena. Els descobriments manifesten que el PC de benzè per la Hb de rata és molt més alt que l'Hb humana, tanmateix; les proves que mesuren els PCs de les formes oxigenades i desoxigenades d'HbA i HbS no diferien massa, indicant que l'afinitat del benzè no es veia afectada per la solubilitat de l'aigua de l'Hb.[32]
Variants d'hemoglobina són part del desenvolupament normal de l'embrió i del fetus, però també hi poden haver mutacions patològiques de les diferents formes d'hemoglobina en la població, causades per variacions en els gens. Algunes variants de l'hemoglobina molt conegudes, com ara l'anèmia de cèl·lules falciformes, són responsables de malalties i per tant són considerades com hemoglobinopaties. D'altres variants causen patologies no detectables, i per tant es consideren variants no patològiques.[12][33]
En l'embrió:
En el fetus:
En els adults:
Formes variants que provoquen malalties:
Quan els glòbuls vermells arriben al final de la seva vida degut a l'envelliment o a defectes, s'acaben destruint. La molècula d'hemoglobina, doncs, és destruïda però el grup hemo és reciclat. Quan l'anell de porfirina es trenca, els fragments solen ser excretats en la bilis del fetge. Aquest procés, a més, produeix una molècula de monòxid de carboni per cada molècula hemo degradada.[34] Aquesta és una de les poques fonts naturals de producció de monòxid de carboni en l'organisme humà, i és responsable de les quantitats normals de monòxid de carboni en sang inclòs en persones que respiren aire pur. L'altre producte final majoritari durant la degradació d'un grup hemo és la bilirubina. Nivells elevats d'aquesta substància química són detectats en la sang si els glòbuls vermells són destruïts més ràpidament del que tocaria. L'hemoglobina (en forma proteica o no) mal degradada i que ha sigut alliberada de les cèl·lules sanguínies massa ràpidament pot obstruir petits vasos sanguinis i sobretot la sang delicada que filtra pels ronyons; causant danys als ronyons.
La deficiència d'hemoglobina pot ser causada ja sigui per una disminució de les molècules d'hemoglobina (com succeeix en l'anèmia) o per una disminució de l'habilitat de cada molècula per unir-se a l'oxigen a una mateixa pressió parcial d'oxigen. Les hemoglobinopaties (defectes genètics resultants de l'estructura anormal de la molècula d'hemoglobina) poden causar les dues. En qualsevol cas, una deficiència de l'hemoglobina disminueix la capacitat de transportar oxigen de la sang. Una disminució de l'hemoglobina està, generalment, estrictament distingida de la hipoxèmia, definida com una disminució de la pressió parcial de l'oxigen en la sang, tot i que ambdues són causes d'hipòxia (subministrament insuficient d'oxigen als teixits).
Altres causes comunes perquè hi hagi una baixa quantitat d'hemoglobina són: pèrdua de sang, deficiència nutricional, problemes de la medul·la òssia, quimioteràpia, insuficiència renal o hemoglobina anormal (com en el cas de la malaltia de l'anèmia falciforme).
Nivells elevats d'hemoglobina poden ser causats per una exposició a elevades altituds, fumar, deshidratació o tumors.[24]
L'habilitat de cada molècula d'hemoglobina per transportar oxigen és modificada normalment per un PH de la sang alterat o pel CO₂, que provoca que la corba de dissociació de l'oxihemoglobina estigui alterada. De totes maneres, també pot ser alterada patològicament en, per exemple, enverinament per monòxid de carboni.
Una disminució de l'hemoglobina, amb disminució absoluta de glòbuls vermells o sense, té els símptomes d'una anèmia. L'anèmia té diferents causes, tot i que la deficiència de ferro i la seva resultant anèmia per deficiència de ferro són les causes més comunes en el món occidental. Donat que l'absència de ferro provoca una deficient síntesi de grups hemo, les cèl·lules sanguínies en una anèmia per deficiència de ferro són hipocròmiques (els falta el pigment de color vermell típic de l'hemoglobina) i microcítiques (són més petites del normal). Altres tipus d'anèmia són menys comuns. En l'hemòlisi (destrucció accelerada de cèl·lules sanguínies), la icterícia associada és causada per la bilirubina (un metabòlic de l'hemoglobina), i l'hemoglobina circulant pot causar insuficiència renal. Algunes mutacions en la cadena de globina estan associades a les hemoglobinopaties, com la malaltia de l'anèmia falciforme i la talassèmia. Altres mutacions, com les discutides al principi de l'article, són benignes i són tractades simplement com a variants de l'hemoglobina.
Hi ha un grup de trastorns genètics, coneguts amb el nom de porfíries que es caracteritzen per errors en les rutes metabòliques durant la síntesi de grups hemo. Jordi III, rei del Regne Unit, és considerat el pacient de porfíria més famós.
En menor mesura, l'hemoglobina A es combina lentament amb la glucosa a la seva valina terminal (un aminoàcid alfa) de cada cadena ß. La molècula resultant es denomina sovint com HbA1c. A mesura que la concentració de glucosa en sang augmenta, el percentatge d'Hb A que es converteix en HbA1c augmenta. En els pacients diabètics, la glucosa dels quals és normalment alta, el percentatge de HbA1c també és elevat. Degut a la lentitud de la combinació de l'Hb A amb la glucosa, el percentatge de HbA1c ens permet deduir el nivell mitjà de glucosa després d'un temps llarg (la mitjana de vida dels glòbuls vermells, que és típicament d'entre 50 i 55 dies). L'hemoglobina glicosilada és la forma de l'hemoglobina a la que s'hi ha unit una glucosa. La glucosa resta unida a l'hemoglobina durant tota la vida del glòbul vermell, que és d'aproximadament 120 dies.
Els nivells d'hemoglobina glicosilada són investigats per supervisar el control a llarg termini de la malaltia crònica de la diabetis mellitus de tipus 2 (T2DM o DMT2). Un control deficient del T2DM deriva en nivells elevats d'hemoglobina glicosilada en els glòbuls vermells. El rang normal és d'aproximadament de 4% a 5,9%. I tot i que són difícils d'obtenir, les persones que tenen diabetis de tipus 2 han d'intentar aconseguir uns valors inferiors al 7%. Els nivells més alts del 9% estan associats amb un control deficient de l'hemoglobina glicosilada, i els nivells superiors al 12% s'associen amb un control molt deficient. Els pacients diabètics que mantenen els seus nivells d'hemoglobina glicosilada en nivells pròxims al 7% tenen moltes més probabilitats d'evitar les complicacions que sovint acompanyen la diabetis (en relació amb aquells pacients diabètics que tenen uns nivells del 8% o més).
Es van dur a terme investigacions per identificar l'efecte de dos programes d'entrenament diferents (un d'ells combinava l'exercici aerobi i de resistència mentre que en l'altre únicament s'utilitzava l'exercici aerobi) en els nivells d'hemoglobina glicosilada de pacients amb T2DM. El control general de la glucosa en aquesta investigació va ser mesurat com a hemoglobina glicosilada (HbA o A). L'efecte de combinar exercicis de resistència amb exercicis aerobis va millorar més el control de la glucosa que en els exercicis únicament aerobis. L'efecte mitjana dels programes d'entrenament van incloure una reducció del 0,8% de l'hemoglobina glicosilada que és un resultat similar al dels pacients que van ser sotmesos durant un llarg període a una dieta i una medicació controlada o a tractaments amb insulina.
Nivells elevats d'hemoglobina són associats amb l'augment de nombre o mida dels glòbuls vermells, aquest fet rep el nom de policitèmia. Aquest augment pot ser provocat per una malaltia cardíaca congènita, fibrosi pulmonar, massa eritropoesina o policitèmia vera.[35]
Una de les dades que més es vigila quan es demana una analítica és la concentració d'hemoglobina en sang. Per exemple, es té molt en compte aquesta dada quan es fan donacions de sang. Els resultats es donen en g/L, g/dL o mol/L. 1g/dL equival a 0,6206 mmol/L. Els nivells normals són els següents:
Els valors d'hemoglobina normals durant el primer i tercer trimestre d'embaràs han de ser, com a mínim, d'11 g/dL, i de 10,5 g/dL durant el segon trimestre. Si la concentració està per sota de la normal, s'anomena anèmia. Les anèmies es classifiquen segons la mida dels glòbuls vermells, que són les cèl·lules que contenen hemoglobina en els animals vertebrats. L'anèmia s'anomena “microcítica” si els glòbuls vermells són petits, i “macrocítica” si són grans; en el cas que la mida sigui normal s'anomenarà “normocítica”.
L'hematòcrit (la proporció de volum sanguini ocupada pels glòbuls vermells) és típicament tres vegades més el nivell d'hemoglobina. Per exemple, si al mesurar l'hemoglobina trobem un resultat de 17, el d'hematòcrit serà de 51.[38]
El control a llarg termini de la concentració de sucre en sang pot ser mesurada per la concentració de HbA1c. Mesurar-ho directament requeriria diverses mostres de sang donat que els nivells de sucre en sang varien molt al llarg del dia. L'HbA1c és un producte en una reacció irreversible on l'hemoglobina A es combina amb la glucosa. Una concentració elevada de glucosa deriva en una gran quantitat de HbA1c. Com que la reacció és lenta, la proporció de HbA1c representa el nivell mitjà de glucosa a la sang durant la mitjana de vida dels glòbuls vermells (que típicament és de 50 a 55 dies). Una proporció d'HbA1c que s'acosta, o és inferior, al 6% representa un bon control a llarg termini de la concentració de glucosa a la sang, els valors que són propers i principalment més grans del 7% impliquen un mal control. Aquest test és especialment útil per a persones que pateixen diabetis.
En l'àmbit de la ressonància magnètica funcional (o fMRI), la màquina utilitza el senyal obtingut de la desoxihemoglobina (que és sensible als camps magnètics).
Existeix una àmplia varietat de formes de transportar l'oxigen i de proteïnes d'unió en els diferents organismes de tot el regne animal i vegetal. Alguns organismes incloent els dels regnes dels bacteris, els protozous i els fongs tots tenen proteïnes similars a l'hemoglobina de les quals s'ha predit i se'n coneixen els papers. Entre elles es troba la unió reversible a lligands gasosos. Ja que moltes d'aquestes proteïnes contenen globines i la fracció hemo (que consisteix en un suport de porfirina pla), sovint se les anomena hemoglobines, tot i que la seva estructura terciària és molt diferent a la de l'hemoglobina dels vertebrats. De fet, distingir entre “miohemoglobina” i hemoglobina en els animals inferiors sovint és impossible, ja que alguns d'aquests organismes no tenen músculs. O tenen sistema circulatori separat que no pot fer front al transport d'oxigen (com succeeix, per exemple, amb molts insectes i alguns artròpodes). En tots aquests grups, l'hemo/globina conté molècules (fins i tot les globines monomèriques) que poden fer front a unions amb gasos; i és per aquest motiu que s'utilitza el nom d'hemoglobina. A més, per fer front al transport i detecció d'oxigen, també han de tractar amb el NO, el CO₂, components de sulfur i la compactació d'oxigen en ambients que poden ser anaeròbics. Fins i tot poden fer front a la desintoxicació de compostos clorats d'una forma anàloga als enzims P450 i peroxidases que contenen grups hemo.

L'estructura de l'hemoglobina varia segons les espècies. L'hemoglobina està present en tots els regnes d'organismes, però no en tots els organismes. Les espècies primitives, com ara els bacteris, protozous, algues i algunes plantes; sovint tenen només hemoglobines d'una sola globina. Alguns nematodes, mol·luscs i crustacis contenen llargues multisubunitats moleculars, molt més llargues que les que podríem trobar en els vertebrats. En particular, en els fongs i en anèl·lids gegants es van trobar hemoglobines quimèriques que poden contenir tant globina com altres tipus de proteïnes.
Un dels esdeveniments i usos més sorprenents de l'hemoglobina en els organismes és en el cuc de tub gegant (Riftia Pachyptilam, també coneguda com a Vestimentifera) que pot arribar a mesurar 2,4 metres de llargada i té la capacitat de viure en els respiradors volcànics dels oceans. En comptes d'un tracte digestiu, aquests cucs contenen una població de bacteris que constitueixen la meitat del seu pes. El bacteri reacciona amb l'H₂S del respirador i l'oxigen de l'aigua per produir energia per crear menjar a partir de l'H₂ O i del CO₂. En la seva part final, els cucs tenen una estructura de color vermell fosc que té una forma semblant a un vano (i rep el nom de plomall). Aquesta estructura s'estén fins a l'interior de l'aigua i absorbeix H₂S i O₂ pel bacteri, i CO₂ per utilitzar-la com a matèria primera sintètica similar a les plantes fotosintètiques. Les estructures tenen un color vermell brillant a causa del fet que contenen diverses hemoglobines extraordinàriament complexes que tenen fins a 144 cadenes de globina, i podem deduir que cadascuna d'elles contindrà estructures hemo associades. Aquestes hemoglobines són importants i remarcables, ja que tenen la capacitat de transportar oxigen fins i tot en presència de sulfur, i fins i tot de transportar sulfur sense ser “enverinades” completament o inhibides (tal com els hagués succeït a les hemoglobines d'altres espècies).[39][40]
Mioglobina: es troba en el teixit muscular de molts vertebrats, inclosos els humans, dona al teixit muscular un color vermell o gris fosc. És molt similar a l'hemoglobina quant a estructura i seqüència, però no és un tetràmer; sinó un monòmer al que li falten unions cooperatives. És utilitzat per emmagatzemar oxigen més que per transportar-lo.
Hemocianina: és el segon transportador d'oxigen més comú a la natura, es pot trobar en la sang d'alguns artròpodes i mol·luscs. Utilitza com a grup prostètic el coure en comptes del ferro que sí que utilitzen els grups hemo i és blau quan està oxigenat.
Hemeritrina: alguns invertebrats marins i unes poques espècies d'anèl·lids utilitzen aquesta proteïna que conté ferro per transportar oxigen cap a la seva sang (cal remarcar que aquesta proteïna no conté grups hemo). Té una aparença rosa o violeta quan està oxigenada, i té un color clar quan no ho està.
Clorocruorina: es troba en els anèl·lids i és molt similar a l'eritrocruorina, però el grup hemo és significativament diferent pel que fa a la seva estructura. Quan està oxigenada és de color vermell però quan està desoxigenada té un color verdós.
Vanabins: es troba en la sang d'alguns organismes marins (tot i que són poques espècies) i es creu que utilitzen el vanadi (un metall molt rar) per la unió de l'oxigen al seu grup prostètic.
Eritrocruorina: es troba en molts anèl·lids, incloent els cucs de terra, és una proteïna molt gran que flota lliurement per la sang i que conté diverses dotzenes (o fins i tot pot contenir centenars) grups de ferro i hemo. Aquestes subunitats proteiques estan unides formant un complex proteic simple amb una massa molecular superior a 3.5 milions de daltons.
Pinablobina: únicament s'ha trobat en el mol·lusc Pinna squamosa. És una porfirina de color blau basada en el manganès.
Leghemoglobina: s'ha trobat en les plantes lleguminoses, com l'alfals i la soja.
Alguns eritròcits contenen hemoglobina. En el cervell, això inclou les neurones A9 dopaminèrgiques de la substància negra, els astròcits en el còrtex cerebral i l'hipocamp, i en tots els oligodendròcits madurs. S'ha suggerit que l'hemoglobina cerebral en aquestes cèl·lules deu permetre “l'emmagatzematge d'oxigen per proporcionar mecanismes homeostàtics en condicions d'anòxia, fet que és bastant important per les neurones A9DA que tenen un elevat metabolisme amb un gran requeriment per la producció d'energia”. A més, s'ha observat que “les neurones A9 dopaminèrgiques podent patir un gran risc, ja que, degut la seva elevada activitat mitocondrial, es troben en situacions d'intens estrès oxidatiu produït per la producció de peròxid d'hidrogen per la via de l'autooxidació”. Això pot explicar el risc de les cèl·lules degut a la degeneració que pateixen en malalties com el Parkinson. La presència de ferro en l'hemoglobina d'aquestes cèl·lules deriva en el color fosc que tenen post-mortem (i del qual s'ha extret el nom llatí de “negra” (referint-se a la substància negra).
Fora del cervell, l'hemoglobina no té funcions pel que fa al transport d'oxigen sinó com un antioxidant i un regulador del metabolisme del ferro in els macròfags,[41] cèl·lules alveolars[42] i cèl·lules del ronyó.[43]


Històricament el color de la sang estava associat amb el rovell, tal com els Romans de l'Antiguitat ho associaven al color del planeta Mart i amb el Déu de la guerra (ja que Mart té un color taronja vermellós). El color de Mart es deu al ferro i l'oxigen en el terra Marcià, però el vermell de la sang no es deu al ferro dintre de l'hemoglobina o els seus òxids (que és una confusió molt comuna). El vermell es deu a la fracció de porfirina de l'hemoglobina en la qual el ferro està unit; no pel ferro en si mateix, tot i que la lligadura i l'estat redox del ferro poden influir en les transicions electròniques del pi fins al pi* de la porfirina i, evidentment, en les seves característiques visuals.
L'artista Julian Voss-Andreae va crear una escultura anomenada “Heart of Steel (Hemoglobina)” (que vol dir “Cor de ferro”) el 2005, basada en la columna vertebral de les proteïnes. L'escultura estava feta de vidre i d'acer desgastat. Es va realitzar un rovell intencional a l'obra, que inicialment brillava. Aquest fet representa la reacció química fonamental de l'hemoglobina, és a dir, l'oxigen que s'uneix al ferro.[44]
Per acabar, el grup de rock anomenat Placebo va gravar una cançó anomenada “Haemoglobin”.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.