molècula de naturalesa proteica que catalitza reaccions químiques From Wikipedia, the free encyclopedia
Els enzims són substàncies orgàniques, gairebé sempre de natura proteica, que acceleren reaccions químiques.[1] Els enzims interaccionen amb molècules de partida (substrats) i catalitzen la seva transformació en altres de diferents (productes). Intervenen amb un paper important en gairebé tots els processos cel·lulars. Com que tenen un alt grau de selectivitat respecte al seu substrat i cadascun d'ells catalitza unes reaccions molt concretes, el conjunt d'enzims que es produeixen en una cèl·lula determina les rutes metabòliques que s'hi poden dur a terme.

Igual que tots els catalitzadors, els enzims redueixen l'energia d'activació (Ea o ΔG‡) d'una reacció i, d'aquesta manera, n'augmenten molt la velocitat. Els enzims no són consumits per les reaccions que catalitzen ni n'alteren l'equilibri químic. Tanmateix, es diferencien d'altres catalitzadors per la seva alta especificitat. Se sap que els enzims catalitzen unes 4.000 reaccions bioquímiques.[2] Algunes molècules d'ARN anomenades ribozims també catalitzen reaccions; algunes parts del ribosoma en són un exemple important.[3] Els enzims artificials són molècules sintètiques que també tenen propietats catalítiques semblants a les dels enzims.[4]
Hi ha altres molècules que poden afectar l'activitat dels enzims. Els inhibidors redueixen l'activitat enzimàtica, mentre que els activadors l'augmenten. Molts medicaments i verins són inhibidors enzimàtics. L'activitat dels enzims també varia segons la temperatura, el medi químic (p. ex., el pH) i la concentració del substrat. Alguns enzims tenen aplicacions comercials, com ara la síntesi d'antibiòtics. A més a més, alguns productes de neteja utilitzen enzims per a catalitzar reaccions bioquímiques. Per exemple, els enzims dels detergents desfan les taques de proteïnes o greix de la roba, mentre que els enzims dels entendridors de carn fragmenten les proteïnes i fan que la carn sigui més fàcil de mastegar.

A finals del segle xviii i principis del XIX ja es coneixien la digestió de la carn per mitjà de secrecions estomacals[5] i la conversió del midó en sucres mitjançant extractes vegetals i saliva, però no s'havia identificat el mecanisme pel qual es produïen aquests fenòmens.[6]
Al segle xix, Louis Pasteur estudià la fermentació de sucres en alcohol pel llevat i conclogué que era catalitzada per una força vital continguda a les cèl·lules del llevat, anomenada «ferment», que es creia que només funcionava en organismes vivents. Escrigué: «la fermentació de l'alcohol és un procés relacionat amb la vida i l'organització de les cèl·lules del llevat, no amb la mort o putrefacció de les cèl·lules».[7]
El 1878, el fisiòleg alemany Wilhelm Kühne encunyà el mot «enzim», que prové del grec ἔνζυμον ('en el llevat'), per a descriure aquest procés. Posteriorment, aquesta paraula fou utilitzada per a referir-se a substàncies no vivents com ara la pepsina, mentre que «ferment» es feu servir en referència a l'activitat química produïda pels organismes vivents.
El 1897, Eduard Buchner començà a estudiar la capacitat per a fermentar sucre d'uns extractes de llevat sense cèl·lules vivents. En una sèrie d'experiments a la Universitat de Berlín, descobrí que el sucre es fermentava fins i tot quan no hi havia cèl·lules de llevat vivents a la mescla.[8] Donà el nom de «zimasa» a l'enzim que havia causat la fermentació de la sucrosa.[9] El 1907, rebé el Premi Nobel de Química «per la seva investigació en bioquímica i el seu descobriment de la fermentació acel·lular». Seguint l'exemple de Buchner, els enzims se solen anomenar segons la reacció que catalitzen. Generalment s'afegeix el sufix «-asa» al nom dels substrats (p. ex., la lactasa és l'enzim que descompon la lactosa) o el tipus de reacció (p. ex., l'ADN polimerasa forma polímers d'ADN).
Havent quedat demostrat que els enzims podien funcionar a l'exterior d'una cèl·lula vivent, el pas següent era determinar-ne la naturalesa bioquímica. Molts dels primers investigadors remarcaren que l'activitat enzimàtica estava associada amb les proteïnes, però alguns científics (com ara el premi Nobel Richard Willstätter) argumentaven que les proteïnes eren simplement portadores dels enzims autèntics i que per elles soles no eren capaces de dur a terme la catàlisi. Tanmateix, el 1926, James B. Sumner demostrà que l'enzim ureasa era proteïna pura i el cristal·litzà; Summer feu el mateix amb l'enzim catalasa el 1937. La conclusió que les proteïnes poden ser enzims queda demostrada definitivament per Northrop i Stanley, que treballaren en els enzims digestius pepsina (1930), tripsina i quimotripsina. Aquests tres científics foren guardonats amb el Premi Nobel de Química del 1946.[10]
El descobriment que els enzims podien cristal·litzar-se finalment permeté determinar-ne l'estructura per mitjà de difracció de rajos X. Això es feu per primer cop amb el lisozim, un enzim que es troba en les llàgrimes, la saliva i la clara dels ous que digereix les parets cel·lulars d'alguns bacteris; la seva estructura fou determinada per un grup encapçalat per David Chilton Phillips i publicada el 1965.[11] Aquesta determinació de l'estructura del lisozim a alta resolució marca el principi del camp de la biologia estructural i l'esforç per esbrinar com funcionen els enzims a nivell atòmic.

En general, els enzims són proteïnes globulars. La seva mida va des de només 62 residus d'aminoàcids, en el cas del monòmer de 4-oxalocrotonat tautomerasa,[12] fins a més de 2.500 residus en l'àcid gras sintasa.[13] Existeix un nombre petit de catalitzadors de base ARN, i el més comú és el ribosoma; reben el nom d'«enzims ARN» o «ribozims». L'activitat dels enzims és determinada per la seva estructura tridimensional.[14] Tanmateix, encara no s'ha aconseguit predir l'activitat de nous enzims a partir de la seva estructura.[15]
La majoria d'enzims són més grossos que els substrats sobre els quals actuen, i només una petita part de l'enzim (aproximadament 3-4 aminoàcids) participa directament en la catàlisi.[16] La regió que conté aquests residus catalítics, s'adhereix al substrat, i després duu a terme la reacció és coneguda com a «zona activa». Els enzims també poden tenir zones que s'adhereixen a cofactors, que són necessaris per a la catàlisi. Alguns enzims també tenen zones d'adherència a petites molècules, que sovint són productes directes o indirectes, o substrats de la reacció catalitzada. Aquesta adherència pot servir per augmentar o reduir l'activitat de l'enzim, cosa que possibilita una regulació realimentada.
Com totes les proteïnes, els enzims es formen com a llargues cadenes lineals d'aminoàcids que es pleguen per produir un producte tridimensional. Cada seqüència d'aminoàcid produeix una estructura específica, amb les seves propietats particulars. A vegades, poden agrupar-se cadenes proteíniques individuals per formar un complex proteic. La majoria d'enzims poden ser desnaturalitzats —és a dir, desplegats i desactivats— per mitjà de desnaturalitzants calorífics o químics, que destrueixen l'estructura tridimensional de la proteïna. Segons l'enzim de què es tracti, la desnaturalització pot ser reversible o irreversible.
Els enzims són generalment molt específics quant a les reaccions que catalitzen i els substrats que estan implicats en aquestes reaccions. La forma complementària, la càrrega i les característiques hidròfiles/hidròfobes dels enzims i els substrats són les responsables d'aquesta especificitat. Els enzims també poden presentar nivells importants d'estereoespecificitat, regioselectivitat i quimioselectivitat.[17]
Alguns dels enzims més específics i precisos són els que estan implicats en la còpia i expressió del genoma. Aquests enzims tenen mecanismes de «control de qualitat». Un enzim com ara l'ADN polimerasa catalitza una reacció en una primera fase, i després verifica que el producte sigui correcte en una segona fase.[18] Aquest procés bifàsic resulta en una proporció mitjana d'error de menys d'un error per cada cent milions de reaccions, en el cas de polimerases mamiferoides d'alta fidelitat.[19] També hi ha mecanismes de control similars a l'ARN polimerasa,[20] les aminoacil ARNt sintetases[21] i els ribosomes.[22]
Alguns enzims productors de metabòlits secundaris són descrits com a promiscus, car poden actuar sobre una varietat relativament àmplia de substrats diferents. S'ha suggerit que aquesta especificitat de substrat àmplia és important per l'evolució de noves rutes biosintètiques.[23]
Els enzims són molt específics, i Emil Fischer suggerí el 1894 que això era perquè tant l'enzim com el substrat tenen formes geomètriques específiques complementàries que encaixen exactament l'una amb l'altra.[24] Això és denominat sovint «model pany i clau». Tanmateix, mentre que aquest model explica l'especificitat dels enzims, no explica l'estabilització de l'estat de transició que assoleixen els enzims. S'ha demostrat que el model pany i clau és incorrecte. El model d'acoblament induït és la figura enzim-substrat-coenzim més acceptada actualment.

El 1958, Daniel Koshland suggerí una modificació del model pany i clau; com que els enzims són estructures bastant flexibles, la zona activa canvia de forma constantment a causa de les interaccions amb el substrat, a mesura que el substrat interacciona amb l'enzim.[25] Com a resultat, el substrat no s'uneix simplement a una zona activa rígida, sinó que les cadenes laterals d'aminoàcids que formen la zona activa són modelades en les posicions precises que permeten a l'enzim executar la seva funció catalítica. En alguns casos, com el de les glicosidases, la molècula del substrat també canvia lleugerament de forma quan entra a la zona activa.[26] La zona activa continua canviant fins que el substrat està completament unit, moment en què queden determinades la forma i la càrrega finals.[27]
Els enzims poden actuar de diferents formes, totes les quals redueixen la ΔG‡:[28]
És interessant remarcar que aquest efecte entròpic implica una desestabilització de l'estat fonamental,[29] i la seva contribució a la catàlisi és relativament minsa.[30]
La comprensió de l'origen de la reducció de ΔG‡ exigeix que se sàpiga com estabilitzen els enzims el seu estat de transició més que l'estat de transició de la reacció no catalitzada. Aparentment, el mètode més eficient d'assolir una gran estabilització és l'ús d'efectes electroestàtics, en particular creant un medi polar relativament fix orientat vers la distribució de càrrega de l'estat de transició.[31] No existeix un tal ambient a la reacció no catalitzada en aigua.
La dinàmica interna d'un enzim està relacionada amb el seu mecanisme de catalític.[32][33][34] La dinàmica interna és el moviment de les parts internes d'un enzim, com ara residus d'aminoàcids, grups d'aminoàcids o fins i tot un domini proteic sencer. Aquests moviments es produeixen a diverses escales temporals que van de femtosegons a segons. Les xarxes de residus proteics dins l'estructura d'un enzim poden contribuir a la catàlisi per moviments dinàmics.[35][36][37][38] Els moviments proteics són vitals per molts enzims, però la importància relativa de les vibracions petites i ràpides, o els moviments conformacionals més grans i lents, depèn del tipus de reacció. Tanmateix, tot i que aquests moviments són importants en la unió i l'alliberament de substrats i productes, no està clar si els moviments proteics contribueixen a accelerar els passos químics a les reaccions enzimàtiques.[39] Aquests nous coneixements també tenen implicacions en la comprensió dels efectes al·lostèrics i el desenvolupament de nous medicaments.
Els enzims al·lostèrics canvien la seva estructura en resposta a la unió amb efectors. La modulació pot ser directa, quan l'efector s'uneix directament a punts d'unió de l'enzim, o indirecta, quan l'efector s'uneix a altres proteïnes o subunitats de proteïnes que interaccionen amb l'enzim al·lostèric i per tant influeixen l'activitat catalítica.
Alguns enzims no requereixen cap component addicional per executar plenament la seva activitat. En canvi, n'hi ha d'altres que per actuar requereixen la unió amb molècules no proteiques anomenades «cofactors».[40] Els cofactors poden ser o bé compostos inorgànics (ex., ions de metalls o centres de ferro-sofre) o bé orgànics (ex., flavina i hemo). Els cofactors orgànics poden ser o bé grups prostètics, que són units fermament a un enzim, o coenzims, que són alliberats de la zona activa de l'enzim durant la reacció. Els coenzims inclouen NADH, NADPH i el trifosfat d'adenosina. Aquestes molècules actuen transferint grups químics entre els enzims.[41]
Un exemple d'enzim que conté un cofactor és l'anhidrasa carbònica, que es mostra al diagrama de cintes anterior amb un cofactor de zinc unit com a part de la zona activa.[42] Aquestes molècules fermament unides solen trobar-se a la zona activa i participen en la catàlisi. Per exemple, els cofactors flavina i hemo solen participar en reaccions redox.
Els enzims que requereixen un cofactor però que no el tenen unit reben el nom d'apoenzims o apoproteïnes. Un apoenzim junt amb el seu o els seus cofactors rep el nom d'holoenzim (la forma activa). La majoria de cofactors no estan enllaçats de manera covalent a un enzim, però estan units molt fermament. Tanmateix, els grups prostètics orgànics poden ser units de manera covalent (ex., el tiamina pirofosfat en l'enzim piruvat deshidrogenasa). El terme holoenzim també es pot aplicar a enzims que contenen múltiples subunitats proteiques, com ara les ADN polimerases; en aquest cas, l'holoenzim és el complex complet que conté totes les subunitats necessàries per a l'activitat.

Els coenzims són petites molècules orgàniques que transporten grups químics d'un enzim a un altre.[43] Algunes d'aquestes substàncies químiques, com ara la riboflavina, la tiamina i l'àcid fòlic, són vitamines, o compostos que no es poden sintetitzar al cos i s'han d'obtenir amb els aliments. Els grups químics transportats inclouen l'ió d'hidrur (H-) transportat per NAD o NADP+, el grup acetil transportat pel coenzim A, els grups formil, metenil o metil transportats per l'àcid fòlic i el grup metil transportat per l'S-adenosilmetionina.
Com que els coenzims canvien químicament a conseqüència de l'acció enzimàtica, és útil considerar que els coenzims són una classe especial de substrats, o segons substrats, que són comuns a molts enzims diferents. Per exemple, es coneixen uns 700 enzims que utilitzen el coenzim NADH.[44]
Els coenzims solen ser regenerats, i les seves concentracions mantingudes a un nivell estable dins la cèl·lula; per exemple, NADPH és regenerat per la ruta del pentosa-fosfat i l'S-adenosilmetionina és regenerada per la metionina adenosiltransferasa.

Com tots els catalitzadors, els enzims no alteren la posició de l'equilibri químic de la reacció. Habitualment, en presència d'un enzim, la reacció transcorre en la mateixa direcció que ho faria sense l'enzim, simplement més ràpid. Tanmateix, en absència de l'enzim, altres possibles reaccions «espontànies» no catalitzades poden crear productes diferents, car en aquestes condicions aquest producte diferent és format més ràpidament.
A més, els enzims poden acoblar dues o més reaccions, de manera que una reacció termodinàmicament favorable pot ser utilitzada per a alimentar-ne una de termodinàmicament desfavorable. Per exemple, la hidròlisi de l'ATP és sovint utilitzada per alimentar altres reaccions químiques.
Els enzims catalitzen de manera igual les reaccions normals i les inverses. No alteren l'equilibri en si, només la velocitat a la qual s'assoleix. Per exemple, l'anhidrasa carbònica catalitza la seva reacció en qualsevol de les dues direccions segons la concentració dels seus reactants.
Tanmateix, si l'equilibri està molt desplaçat en una direcció, és a dir, en una reacció molt exergònica, la reacció és efectivament irreversible. En aquestes condicions, l'enzim només catalitzarà la reacció en la direcció permesa per la termodinàmica.

La cinètica enzimàtica és la investigació de com els enzims s'uneixen a substrats i els transformen en productes. Les dades de velocitat utilitzades en les anàlisis cinètiques són obtingudes d'assajos enzimàtics.
El 1902, Victor Henri[45] proposà una teoria quantitativa de la cinètica enzimàtica, però les seves dades experimentals no resultaren útils car la importància de la concentració d'ions d'hidrogen encara no era apreciada. Després que Peter Lauritz Sørensen definís l'escala logarítmica del pH i introduís el concepte d'emmagatzematge el 1909[46] el químic alemany Leonor Michaelis i la investigadora postdoctoral canadenca Maud Leonora Menten repetiren els experiments d'Henri i confirmaren la seva equació, que és denominada cinètica d'Henri-Michaelis-Menten (a voltes també cinètica de Michaelis-Menten).[47] La seva obra fou continuada per George Edward Briggs i John Burdon Sanderson Haldane, que derivaren equacions cinètiques que encara són usades àmpliament avui en dia.[48]
La contribució principal d'Henri fou pensar en les reaccions enzimàtiques de dues etapes. A la primera, el substrat s'uneix reversiblement a l'enzim, formant el complex enzim-substrat. A vegades s'anomena això complex de Michaelis. Aleshores, l'enzim catalitza el pas químic de la reacció i allibera el producte.
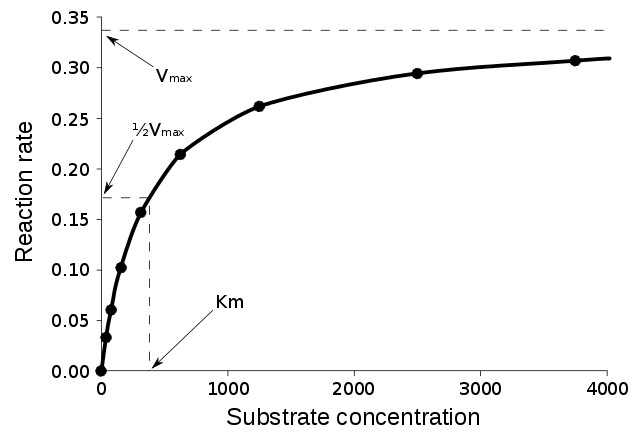
Els enzims poden catalitzar fins a diversos milions de reaccions per segon. Per exemple, la reacció catalitzada per l'orotidina 5'-fosfat descarboxilasa consumeix la meitat del substrat en 78 milions d'anys si no hi ha cap enzim present. Tanmateix, quan s'afegeix la descarboxilasa, el mateix procés només triga 25 mil·lisegons.[49] La velocitat d'un enzim depèn de les condicions de la solució i de la concentració del substrat. Les condicions que desnaturalitzen la proteïna eliminen l'activitat enzimàtica, com ara temperatures elevades, un pH extrem o altes concentracions de sal, mentre que l'augmentació de la concentració del substrat tendeix a augmentar l'activitat. Per determinar la velocitat màxima d'una reacció enzimàtica, s'augmenta la concentració del substrat fins que s'observa una velocitat constant de formació del producte. La corba de saturació de la dreta mostra això. La saturació es produeix perquè, a mesura que augmenta la concentració del substrat, una part cada cop més important de l'enzim lliure és transformada en la forma ES unida al substrat. A la velocitat màxima (Vmax) de l'enzim, totes les zones actives de l'enzim estan unides al substrats, i la quantitat de complex ES és la mateixa que la quantitat total d'enzim. Tanmateix, Vmax només és una de les constants cinètiques dels enzims. La quantitat de substrat necessària per assolir una determinada velocitat de reacció també és important. Això és determinat per la constant de Michaelis-Menten (Km), que és la concentració del substrat necessària perquè un enzim assoleixi la meitat de la seva velocitat màxima. Cada enzimé una Km característica per un substrat donat, i això pot mostrar com és de ferma la unió del substrat a l'enzim. Una altra constant útil és kcat, que és el nombre de molècules de substrat que porta una zona activa per segon.
L'eficiència d'un enzim es pot expressar en termes de kcat/Km. Això també rep el nom de constant d'especificitat i incorpora la constant de velocitat de cada pas de la reacció. Com que la constant d'especificitat reflecteix tant l'afinitat com la capacitat catalítica, és útil per comparar enzims diferents entre ells, o el mateix enzim amb diferents substrats. El màxim teòric de la constant d'especificitat rep el nom de límit de difusió i és d'aproximadament 108 to 10⁹ (M−1 s−1). En aquest punt, cada col·lisió de l'enzim amb el seu substrat resultarà en catàlisi, i la velocitat de formació del producte no està limitada per la velocitat de reacció sinó per la velocitat de difusió. Els enzims amb aquestes propietats són considerats «catalíticament perfectes» o «cinèticament perfectes». En són exemples la triosa-fosfat isomerasa, l'anhidrasa carbònica, l'acetilcolinesterasa, la catalasa, la fumarasa, la β-lactamasa, i la superòxid dismutasa.
La cinètica de Michaelis-Menten es basa en la llei de masses, que deriva de les assumpcions de difusió lliure i col·lisions aleatòries impulsades termodinàmicament. Tanmateix, molts processos bioquímics o cel·lulars es desvien significativament d'aquestes condicions, a causa d'apinyament molecular, separació en fases de l'enzim/substrat/producte, o moviment molecular mono o bidimensional.[50] En aquestes situacions, es pot aplicar una cinètica de Michaelis-Menten fractal.[51][52][53][54]
Alguns enzims funcionen amb una cinètica més ràpida que la velocitat de difusió, cosa que semblaria impossible. S'han suggerit diversos mecanismes per explicar aquest fenomen. Es creu que algunes proteïnes acceleren la catàlisi agafant el seu substrat i preorientant-lo per mitjà de camps elèctrics dipolars. Altres models apel·len a una explicació basada en una tunelització mecanicoquàntica, segons la qual un protó o un electró pot travessar barreres d'activació, tot i que en el cas de la tunelització de protons el model roman bastant controvertit.[55][56] S'ha observat tunelització de protons en la triptamina.[57] Això suggereix que la catàlisi enzimàtica es podria descriure amb més precisió com «a través» de la barrera en lloc del model tradicional, que requereix que el substrat passi «per sobre» d'una barrera energètica abaixada.


La velocitat de reacció dels enzims pot ser reduïda per diversos tipus d'inhibidors enzimàtics.
En la inhibició competitiva, l'inhibidor i el substrat competeixen per l'enzim (és a dir, no poden unir-s'hi els dos alhora). Sovint, els inhibidors competitius s'assemblen molt al substrat autèntic de l'enzim. Per exemple, el metotrexat és un inhibidor competitiu de l'enzim dihidrofolat reductasa, que catalitza la reducció del dihidrofolat en tetrahidrofolat. La semblança entre l'estructura de l'àcid fòlic la d'aquest medicament és mostrada a la figura inferior de la dreta. Cal remarcar que no és necessari que la unió de l'inhibidor es produeixi al punt d'unió del substrat (com sovint s'afirma), si la unió de l'enzim canvia la conformació d'aquest per evitar la unió amb el substrat, i a l'inrevés. En la inhibició competitiva, la velocitat màxima de la reacció no canvia, però calen concentracions de substrat més altes per assolir una determinada velocitat, augmentant la Km aparent.
En la inhibició incompetitiva, l'inhibidor no pot unir-se a l'enzim lliure, sinó únicament al complex ES. El complex EIS format per aquest procés és enzimàticament inactiu. Aquest tipus d'inhibició és rar, però es pot produir en enzims multimèrics.
Els inhibidors no competitius poden unir-se a l'enzim al mateix temps que el substrat, és a dir, mai no s'uneixen a la zona activa. Tant els complexos EI com els EIS són enzimàticament inactius. Com que l'inhibidor no pot ser expulsat de l'enzim per una concentració més alta de substrat (a diferència de la inhibició competitiva), la Vmax aparent canvia. Tanmateix, com que el substrat encara es pot unir a l'enzim, la Km roman igual.
Aquest tipus d'inhibicó s'assembla a la no competitiva, excepte que el complex EIS té una activitat enzimàtica residual.
En molts organismes, els inhibidors poden formar part d'un mecanisme de retroalimentació. Si un enzim produeix una quantitat excessiva d'una substància, aquesta substància pot actuar com a inhibidor de l'enzim al principi de la ruta que la produeix, causant l'alentiment o l'aturada de la producció de la substància quan n'hi ha una quantitat suficient. Es tracta d'una forma de retroalimentació negativa. Els enzims subjectes a aquesta forma de regulació sovint són multimèrics i tenen punts d'unió al·lostèrics per les substàncies reguladores. La seva funció substrat/velocitat no és hiperbòlica, sinó sigmoïdal (amb forma de S).

Els inhibidors irreversibles reaccionen amb l'enzim i formen un adducte covalent amb la proteïna. La inactivació és irreversible. Aquests compostos inclouen l'eflornitina, un medicament utilitzat per tractar la malaltia del son, causada per paràsits.[59] La penicil·lina i l'aspirina també actuen d'aquesta manera. En aquests medicaments, el compost s'uneix a la zona activa i l'enzim converteix l'inhibidor en una forma activada que reacciona irreversiblement amb un o diversos residus d'aminoàcids.
Els inhibidors són utilitzats sovint com a medicaments, però també poden actuar com a verins. Tanmateix, la diferència entre medicament i verí sovint no és més que una qüestió de quantitat, car la majoria de medicaments són verinosos a un cert nivell, com ho escrigué Paracels: «totes les substàncies són verins; és la dosi correcta la que diferencia un verí d'un remei».[60] D'igual manera, els antibiòtics i altres medicaments contra les infeccions només són verins específics que maten un patogen, però no el seu hoste.
Un exemple d'inactivador utilitzat com a medicament és l'aspirina, que inhibeix els enzims COX-1 i COX-2, que produeixen el missatger d'inflamació prostaglandina, eliminant així el dolor i la inflamació. El cianur, un verí, és un inactivador enzimàtic irreversible que es combina amb el coure i el ferro de la zona activa de l'enzim citocrom c oxidasa i bloqueja la respiració cel·lular.[61]
Els enzims tenen una àmplia varietat de funcions a l'interior dels éssers vius. Són indispensables per la transducció de senyals i la regulació cel·lular, sovint per mitjà de cinases i fosfatases.[62] També generen moviment, amb la miosina que hidrolitza ATP per generar contracció muscular i mou productes dins la cèl·lula com a part del citoesquelet.[63] Altres ATPases de la membrana cel·lular són bombes iòniques implicades en el transport actiu. Els enzims també estan implicats en funcions més exòtiques, com ara la luciferasa, que genera llum en les cuques de llum.[64] Els virus també poden contenir enzims per la infecció de cèl·lules, com ara la VIH integrasa i la transcriptasa inversa, o per l'alliberament del virus de les cèl·lules, com ara la neuraminidasa del virus de la grip.
Una de les funcions més importants dels enzims és en l'aparell digestiu dels animals. Enzims com ara les amilases i proteases descomponen les molècules grans (midó o proteïnes, respectivament) en molècules més petites, de manera que els intestins les puguin absorbir. Les molècules de midó, per exemple, són massa grans per ser absorbides per l'intestí, però els enzims hidrolitzen les cadenes de midó en molècules més petites com ara maltosa i finalment glucosa, que poden ser absorbides. Enzims diferents digereixen aliments diferents. En els remugants, que tenen una dieta herbívora, uns microorganismes de l'estómac produeixen un altre enzim, la cel·lulasa, per descompondre les parets cel·lulars de cel·lulosa de les fibres vegetals.[65]
Diversos enzims poden treballar ensems en un ordre específic, creant rutes metabòliques. En una ruta metabòlica, cada enzim agafa el producte d'un altre enzim com a substrat. Després de la reacció catalítica, el producte és passat a un altre enzim. A vegades, la mateixa reacció pot ser catalitzada en paral·lel per més d'un enzim; això pot permetre una regulació més complexa. Per exemple, un enzim forneix una activitat baixa i constant, mentre que un altre forneix una activitat alta induïble.
Els enzims determinen quins passos es produeixen en aquestes rutes. Sense els enzims, el metabolisme ni progressaria pels mateixos passos ni seria prou ràpid com per satisfer les necessitats de les cèl·lules. De fet, una ruta metabòlica com ara la glicòlisi no podria existir sense enzims. La glucosa, per exemple, pot reaccionar directament amb ATP per quedar fosforilada en un o més dels seus carbonis. En absència d'enzims, aquest procés és tan lent que és negligible. Tanmateix, si s'afegeix hexocinasa, aquestes reaccions lentes continuen produint-se, però la fosforilació al carboni 6 té lloc tan ràpidament que, si s'analitza la mescla una estona després, es troba glucosa 6-fosfat com a únic producte significatiu. Per consegüent, la xarxa de rutes metabòliques de cada cèl·lula depèn del conjunt d'enzims funcionals presents.
Hi ha cinc mecanismes principals de control de l'activitat enzimàtica dins les cèl·lules.

Com que la regulació estricta de l'activitat enzimàtica és essencial per l'homeòstasi, qualsevol disfunció (mutació, sobreproducció, subproducció, o deleció) d'un únic enzim crític pot causar una malaltia genètica. La importància dels enzims és demostrada pel fet que una malaltia letal pot ser causada per la disfunció de només un tipus d'enzim dels milers que hi ha al cos humà.
Un exemple és el tipus més habitual de fenilcetonúria. La mutació d'un únic aminoàcid de l'enzim fenilalanina hidroxilasa, que catalitza el primer pas de la degradació de la fenilalanina, resulta en l'acumulació de fenilalanina i productes relacionats. Això pot conduir a retard mental si no es tracta la malaltia.[69]
Un altre exemple és quan mutacions de la línia germinal de gens que codifiquen enzims de reparació de l'ADN causen síndromes hereditàries de càncer, com ara xerodèrmia pigmentada. Els defectes en aquests enzims causen càncer perquè el cos és menys capaç de reparar mutacions del genoma. Això causa una lenta acumulació de mutacions i resulta en el desenvolupament de molts tipus de càncer en el malalt.
El nom d'un enzim deriva sovint del seu substrat o de la reacció química que catalitza, amb el sufix -asa. En són exemples la lactasa, l'alcohol deshidrogenasa i l'ADN polimerasa. Això pot resultar en què diferents enzims, anomenats isozims, que tenen la mateixa funció tinguin el mateix nom bàsic. Els isoenzims tenen una seqüència d'aminoàcids diferent i se'ls pot distingir pel seu pH òptim, propietats cinètiques o immunològicament. A més, la reacció fisiològica normal que catalitza un enzim pot no ser la mateixa que en condicions artificials. Això pot fer que un mateix enzim sigui identificat amb dos noms diferents. Per exemple, la glucosa isomerasa, utilitzada a la indústria per convertir glucosa en l'edulcorant fructosa, és una xilosa isomerasa in vivo.
La Unió Internacional de Bioquímica i Biologia Molecular ha desenvolupat una nomenclatura pels enzims, els números EC; cada enzim és descrit per una seqüència de quatre números precedida per EC.[70]
El primer número classifica de manera general l'enzim segons el seu mecanisme:
El nivell de classificació més alt és el següent:
Es pot navegar per la nomenclatura completa a http://www.chem.qmul.ac.uk/iubmb/enzyme/.
S'utilitzen enzims a la indústria química i altres sectors industrials quan calen catalitzadors extremament específics. Tanmateix, els enzims en general estan limitats a les reaccions que han evolucionat per a catalitzar i la seva manca d'estabilitat en dissolvents orgànics i a temperatures elevades. Així doncs, l'enginyeria proteica és un àmbit d'investigació actiu que intenta crear enzims amb propietats noves, ja sigui per disseny racional o per evolució in vitro.[72][73] Aquests esforços han començat a donar fruit amb el disseny ex novo de diversos enzims per a catalitzar reaccions que no es donen a la natura.[74]
| Aplicació | Enzims utilitzats | Usos |
Processament d'aliments  |
Amilases de fongs i plantes | Producció de sucres a partir de midó, com en la producció de xarop de blat de moro.[75] En fleques, per catalitzar la descomposició del midó de la farina en sucre. La fermentació del sucre per part dels llevats produeix el diòxid de carboni que fa pujar la massa. |
| Proteases | Utilitzades per fabricants de galetes per reduir el contingut proteic de la farina. | |
| Aliments per nadons | Tripsina | Per predigerir aliments per nadons. |
Cerveseria  |
Els enzims de l'ordi són alliberats durant l'etapa de maceració de la producció de cervesa. | Degraden el midó i les proteïnes per produir sucres, aminoàcids i pèptids simples que utilitzen els llevats en la fermentació. |
| Enzims d'ordi produïts industrialment | Àmpliament utilitzats en el procés de producció de cervesa per substituir els enzims naturals de l'ordi. | |
| Amilases, glucanases, proteases | Fragmenten els polisacàrids i les proteïnes de la malta. | |
| Betaglucanases i arabinoxilanases | Milloren el producte de la maceració i les característiques de filtració de la cervesa. | |
| Amiloglucosidases i pul·lulanases | Cervesa baixa en calories i ajustament de la fermentabilitat. | |
| Proteases | Eliminen la terbolesa produïda durant l'emmagatzemament de les cerveses. | |
| Acetolactatdescarboxilases (ALDC) | Augmenten l'eficiència de la fermentació per mitjà de la reducció de diacetil.[76] | |
| Sucs de fruita | Cel·lulases, pectinases | Donar claredat als sucs de fruita |
Indústria lletera  |
Rennina, derivada de l'estómac d'animals remugants joves (com ara vedells o xais). | Manufactura de formatges, utilitzat per hidrolitzar proteïnes. |
| Enzims produïts per microbis | Amb un ús creixent a la indústria lletera. | |
| Lipases | Utilitzades durant la producció de formatge Rocafort per millorar la maduració del Danablú. | |
| Lactases | Descomponen la lactosa en glucosa galactosa. | |
| Entendriment de la carn | Papaïnes | Per fer més tendra la carn que ha de ser cuinada. |
| Indústria del midó | Amilases, amiloglucosideases i glucoamilases | Converteix midó en glucosa i diversos xarops. |
| Glucosa isomerases | Converteix glucosa en fructosa en la producció de xarop de blat de moro a partir de midó. Aquest xarop té propietats millorades d'edulcoració i un valor calorífic inferior al de la sucrosa amb el mateix nivell de dolçor. | |
Indústria paperera |
Amilases, xilanases, cel·lulases i ligninases | Descomponen el midó en una menor viscositat, contribuint a encolar i acabar el paper. Les xilanases redueixen la quantitat de lleixiu necessària per la descoloració; les cel·lulases suavitzen les fibres, milloren el drenatge d'aigua, i promouen l'eliminació de tinta; les lipases redueixen la cobertura del paper i els enzims degradadors de lignina eliminen la lignina per fer el paper més tou. |
Indústria dels biocombustibles |
Cel·lulases | Utilitzades per descompondre la cel·lulosa en sucres que poden ser fermentats (vegeu etanol cel·lulòsic). |
| Ligninases | Ús de residus de lignina | |
| Detergents biològics | Principalment proteases, produïdes en forma extracel·lular a partir de bacteris | Utilitzades per condicions de preremull i aplicacions directes de líquids per eliminar taques de proteïnes de la roba. |
| Amilases | Detergents pels rentavaixelles, utilitzats per eliminar residus resistents de midó. | |
| Lipases | Utilitzades per ajudar a eliminar taques de greix i d'oli. | |
| Cel·lulases | Utilitzades en suavitzants biològics. | |
| Netejadors de lents de contacte | Proteases | Utilitzades per eliminar proteïnes de les lents de contacte per evitar infeccions. |
| Indústria de la goma | Catalases | Utilitzades per generar oxigen a partir de peròxid per convertir làtex en cautxú cel·lular. |
| Indústria fotogràfica | Proteases (ficina) | Dissolució de gelatina de pel·lícules rebutjades, permetent recuperar-ne el contingut en argent. |
Biologia molecular  |
Enzims de restricció, ADN ligases i polimerases | Utilitzades per manipular ADN en enginyeria genètica, importants en farmacologia, agricultura i medicina. Essencials per la digestió de restricció i la reacció en cadena de la polimerasa. La biologia molecular també és important en les ciències forenses. |
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.