aigua en estat sòlid From Wikipedia, the free encyclopedia
El glaç, o gel, és l'estat sòlid de l'aigua (H₂O), el qual es forma quan aquest es troba en una temperatura inferior a 0 °C (273,15 K), que és el seu punt de congelació. El glaç també és considerat un mineral. Quant al seu nom, Pompeu Fabra proposava una redistribució semàntica, gel, quan és artificial, i glaç, quan és natural.[1] El mot «glaç» prové del llatí glacies, amb el mateix significat,[2] i «gel» del llatí gĕlu, també amb el mateix significat.[3]
| Per a altres significats, vegeu «Gel (col·loide)». |


El glaç s'observa a les terres i les aigües superficials de la Terra en diverses formes. Destaquen sobretot les glaceres continentals (lloses de glaç) que cobreixen gran part de l'Antàrtida i Groenlàndia. Masses més petites de glaç perenne, anomenades casquets glacials, ocupen parts del Canadà àrtic i altres regions d'alta latitud, mentre que les glaceres de muntanya es troben en àrees més restringides, com valls de muntanyes i terres planes. Altres manifestacions del glaç a la terra inclouen els diferents tipus de glaç de terra associats a la permagel, és a dir, el sòl permanentment congelat comú a les regions molt fredes.[4]
A les aigües oceàniques de les regions polars, els icebergs es formen quan grans masses de glaç es trenquen de les glaceres, o plataformes de glaç, i es desplacen. La congelació de l'aigua de mar en aquestes regions dona lloc a la formació de làmines de glaç marí conegudes com a glaç compacte. Durant els mesos d'hivern, cossos similars de glaç es formen en llacs i rius de moltes parts del món.[4]
El glaç és l'estat sòlid de l'aigua, una substància normalment líquida que es congela a temperatures de 0 °C o menys i es converteix en estat gasós a temperatures de 100 °C o més. L'aigua és una substància extraordinària, anòmala en quasi totes les seves propietats físiques i químiques i, sens dubte, la més complexa de totes les substàncies familiars que són compostos químics únics. Està formada per dos àtoms d'hidrogen i un àtom d'oxigen , amb la fórmula química . Aquests tres àtoms estan enllaçats mitjançant enllaç covalent i formen una estructura específica, amb l'àtom d'oxigen situat entre els dos àtoms d'hidrogen. No obstant això, els tres àtoms no estan alineats en línia recta. En canvi, els àtoms d'hidrogen es dobleguen cap a l'un a l'altre, formant un angle d'aproximadament 105° i amb una longitud d'enllaç de 95,7 pm.

L'estructura tridimensional de la molècula d'aigua és deguda al fet que l'àtom d'oxigen empra per formar els enllaços orbitals híbrids sp3, que estan orientats cap als vèrtexs d'un tetraedre, i separats 109,5°. Dos d'aquests orbitals tenen dos electrons i, segons la teoria d'enllaç de valència, no formen enllaços. Els altres dos orbitals sp3 tenen un electró cadascun i poden formar enllaços superposant-se amb d'altres orbitals d'un altre àtom amb també un electró. És el cas de l'enllaç amb els hidrògens, que fan ús dels seus orbitals atòmics 1s.
Els dos orbitals sp3 que no formen enllaç per tenir ja dos electrons són claus en el comportament peculiar de l'aigua. El seu volum fa allunyar un poc els orbitals enllaçants i l'angle es contreu de 109,5° a 104,5°. També la seva alta densitat de càrrega negativa atreu els nuclis d'hidrogen, amb densitat electrònica positiva, de les molècules d'aigua adjacents per formar el que es coneix com a enllaços per pont d'hidrogen, les forces intermoleculars més intenses. Aquests enllaços no són especialment forts, però, com que orienten les molècules d'aigua en una configuració específica, afecten significativament les propietats de l'aigua en els seus estats sòlid, líquid i gasós.
En l'estat líquid, la majoria de les molècules d'aigua estan associades en una estructura polimèrica, és a dir, cadenes de molècules connectades per enllaços per pont d'hidrogen febles. Sota la influència de l'agitació tèrmica, hi ha una ruptura i una reformació constant d'aquests enllaços. En l'estat gasós, vapor d'aigua, les molècules d'aigua són en gran part independents les unes de les altres, i, llevat de les col·lisions, les interaccions entre elles són lleus. L'aigua gasosa, doncs, és en gran manera monomèrica, és a dir, formada per molècules individuals, tot i que ocasionalment es produeixen dímers (una unió de dues molècules) i fins i tot alguns trímers (una combinació de tres molècules). En l'estat sòlid, a l'altre extrem, les molècules d'aigua interaccionen entre elles prou fortament per a formar una estructura cristal·lina ordenada.[5]
Cada molècula d'aigua al glaç està enllaçada per quatre enllaços per pont d'hidrogen en les direccions dels vèrtexs d'un tetraedre a altres quatre molècules. Els dos hidrògens s'uneixen per enllaços per pont d'hidrogen a dos oxígens de molècules d'aigua veïnes, i l'oxigen s'enllaça amb els seus dos parells d'electrons no enllaçants a dos hidrògens d'altres dues molècules.[6] A pressió atmosfèrica estàndard i a temperatures properes als 0 °C, el cristall de glaç pren la forma de làmines superposades o plans d'àtoms d'oxigen units en una sèrie d'anells hexagonals. Tanmateix, els sis oxígens no estan exactament en el mateix pla, ja que l'anell té conformació de cadira, com la del ciclohexà. Es podria dir que són plans lleugerament rugosos. L'eix paral·lel als anells hexagonals s'anomena eix c i coincideix amb l'eix òptic de l'estructura cristal·lina. Aquesta estructura s'anomena ( perquè fou la primera estructura del glaç descoberta i perquè és una estructura hexagonal). El grup espacial de l'estructura és P6₃/mmc; la simetria D6h, i la classe de simetria de Laue 6/mmm.[7]

Aquesta estructura cristal·lina presenta una lleugera desviació de la simetria hexagonal ideal. La cel·la unitària és un 0,3 % més curta en la direcció c (en la direcció dels enllaços per pont d'hidrogen). Això dona lloc a una menor compressibilitat en la direcció c. Les constant de la xarxa a –20 °C són a = 0,4519 nm (l'espaiat de la xarxa lateral) i c = 0,7357 nm (l'espaiat entre capes és la meitat 0,36780 nm); amb una distància mitjana més propera O···O de 0,276 nm, amb distàncies de enllaços H···O i O-H de 0,175 nm (enllaç per pont d'hidrogen) i 0,101 nm (enllaç covalent). El nombre de molècules d'aigua en la cel·la unitat és de 12.[6]

La densitat del glaç (916,68 kg/m³ a 0 °C) és menor que la de l'aigua a la mateixa temperatura (1 000 kg/m³) degut a l'espai buit que queda entre capes a causa de la llargària dels enllaços per pont d'hidrogen. A mesura que l'aigua s'escalfa des del punt de fusió de 0 °C a 4 °C, es contrau i es torna més densa. Aquest augment inicial de densitat té lloc perquè a 0 °C una part de l'aigua consisteix en estructures moleculars obertes similars a les de cristalls de gel. A mesura que la temperatura augmenta, aquestes estructures es descomponen i redueixen el seu volum al de les estructures polimèriques més estretament empaquetades de l'estat líquid. Amb un escalfament posterior més enllà dels 4 °C, l'aigua comença a expandir-se en volum, juntament amb l'augment habitual de les vibracions intermoleculars causades per l'energia tèrmica.[6] Per aquesta raó, l'aigua és una de les poques substàncies que en realitat té una densitat menor en forma sòlida que en estat líquid, passant de 1 000 kg/m³ a 917 kg/m³. Per això el glaç flota en lloc de submergir-se, de manera que, durant l'hivern, es desenvolupa com una capa a la superfície dels llacs i rius en lloc de submergir-se sota la superfície i acumular-se en el fons.[4]
A temperatures més baixes o a pressions molt elevades el glaç presenta moltes altres estructures cristal·lines. Aquestes estructures s'han descobert experimentalment al laboratori, però fora de la Terra, en altres planetes o en satèl·lits en els quals les condicions de pressió i de temperatura són diferents, el glaç pot adoptar algunes d'aquestes estructures que són més compactes:
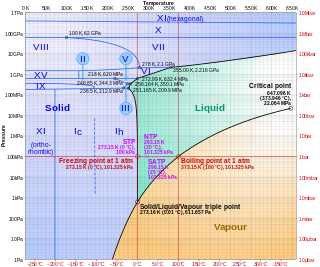



Com qualsevol altre sòlid cristal·lí, el glaç sotmès a tensions experimenta una deformació elàstica, tornant a la seva forma original quan la tensió cessa. No obstant això, si una tensió de cisalla o una força s'apliquen a una mostra de glaç durant un temps prolongat, la mostra es deformarà primer elàsticament i continuarà deformant-se plàsticament, amb una alteració permanent de la forma. Aquesta deformació plàstica, o fluència, és de gran importància per a l'estudi del flux de glacera. Implica dos processos: el desplaçament intracristal·lí, en què les capes dins d'un cristall de glaç es desplacen paral·lelament sense destruir la continuïtat de la seva xarxa cristal·lina, i la recristal·lització, en què els límits cristal·lins canvien de mida o forma segons l'orientació dels cristalls adjacents i les tensions exercides sobre ells. La moviment de les dislocacions, és a dir, de les defectes o desordres en la xarxa cristal·lina, controla la velocitat de deformació plàstica. Les dislocacions no es mouen sota deformació elàstica.
La resistència del glaç, que depèn de molts factors, és difícil de mesurar. Si el glaç es sotmet a tensió durant un temps prolongat, es deforma per fluència plàstica i no té un punt de cadència (a partir del qual comença la deformació permanent) o una resistència màxima. Per a experiments a curt termini amb màquines d'assaig convencionals, els valors típics de resistència en barres són 38 per a compressió, 14 per a flexió, 9 per a tracció i 7 per a cisalla.[4]
| Temperatura, t (°C) |
Densitat, ρ (kg/m³) |
Conductivitat tèrmica, k (W/m K) |
Calor específica, cp (kJ/kg K) |
|---|---|---|---|
| 0 | 916,2 | 2,22 | 2,050 |
| –5 | 917,5 | 2,25 | 2,027 |
| –10 | 918,9 | 2,30 | 2,000 |
| –15 | 919,4 | 2,34 | 1,972 |
| –20 | 919,4 | 2,39 | 1,943 |
| –25 | 919,6 | 2,45 | 1,913 |
| –30 | 920,0 | 2,50 | 1,882 |
| –35 | 920,4 | 2,57 | 1,851 |
| –40 | 920,8 | 2,63 | 1,818 |
| –50 | 921,6 | 2,76 | 1,751 |
| –60 | 922,4 | 2,90 | 1,681 |
| –70 | 923,3 | 3,05 | 1,609 |
| –80 | 924,1 | 3,19 | 1,536 |
| –90 | 924,9 | 3,34 | 1,463 |
| –100 | 925,7 | 3,48 | 1,389 |
L'entalpia de fusió (calor absorbida en la fusió d'un sòlid) de l'aigua és de 334 kJ/kg. La calor específica del glaç en el punt de congelació és de 2,05 kJ/kg °C i augmenta en disminuir la temperatura. La conductivitat tèrmica a aquesta temperatura és de 2,22 W/m K i també augmenta en baixar la temperatura. Una altra propietat important per a l'estudi de les glaceres és la disminució del punt de fusió a causa de la pressió hidroestàtica: 0,0074 °C/bar. Això significa que per a una glacera de 300 metres de gruixa, en què tot el glaç està a la temperatura de fusió, el glaç a la base és 0,25 °C més fred que a la superfície.[4][18]
El glaç pur és transparent, però les bombolles d'aire el fan una mica opac. El coeficient d'absorció, o taxa amb què la radiació incident disminueix amb la profunditat, és d'aproximadament 0,1 cm−1 per a la neu i només 0,001 cm−1 o menys per a glaç clar. El glaç és feblement birrefringent, és a dir, doblement refractant, el que significa que la llum es transmet a diferents velocitats en direccions cristal·logràfiques diferents. Les seccions primes de neu o gel, per tant, es poden estudiar de manera convenient sota llum polaritzada de la mateixa manera que es estudien les roques. El cristall de glaç absorbeix fortament la llum en longituds d'ona vermelles, i per tant, la llum dispersada que es veu emergir de les crevasses de la glacera i les cares de glaç no erosionades apareix com a blava o verda (el color complementari).[4]

L'albedo, o reflectivitat (una albedo de 0 significa que no hi ha reflectivitat), en la radiació solar varia de 0,5 a 0,9 per a la neu, de 0,3 a 0,65 per a la neu pitjada i de 0,15 a 0,35 per al glaç de glacera. En longituds d'ona infraroig tèrmic, la neu i el glaç són gairebé perfectament "negres" (absorbents), i l'albedo és inferior a 0,01. Això significa que la neu i el glaç poden absorbir o irradiar radiació de longitud d'ona llarga amb alta eficiència. En longituds d'ona electromagnètiques més llargues (microones i freqüències de ràdio), la neu seca i el glaç són relativament transparents, tot i que la presència fins i tot de petites quantitats d'aigua líquida modifica notablement aquesta propietat. Les tècniques d'acolliment per radar s'utilitzen ara rutinàriament per mesurar el gruix de les glaceres polars seques, fins i tot quan tenen quilòmetres de gruix, però la menor quantitat d'aigua líquida distribuïda a través de la massa crea grans dificultats amb la tècnica.[4]

L'acumulació de la neu (una forma de gel) en les glaceres i el seu moviment és un agent erosiu molt potent.

El glaç ha tengut i té una gran importància en la conservació d'aliments. Des de fa uns centenars d'anys s'utilitzaven pous de glaç per a l'emmagatzemament de la neu a les muntanyes que es transformava en gel gràcies a la pressió de les successives capes. Actualment s'utilitzen neveres i congeladors per a fabricar el fred necessari.
Hi ha un bon grapat d'esports que es practiquen damunt pistes de glaç:

Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.