Antimikrobni peptidi
From Wikipedia, the free encyclopedia
Antimikrobni peptidi (AMP-i), također zvani odbrambeni peptidi domaćina (HDP-i) su dio urođenog imunskkog odgovora pronađenog među svim klasama života. Postoje fundamentalne razlike između prokariotskih i eukariotskih ćelija koje mogu predstavljati mete za antimikrobne peptide. Ovi peptidi su moćni antibiotici širokog spektra koji pokazuju potencijal kao novi terapeutski agensi. Dokazano je da antimikrobni peptidi ubijaju Gram-negativne i Gram-pozitivne bakterije,[1] omotani virusi, gljive, pa čak i transformirane ili kancerogene ćelije.[2] Za razliku od većine konvencijskih antibiotika, čini se da antimikrobni peptidi često destabiliziraju biološku membranu, mogu formirati transmembranske kanale, a također mogu imati sposobnost poboljšanja imunosti funkcionirajući kao imunomodulatori.
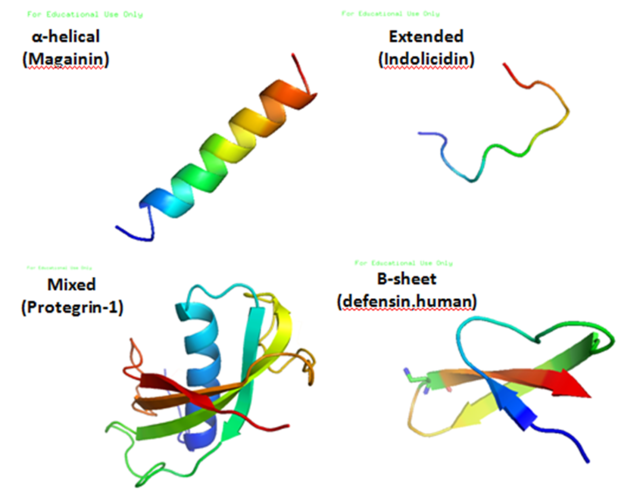
Struktura

Antimikrobni peptidi su jedinstvena i raznolika grupa molekula, koje su podijeljene u podgrupe na osnovu sastava i strukture aminokiselina.[3] Antimikrobni peptidi obično imaju između 12 i 50 aminokiselina. Ovi peptidi uključuju dva ili više pozitivno nabijenih ostataka koje osiguravaju arginin, lizin ili, u kiseloj sredini, histidin, i veliki dio (uglavnom >50%) hidrofobnih ostataka.[4][5][6] Sekundarne strukture ovih molekula prate 4 teme, uključujući (1) α-heliksnu, (2) β-lance zbog prisustva 2 ili više disulfidne veze s, (3) β-ukosnica ili omča zbog prisustva jedne disulfidne veze i/ili ciklizacije peptidnog lanca, i (4) produženja.[7] Mnogi od ovih peptida su nestrukturirani u slobodnom rasatvoru i savijaju se u svoju konačnu konfiguraciju nakon razdvajanja u biološke membrane. Sadrži hidrofilne aminokiselinske ostatke poređane duž jedne strane i ostatke hidrofobne aminokiseline poredane duž suprotne strane spiralne molekule.[3] Ova amfipatičnost antimikrobnih peptida omogućava im da se podijele u membranski lipidni dvosloj. Sposobnost povezivanja sa membranama je definitivna karakteristika antimikrobnih peptida,[8][9]
| Tip | Svojstvo | AMP |
|---|---|---|
| Anionski peptidi | Bogat glutaminskom i asparaginskom kiselinom | Maksimin H5 vodozemaca, dermcidin ljudi |
| Linearni kationski α-heliksni peptidi | Nedostatak cisteina | Cekropini, andropin, moricin, ceratotoksin i melitin iz insekata, magainin, dermaseptin, bombinin, brevinin-1, eskulentini i buforin II iz vodozemaca, CAP18 kunića, LL37 ljudi |
| Kationski peptid obogaćen specifičnom aminokiselinom | Bogat prolinom, argininom, fenilalaninom, glicinom, triptofanom | Abacin i drozocin, apidecin, diptericin, i atacin iz insekata, profenin od svinja, indolicidin od goveda. |
| Anionski/kationski peptidi koji formiraju disulfidne veze | Sadrže 1~3 disulfidne veze |
|
Aktivnosti

Načini djelovanja kojima antimikrobni peptidi ubijaju mikrobe su različiti,[10] i mogu se razlikovati za različite vrste bakterija.[11] Neki antimikrobni peptidi ubijaju i bakterije i gljive, naprimjer, psorijazin ubija E. coli i nekoliko filamentnih gljiva.[12] Citoplazmatska membrana je česta meta, ali peptidi takođe mogu ometati sintezu DNK i sintezu proteina, savijanje proteina i sintezu ćelijskog zida.[10] Početni kontakt između peptida i ciljnog organizma je elektrostatski, jer je većina bakterijskih površina anionska ili hidrofobna, kao što je antimikrobni peptid piscidin. Njihov aminokiselinski sastav, amfipatičnost, kationski naboj i veličina omogućavaju im da se vežu za dvoslojeve membrane i umetnu u njih, kako bi formirali pore pomoću mehanizama 'barel-stub', 'tepih' ili 'toroidnih pora'. Alternativno, mogu prodrijeti u ćeliju kako bi vezali unutarćelijske molekule koje su ključne za život ćelije.[13] Unutarćelijski modeli vezivanja uključuju inhibiciju sinteze ćelijskog zida, promjenu citoplazmatske membrane, aktivaciju autolizina, inhibiciju DNK, RNK i sinteze proteina i inhibiciju određenih enzima. U mnogim slučajevima tačan mehanizam ubijanja nije poznat. Jedna nova tehnika za proučavanje takvih mehanizama je dvopolarizacijska interferometrija.[14][15] Za razliku od mnogih konvencionalnih antibiotika, čini se da su ovi peptidi baktericidni[2] umjesto bakteriostatski. Općenito, antimikrobna aktivnost ovih peptida određuje se mjerenjem minimalne inhibitorne koncentracije (MIC), koja je najniža koncentracija lijeka koji inhibira rast bakterija.<.[16]
AMP mogu imati višestruke aktivnosti uključujući anti-gram-pozitivne bakterije, anti-antigramnsgarivne bakterijske, anti-gljivične, antivirusne, antiparazitske i antikancerogene aktivnosti. Velika funkcionalna analiza AMP-a pokazuje da među svim aktivnostima AMP-a, amfipatičnost i naboj, dva glavna svojstva AMP-a, najbolje razlikuju AMP-ove sa i bez anti-gram-negativnih bakterijskih aktivnosti.[17] Ovo implicira da AMP s antigram-negativnim bakterijskim aktivnostima može preferirati ili čak zahtijevati jaku amfipatičnost i neto pozitivan naboj.
Također pogledajte
- Aurein
- Bakteriocin
- Katelicidin
- Kopsin
- Diptericin
- Perifernomembranski proteini
- Virtualni broj kolonija
Reference
Vanjski linkovi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
