From Wikipedia, the free encyclopedia
Периодичната система (наричана още таблица на Менделеев) представлява класификация на химичните елементи по техния атомен номер (тоест броя на протоните), електронната конфигурация и повтарящите се химични свойства. Таблицата е графичен израз на периодичния закон, открит и публикуван от руския химик Дмитрий Менделеев през 1869 г. Въз основа на периодичния закон Менделеев успешно предсказва свойствата на неизвестни дотогава химични елементи.
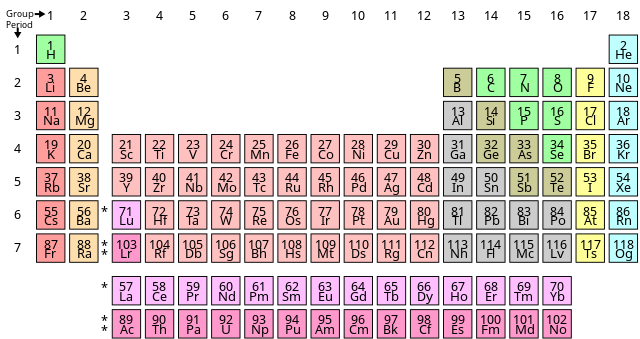


В първоначалния си вариант таблицата е представяла свойствата на елементите в зависимост от атомното им тегло (в съвременната интерпретация това е атомната маса). С развитието на теорията за строежа на атома се установява, че най-важната характеристика на атомите е не тяхната маса, а броят на протоните в ядрата им. Това дава възможност да се уточни формулировката на периодичния закон.
Преди Менделеев са предлагани стотици начини за изобразяване на периодичната система с аналитични криви, таблици, геометрични фигури и др.[1] Никой от тези начини не притежава достойнствата на системата, предложена от Менделеев – простота, естественост и удобство.
В съвременния вариант периодичната система се изобразява като двумерна таблица. Всеки стълб (наричан група) се състои от химични елементи с подобно поведение и свойства. Всеки ред (наричан период) съдържа елементи с един и същи брой електронни обвивки (слоеве). Всеки период започва с метали и завършва с неметали. Много от групите имат както имена, така и номера. Например група VII A е групата на халогените, а група VIII A – на благородните газове.
Всеки елемент в таблицата има точно определен пореден номер Z, равен на броя на протоните в атомното ядро, и точно определени координати в периодичната система – период и група. Между мястото на елемента в периодичната система (съответно строежа на атомите му) и неговия химичен характер съществува зависимост. Тя може да се използва, за да се предвиди химичният характер на елемента и поведението на съответните прости вещества и съединения. Първите 94 елемента съществуват в природата, въпреки че някои са открити само в малки количества, синтезирани в лаборатории, преди да бъдат открити в природата.
Древните философи са първите, стремели се да създадат единна теория на цялата природа и да обяснят нейния произход, строеж и многообразие. Гръцкият философ Демокрит смятал, че всички природни вещества се състоят от малки неделими и несвиващи се частици – атоми, с различна форма и размер, но с еднакъв състав. Първите опити да обобщи нещата в природата е направил древногръцкият философ Аристотел с негово учение за първоматерията и нейните начала, чрез съчетанията на които могат да се получат петте основни елемента – земя, вода, въздух, огън и ефир. Атомите и елементите в учението на древните философи били възприемани като умозаключения и били представяни като абстрактни понятия, без да се базират на резултати от опита.[2]
До XVIII век са познати и описани само 15 елемента – металите желязо, мед, олово, бисмут, арсен, цинк, калай, антимон, платина, сребро, живак, злато и неметалите въглерод, сяра и фосфор.
През 1789 г. Антоан Лавоазие в своята книга „Елементарен курс по химия“ включва първата в новата история на химичните елементи, наречен „Таблица на простите вещества“.[2] Той публикува списък с 33 химични елемента, групирайки ги в газове, метали, неметали и земни.[3] Наред с известните дотогава химични елементи, той отъждествява като прости вещества и въглищата, светлината, топлината и редица оксиди.[2] Лавоазие приема като критерий за определяне на елемент това, което се основава на опита (емпиричен метод), не притежаващ никакви разсъждения за съществуването на атоми и молекули, които не е възможно да се докажат експериментално.
Химиците прекарват следващия век в търсене на по-точна класификация.
В началото на 19 в. английският химик и физик Джон Далтон въвежда понятието „атомно тегло“, първи сметнал атомното тегло на редица елементи и с това сложил началото на атомния строеж на веществото. Далтон първи показва, че атомното тегло е най-важното свойство на елемента, определящо неговите химични свойства.
През 1814 г. шведският химик Берцелиус публикува таблица с атомните маси на 41 прости вещества, приемайки за едница за сравнение кислорода, атомната маса на който приема за 100 и доказва, че атомната маса не е цяло число.
Към средата на 19 в. са установени химичните свойства на редица елементи и някои закономерности в изменение на стойностите на техните атомни маси. Първи опити за известна систематизация прави Йохан Волфганг Дьоберайнер през 1829 г. Той отбелязва, че много от елементите могат да бъдат групирани в триади въз основа на химичните свойства. Литият, натрият и калият например образуват триадата на меките реактивни метали. Същият учен открива, че атомните тегла на елементите във всяка триада образуват аритметична прогресия.[4] Това правило става известно като закон на триадите.[5] Систематизацията му се изчерпвала с този закон, без да са направени някакви други изводи.
Германският химик Леополд Гмелин работи с тази система и до 1843 г. идентифицира десет триади, три групи от четири и една група от пет елемента. В публикация от 1857 г. Жан-Батист Дюма описва взаимоотношенията между различните групи метали. Въпреки тези частични успехи по онова време все още е липсвала единна схема, която да обхваща всички закономерности.
През 1857 г. английският химик Уилям Олдинг разполага 48 елемента в 13 групи по сходство на химичните им свойства и по атомните им тегла във всяка група, но не и систематизирани с атомните им тегла между групите. Той не намира място на 11 елемента, включително на въглерода и водорода.[2]
През 1857 г. немският химик Фридрих Август Кекуле отбелязва, че въглеродът често има четири други атома, свързани с него. Метанът например има един въглероден атом и четири водородни атома.[6] Тази концепция става известна като валентност:[7] Атомите на всеки химичен елемент проявяват склонност да се свързват в точно определени пропорции.
Голямото затруднение в опитите да се систематизират елементите може да се обясни с неточните стойности на техните атомни тегла и с отсъствието по това време на определенията и понятията в химията. Началото на премахването на това несъответствие слага Първият конгрес на химиците в Карлсруе, Германия, през септември 1860 г., където присъствал и Менделеев. Голяма роля в установяването на общи двойки има италианският химик Станислао Канцаро и в частност точното определяне на атомните и молекулните тегла. Идеите, изказани на конгреса, оказват съществено влияние на химиците за разширяване на възможностите в систематизацията на елементите и довеждат до нови хипотези и таблици, повече или по-малко спорни, но приближаващи се до първоначалните варианти на Периодичната система.[2]
В края на 60-те години се наброяват около 50 опита за систематизация на химичните елементи. Най-често извежданите примери са тези на Шанкуртоа, Нюландс и Майер.
През 1862 г. френският геолог Александър Емил Бегуйе дьо Шанкуртоа публикува ранна форма на периодична таблица, която нарича телурова спирала или винт. Той е първият човек, който забелязва периодичността на елементите. Тази система се основава на хипотезата, че всяко целочислено значение на атомното тегло отговаря на един елемент.[2] Елементите са разделени на групи по 16 броя, като атомните тегла на завършващите групата са кратни на 16. Системата е изобразена по повърхността на цилиндър. Успоредно на основата на цилиндъра са прекарани вертикални линии, означени от 0 до 16. Прекарани са спирални линии под ъгъл 45°, започващи от горния край с числата на атомните тегла, кратни на 16 по вертикала, на които линии са нанесени сходни по свойства елементи на местата, отговарящи на атомните им тегла. Шанкуртоа е искал да въведе някаква периодичност в системата, като например поставя кислорода, сярата, селена и телура в една от образуващите, но намиращите се в тази група мед и титан нямат никакво отношение към тази група. Заедно с въглерода и силиция в една група са и кобалтът, церият и среброто, а в групата на алкалните метали стои манганът. Неговата диаграма включва някои йони и съединения в допълнение на елементите. Тъй като разположението на елементите завършва с телура, системата получава названието „телурен винт“.[2] Таблицата използва геоложки, а не химически термини и не включва диаграма, в резултат на което получава малко внимание.[8]
През 1864 г. германският химик Лотар Майер публикува таблица с 44 елемента, използваща приблизително еднаква разлика в атомите на елементите, разположени хоризонтално, а вертикално в колони елементите са подредени за първи път по валентност. Не всички приведени валентности отговарят на действителността, но Майер не се усъмнил в правилността на атомните тегла на някои елементи. В таблицата не намират място водород, бор, алуминий и други. Желязото и манганът заемат едно и също място в един от вариантите на таблицата.[2] Таблицата показва, че елементите с подобни свойства често имат една и съща валентност.[9] По същото време английският химик Уилям Одлинг публикува таблица с 57 елемента, наредени по атомно тегло, и споменава идеята за периодичен закон,[10] но не я прокарва последователно и впоследствие предлага класификация на елементите според тяхната валентност.[11]
След 4 години Майер публикува нова форма на таблицата, в която за първи път са показани периоди.[2] В таблицата са отбелязани 17 групи, но някои от тях са пропуснати. В таблицата не е показан първият период и не съществува някаква завършена класификация на елементите.[2]

Английският химик Джон Александър Рейна Нюлендс публикува серия от статии от 1863 г. до 1866 г., в които отбелязва, че когато елементите са изброени в реда на нарастване на атомното тегло, подобни физични и химични свойства се повтарят на интервали от осем. Той приравнява тази периодичност към октавите на музиката.[12][13] Нюлендс нарича това правило „закон на октавите“. Елементите са наредени подред според атомните им тегла от водорода до тория. Използваните от него елементи са 62, а местата в таблицата – 56, затова се наложило на 6 места да слага по два елемента. Той е осмиван от съвременниците си и химичното общество отказва да публикува откритията му.[14] Въпреки това Нюлендс изготвя таблица на елементите и я използва, за да предвиди съществуването на липсващи елементи като германия.[15] Химичното общество признава значението на откритията пет години след като признава Менделеев.[16] През 1867 г. немският химик Густав Хинрикс публикува в Америка спирална периодична система, основаваща се на атомните спектри и тегла и на химичните сходства на елементите.

Към края на 60-те нараства необходимостта от създаването на система на елементите, основана на принципа на закономерност и включваща всички известни елементи.
През последните 15 години, предшестващи откритието на Менделеев (1854 – 1869 г.), научната му дейност била насочена към изучаването в различните страни на измеримите свойства на елементите и взаимодействията между тях. Изучаването на съотношението на атомните тегла на елементите привлича вниманието на Менделеев, особено след Първия конгрес на химиците.[2] Така той трупа опит в резултат на свои собствени наблюдения от огромна маса емпиричен материал, подлежащ на теоретично обобщение и систематична обработка. За разлика от много химици, които се занимават с този въпрос през 60-те години, като въвеждат частично периодичността, но се ограничават в тясна област на проблема, Менделеев разглежда въпроса в по-широк мащаб, включвайки всички елементи и имайки предвид всички техни свойства и характеристики, откривайки взаимната им връзка.
Работейки над своя труд „Основи на химията“, Д. И. Менделеев открива през 1869 г. един от фундаменталните природни закони – периодичния закон на химичните елементи.
На 6 март 1869 г. знаменитият му доклад „Съотношение между свойствата на елементите и атомните им тегла“ (на руски: Соотношение свойств с атомным весом элементов) е прочетен от Н. А. Меншуткин на заседание на Руското химическо общество. През същата година се появява съобщението на немски в списанието „Zeitschrift für Chemie“, а през 1871 г. в „Annalen der Chemie“ е публикувана обширна статия на Д. И. Менделеев, посветена на неговото откритие – „Периодична закономерност на химическите елементи“ (на немски: Die periodische Gesetzmässigkeit der Elemente). Въпреки редица недостатъци на този първи вариант, за Менделеев е ясно, че отбелязаните математически закономерности в измененията на атомните маси на елементите по вертикалите и хоризонталите отразяват неизвестен още общ строг природен закон. Той веднага използва тези закономерности за предсказване на елементи. В получилата се таблица има 4 празни места, отбелязани от Менделеев с въпросителни. Той първи разбира, че наличието на празни места в Системата не бива да се допуска, за да не се наруши закономерността, в която той вярва.
Отделни учени в редица страни, особено в Германия, смятат Лотар Майер за съоткривател. Съществената разлика между предложените системи е в това, че таблицата на Л. Майер е един от вариантите на класификация на известните към онзи момент химични елементи, докато посочената от Менделеев периодичност дава разбиране за закономерността, според която се определя мястото на елементи, които не са били известни по онова време, и предлага възможност да се предскаже не само съществуването на такива елементи, но и техните свойства.[17]
Въпреки че не съдържа някаква конкретна представа за строежа на атома, периодичният закон стига много близко до поставянето на този проблем. През 1984 г. академик В. И. Спицин пише: „Първите представи за строежа на атома и за химичната валентност, разработени в началото на XX век, се основават на закономерностите в свойствата на елементите, установени с помощта на периодичния закон.“[18]
Развивайки през следващите две години идеите си, Менделеев въвежда понятието за място на химичния елемент в периодичната система. Мястото на един химичен елемент се определя чрез съпоставяне на свойствата му със свойствата на другите химични елементи. По този начин, отчитайки резултатите от изучаване на стъклообразуващите оксиди, Менделеев поправя атомните маси на девет елемента – берилий, индий, уран и др. През 1870 г. предсказва съществуването на три неизвестни дотогава елемента, изчислява атомните им маси и описва свойствата им – „екаалуминий“ (открит през 1875 г. и наречен галий), „екабор“ (открит през 1879 г. и наречен скандий) и „екасилиций“ (открит през 1885 г. и наречен германий).
През 1871 г. Менделеев публикува своя втори вариант на Системата на елементите, който е по-съвършен от първия и го нарича „Естествена система на елементите“.[2] Вторият вариант по форма се отличава от първия вариант, като хоризонталните редове на елементите от първия вариант са представени като вертикални. Новата Система е конструктивно по-сложна и по-ясна и му дава възможност да предскаже съществуването на 11 елемента, сред които „екателур“ – полоний (открит през 1898 г.), „екайод“ – астат (открит през 1942 – 3 г.), „екаманган“ – технеций (открит през 1937 г.), „двиманган“ – рений (открит през 1925 г.), „екацезий“ – франций (открит през 1939 г.). Повечето останали елементи са получени в чист вид и описани научно през XIX век.
Първото сериозно изпитание на Закона за периодичност е свързано с откритието на петте нови елемента, които не са предсказани от Менделеев – хелий, аргон, неон, криптон и ксенон. Те показват странни свойства – всички те били газове и не давали никакви признаци за взаимодействие с други елементи, поради което ги наричат „благородни“ или „инертни“. През 1900 г. Дмитрий Менделеев и Уилям Рамзи стигат до извода, че е необходимо в периодичната система да бъдат включени елементите от групата на благородните газове. Така те създават нулевата група в системата.
Откриването на радиоактивността е следващото изпитание за Системата. Открити са радиоактивните елементи полоний, радий и актиний, за които се намира място. През 1902 г. стават известни още 3 радиоактивни елемента, произхождащи от радия, тория и актоноурания, наречени съответно радон, торон и актинон.[2] Те си приличат по химичните си свойства – не взаимодействат химично, имат поведението на инертни газове и се различават само по атомни маси, а в нулевата група на Периодичната система имало само едно място.
През 1839 г. шведският химик Карл Мозандър отделя от минерала церит, освен церий, още лантан и нов редкоземен „елемент“, наречен от него дидим със знак Di, от гръцката дума за близнаци, защото бил много близък до церия и лантана – съставящите проявяват трета валентност и са химично подобни. През 1885 г. от дидима, който фактически се оказва трудно разделима смес от два елемента, се получават елементите празеодим и неодим. Четири години по-късно същият учен открива елементите тербий и ербий. Церият е открит през 1803 г. Елементът проявява трета и четвърта валентност. Когато Менделеев открива Периодичната система, са известни четири редкоземни елемента. Трите елемента – La, Ce, дидим, проявяват трета валентност, а церият проявява и четвърта валентност. Тогава Менделеев поставя лантана в III група, церия – в IV, а дидима, въпреки неуспешните му усилия да образува V валентност – в V група. Чешкият химик Богуслав Браунер пръв изказва идеята за образуване на извънсистемна група на редкоземните елементи.[2] Той докладва през 1902 г. на заседание на Бохемската академия на науките в Прага, че между неодима и самария има твърде голяма разлика в атомните маси (около 6,1), в сравнение със съседните елементи, и според него това показва, че има неоткрит елемент – бъдещият прометий.
До смъртта на Менделеев през 1907 г. са известни 13 редкоземни елемента, с изключение на неоткритите още лутеций и прометий. Всички те проявяват трета валентност, някои от тях и втора, а други и четвърта валентност. Менделеев не възприема съществуването на извънсистемна група от елементи, за която смята, че противоречи на Периодичния закон.[2]
В началото на XX век са неизвестни само още десет естествени елемента. Оттогава насам са станали известни само някои труднооткриваеми, често радиоактивни, елементи.
През 1911 г. Ърнест Ръдърфорд разработва планетарния модел на атома, според който масата и положителният заряд на атома са съсредоточени в малък обем, около който обикалят електроните, образувайки електронната обвивка на атома. През 1913 г. холандският учен Антониус Ван ден Брук предполага, че електрическият заряд Z на ядрото на атома на всеки химичен елемент е равен на поредния номер в Периодичната система. Това предположение е потвърдено от Хенри Мозли.
През 1913 г. Фредерик Соди и независимо от него Казимир Фаянс формулират закона за радиоактивните отмествания – при α-разпада радиоактивният елемент се превръща в елемент, отстоящ от изходния на две места в Периодичната система вляво, а при β-разпада – с едно място вдясно.[2]
Тогава стои и въпросът за две групи новооткрити елементи, които през 1912 г. наброяват 39, а трябва да се поместят в 8 клетки от бисмута до урана. В едната група те се различават забележимо по атомни маси, но не се различават по останалите си свойства. Другите радиоактивни елементи имат еднакви атомни маси, но нямат сходни свойства. През 1913 г. Соди предлага радиоактивните елементи с еднакви химични свойства (освен радиоактивните им свойства) да се смятат като разновидност на един и същ радиоактивен химичен елемент. Такива разновидности той нарича изотопи – „с едно и също място“. След години се разбира, че и стабилните химични елементи имат изтопи. Под силното влияние на откритието на делимостта на атома, Соди предложил атомът да се нарича „том“ (делим), но това не се възприело.
През 1913 г. Хенри Мозли формулира закон, свързващ честотата на рентгеновото характеристично излъчване на всеки елемент с номера и мястото му в Таблицата. Решителен принос в учението за строежа на атома има и Нилс Бор, на основа на представите за кватновата природа на поглъщането и излъчването на енергия, въведени от Макс Планк.
През 1923 г. се открива неутронът, с което се доказва протон-неутронният модел на атома. Така броят на протоните в ядрото, определящ стойността на положителния му заряд, е равен на броя на електроните в електронната обвивка (поради което атомът е електронеутрален), и е също равен на поредния номер на елемента в Периодичната система. Броят на неутроните в ядрото на изтопите на даден елемент може да бъде различен в близки граници. Така се разбира, че атомната маса на един елемент е дробно число, тъй като количественото отношение на стабилните изотопи на един елемент е различно. Така се намира място за торона, актинона и радона – изотопи на един и същ елемент, наречен радон със знак Rn, поради това, че и трите изотопа са дъщерни продукти на радиоактивните изотопи на радона, който заел единственото свободно място в нулевата група.[2]
Много от тях не се срещат в природата и са продукт на процесите на изкуствения термоядрен синтез. Едва през декември 1994 г. са произведени двата изкуствени елемента дармщатий (ека-платина) и рьонтгений (ека-злато).
Периодична система на елементите | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Група | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |||||
| Период | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57-71 * |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||
| 7 | 87 Fr |
88 Ra |
89-103 ** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||
| * Лантаниди | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| ** Актиниди | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
| Фоновият цвят показва химическата серия на елемента | |||||||||||||
| Метал |
Металоид | Неметал | |||||||||||
| Алкален метал | Алкалоземен метал | Лантанид | Актинид | Преходен метал | Слаб метал | Неметал | Халоген | Благороден газ | |||||
| Цветът на атомния номер показва агрегатното състояние на елемента (0 oC, 1 atm) | |||||||||||||
| Твърдо вещество | Течност | Газ | Неизвестна фаза | ||||||||||
| Очертанието показва начина на възникване на елемента | |||||||||||||
| Естествен | При разпад | Синтетичен | |||||||||||
Всеки химичен елемент има уникален атомен номер (Z), представляващ броя на протоните в ядрото му. Повечето елементи имат различен брой неутрони между различните атоми, като тези вариации се наричат изотопи. Например, въглеродът има три естествени изотопа: всичките му атоми имат шест протона и повечето имат и шест неутрона, но около един процент имат седем неутрона, а много малка част имат осем неутрона. Изотопите никога не са сложени отделно в периодичната таблица. Те винаги са групирани заедно под един елемент. Елементи без стабилни изотопи имат атомните маси на техните най-стабилни такива, като атомните маси са показани в скоби.[19]
В стандартната периодична таблица елементите са изброени в реда на нарастване на атомния номер. Нов ред (период) започва, когато нова електронна обвивка има своя първи електрон. Колоните (групите) се определят от електронната конфигурация на атома. Елементи с един и същ брой електрони в определена подгрупа попадат в същите колони (например кислород и селен са в същата колона, защото и двата елемента имат четири електрона в най-външния си слой). Елементи със сходни химични свойства по принцип попадат в същата група в периодичната таблица, въпреки че в f-блока и до известна степен в d-блок, елементите в същия период имат сходни свойства. По този начин е относително лесно да се предвидят химичните свойства на даден елемент, ако човек знае свойствата на елементите около него.[20]
Към 2016 г. периодичната таблица има 118 потвърдени елемента, от елемент 1 (водород) до 118 (оганесон). Елементи 113, 115, 117 и 118 са официално потвърдени от Международния съюз по чиста и приложна химия (IUPAC) през декември 2015 г.[21] Техните предложени имена, нихоний (Nh), московий (Mc), тенесин (Ts) и оганесон (Og), съответно са обявени от IUPAC през юни 2016 г. и стават официални през декември 2016 г.[22]
Първите 94 елемента се срещат в природата. Останалите 24 се появяват само когато се синтезират в лаборатории.
Група или семейство е вертикална колона в периодичната таблица. Групите обикновено имат по-значими периодични тенденции от периодите и блоковете. Модерните квантови механични теории на атомната структура обясняват груповите тенденции, като предлагат елементите в рамките на една и съща група да имат същите електронни конфигурации в тяхната валентна обвивка.[23] Следователно, елементите в същата група имат сходни химични свойства и проявяват ясна тенденция в тези свойства с нарастващ атомен номер.[24] Въпреки това в някои части на периодичната таблица, като d-блока и f-блока, хоризонталните прилики могат да бъдат толкова важни, колкото и вертикалните, дори по-изразени.[25][26][27]
В международната конвенция за наименуване групите са номерирани от 1 до 18 от най-лявата колона (алкалните метали) до най-дясната колона (благородните газове).[28] До 1988 г. групите са означавани с римски цифри. В Америка римските цифри са последвани от „А“, ако групата е в s- или p-блок, или „B“, ако групата е в d-блок. Използваните римски цифри съответстват на последната цифра от днешната конвенция за наименуване (например елементите от група 4 са група IVB, а елементите от група 14 са група IVA). В Европа буквите са сходни, с изключение на това, че „А“ се използва, ако групата е преди група 10, а „B“ е използвана за групи след група 10, включително 10. Освен това групи 8, 9 и 10 са третирани като една тройна група, позната колективно в двете означения като група VIII. От 1988 г. се използва новата система за именуване на IUPAC и старите имена на групите са изоставени.[29]
Елементите в една и съща група са склонни да проявяват тенденции в радиуса на атома, йонизационната енергия и електроотрицателността. От горе надолу в групата се увеличават атомните радиуси на елементите. Тъй като има повече запълнени енергийни нива, валентните електрони се намират далеч от ядрото. От върха, всеки следващ елемент има по-ниска йонизационна енергия, защото е по-лесно да се отстрани един електрон, по-малко свързан. По подобен начин, една група има от горе надолу намаляване на електроотрицателността поради нарастващото разстояние между валентните електрони и ядрото. Съществуват изключения от тези тенденции, като пример за това се посочва група 11, където електроотрицателността се увеличава.
В контекста на Периодичната система, един период представлява пълен хоризонтален ред от таблицата с химични елементи. Всеки период започва с метал и завършва с благороден газ, а от гледна точка на електронната конфигурация на атомите, всеки период започва с изграждането на нов електронен слой. Въпреки че групите обикновено имат по-значими периодични тенденции, има региони, където хоризонталните тенденции са по-значими от тенденциите на вертикалните групи, като f-блока, където лантанидите и актинидите образуват две значими хоризонтални серии от елементи.[30]
Елементи от един и същ период показват тенденции в атомния радиус, йонизационната енергия, електронното сродство и електроотрицателността. Придвижвайки се от ляво надясно през определен период, атомният радиус обикновено намалява. Това се случва, защото всеки следващ елемент има добавен един протон и един електрон, което кара електронът да бъде привлечен от ядрото.[31] Това намаление на атомния радиус също води до повишаване на йонизационната енергия при преместване от ляво надясно в даден период. Колкото по-плътно е свързан един елемент, толкова повече енергия се изисква за отстраняване на електрона. Електронегативността се увеличава по същия начин като йонизационната енергия, поради привличането на електроните от ядрото. Електронното сродство също показва лека тенденция. Металите (лявата страна на периода) обикновено имат по-ниско сродство на електрони от неметалите (от дясната страна на периода), с изключение на благородните газове.[32]
Специфични области на периодичната таблица могат да се нарекат блокове във връзка с последователността, в която се запълват електронните слоеве на елементите. Наименованията на блоковете съвпада с наименованието на характеристичната орбитала, заемана от валентните електрони. S-блокът се състои от първите две групи (алкални метали и алкалоземни метали), както и водород и хелий. P-блокът се състои от последните шест групи, които са групи 13 до 18 според номерирането на IUPAC (3А до 8А в номерирането на американски групи) и съдържа, наред с другите елементи, всички металоиди. D-блокът съдържа групи от 3 до 12 (или 3B до 2B в американската номерация на групи) и съдържа всички преходни метали. F-блокът включва лантаниди и актиниди.[33] Наименованията на блоковете и орбиталите (s, p, d, f и g), на свой ред, е свързано с характеристиките на спектралните им линии: sharp (остра), principal (главна), diffuse (дифузна) и fundamental (фундаментална).
1s 2s 2p 2p 2p 3s 3p 3p 3p 4s 3d 3d 3d 3d 3d 4p 4p 4p 5s 4d 4d 4d 4d 4d 5p 5p 5p 6s 4f 4f 4f 4f 4f 4f 4f 5d 5d 5d 5d 5d 6p 6p 6p 7s 5f 5f 5f 5f 5f 5f 5f 6d 6d 6d 6d 6d 7p 7p 7p |
Химичните елементи със сходни свойства могат да бъдат наричани с колективно наименование.
IUPAC одобрява 9 колективни наименования на елементи с общи свойства – алкални метали (Li, Na, K, Rb, Cs, Fr), алкалоземни метали (Ca, Sr, Ba, Ra), пниктогени (пникогени) (N, P, As,Sb, Bi), халкогени (O, S, Se, Te, Po), халогени (F, Cl, Br, I, At), благородни газове (He, Ne, Ar, Kr, Xe, Rn, Og), редкоземни метали (Sc, Y и лантаноидите), лантаниди (La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu) и актиниди (Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr).[34]
През 1966 г. Глен Сиборг предлага Съвременна таблица на химичните елементи, в състава на която влизат елементите от 8-ия период и суперактинидите – елементите с пореден номер от 121 до 153.[2]
Електронната конфигурация е разпределението на електроните по слоеве, подслоеве и атомни орбитали. Тя се означава с електронна формула и енергийна диаграма. Може да бъде пълна и непълна. Атомните орбитали се изразяват с квантови клетки, а електроните – със стрелки, обозначаващи спина на електрона.
Всеки един атом може да се разглежда като сфера, за която е характерен атомен радиус (Ra). Атомният радиус е равен на половината от разстоянието между ядрата на 2 атома. По период с нарастване на поредния номер, намаляват атомните радиуси на атомите на химичните елементи. В А групите с увеличаване на поредния номер, нараства атомният радиус. За металите са характерни големи атомни радиуси, а за неметалите – малки. Като резултат от намаляването на атомните радиуси е нарастване на окислителната способност на елементите, а като резултат от увеличаването му – редукционната способност на елементите.
Електроотрицателността (χ) е способността на атомите на химичните елементи да привличат към себе си електроните на другите атоми. В периода с увеличаване на поредния номер, електроотрицателността расте. В А групите с увеличаване на поредния номер електроотрицателността намалява. Така най-електроотрицателен елемент е флуорът, а най-неелектроотрицателен е цезият.
Йонизационна енергия (I) е енергията, необходима за откъсването на най-слабо свързания електрон от атом в основно състояние. С нарастване на поредния номер в периода расте и йонизационната енергия. С нарастване на поредния номер в А групите намалява йонизационната енергия. Измерва се в електронволти (eV) или в kJ/mol.
Електронното сродство (F), известно още и като електроафинитет (A), е енергията, която се поглъща или отделя при присъединяване на електрон към електронната обвивка на атом в основно състояние. Измерва се в електронволти (eV).
В главните подгрупи с нарастването на поредния номер на елемента металният му характер се засилва, а неметалният – отслабва. В периода с нарастването на поредния номер се преминава от елементи с метален, през елементи с амфотерен до елементи с неметален характер, или свойствата се променят плавно от метални към неметални. Всеки период завършва с благороден газ (VIIIA група).
| Група | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Период | ||||||||||||||||||
| 1 | + H |
+ He | ||||||||||||||||
| 2 | + Li |
+ Be |
+ B |
+ C |
+ N |
+ O |
+ F |
+ Ne | ||||||||||
| 3 | + Na |
+ Mg |
+ Al |
+ Si |
+ P |
+ S |
+ Cl |
+ Ar | ||||||||||
| 4 | + K |
+ Ca |
+ Sc |
+ Ti |
+ V |
+ Cr |
+ Mn |
+ Fe |
+ Co |
+ Ni |
+ Cu |
+ Zn |
+ Ga |
+ Ge |
+ As |
+ Se |
+ Br |
+ Kr |
| 5 | + Rb |
+ Sr |
+ Y |
+ Zr |
+ Nb |
+ Mo |
+ Tc |
+ Ru |
+ Rh |
+ Pd |
+ Ag |
++ Cd |
+ In |
+ Sn |
+ Sb |
+ Te |
+ I |
+ Xe |
| 6 | + Cs |
+ Ba |
* La-Lu |
++ Hf |
+ Ta |
+ W |
++ Re |
+ Os |
+ Ir |
+ Pt |
+ Au |
+ Hg |
++ Tl |
+ Pb |
+ Bi |
+ Po |
+ At |
+ Rn |
| 7 | + Fr |
+ Ra |
** Ac-Lr |
+ Rf |
++ Db |
++ Sg |
++ Bh |
+ Hs |
+ Mt |
+ Ds |
+ Rg |
++ Cn |
+ Nh |
+ Fl |
+ Mc |
+ Lv |
+ Ts |
+ Og |
| * Лантаниди | + La |
++ Ce |
+ Pr |
+ Nd |
+ Pm |
+ Sm |
+ Eu |
+ Gd |
+ Tb |
+ Dy |
+ Ho |
+ Er |
+ Tm |
+ Yb |
+ Lu | |||
| ** Актиниди | + Ac |
+ Th |
+ Pa |
+ U |
+ Np |
+ Pu |
+ Am |
+ Cm |
+ Bk |
++ Cf |
++ Es |
++ Fm |
++ Md |
+ No |
+ Lr | |||
| преди 1800 | 1800 – 1849 | 1850 – 1899 | 1900 – 1949 | 1950 – 1999 | след 2000 |
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.